名校
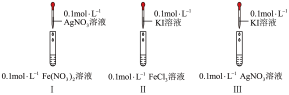
1 . 通过如下实验,比较 、
、 、
、 的氧化性。
的氧化性。
(1)实验室 溶液通常盛放在
溶液通常盛放在___________ 试剂瓶中。
(2)Ⅱ中反应的离子方程式为___________ 。
(3)I、Ⅱ中的现象说明___________。
(4)实验后,I试管壁上的黑色沉淀可用___________洗去。
(5)写出检验I中是否含有 的方法。
的方法。___________ 。
(6)检验Ⅱ中是否含有 不可选用:___________。(不定项)
不可选用:___________。(不定项)
(7)推测Ⅲ中未发生 氧化
氧化 的原因
的原因___________ 。
 、
、 、
、 的氧化性。
的氧化性。
| 实验现象 |
I中产生黑色沉淀,滴加 溶液,变红 溶液,变红 | |
| Ⅱ中溶液呈棕黄色,滴加淀粉溶液,变蓝 | |
| Ⅲ中产生黄色沉淀,滴加淀粉溶液,未变蓝 |
(1)实验室
 溶液通常盛放在
溶液通常盛放在(2)Ⅱ中反应的离子方程式为
(3)I、Ⅱ中的现象说明___________。
A.氧化性顺序: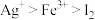 | B.氧化性顺序: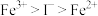 |
C.还原性顺序: | D.还原性顺序: |
(4)实验后,I试管壁上的黑色沉淀可用___________洗去。
| A.酒精 | B.二硫化碳 | C.浓硝酸 | D.热盐酸 |
(5)写出检验I中是否含有
 的方法。
的方法。(6)检验Ⅱ中是否含有
 不可选用:___________。(不定项)
不可选用:___________。(不定项)| A.氢氧化钠溶液 | B.酸性高辒酸钾溶液 | C.硫氰化钾溶液 | D.稀氨水 |
(7)推测Ⅲ中未发生
 氧化
氧化 的原因
的原因
您最近一年使用:0次
名校
解题方法
2 . 配制溶液:
称量→溶解→冷却→操作①→洗涤→注入→混匀→操作②→摇匀→装瓶贴标签
(1)操作①为___________ 、操作②为___________ 。
(2)用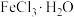 配制
配制 溶液时,应称量
溶液时,应称量___________ g固体(保留两位小数),需要的定量仪器为___________ 。
(3)配置溶液时,不慎掉入镀层缺损的镀铜小铁钉,写出可能发生的反应的离子方程式___________ 。
称量→溶解→冷却→操作①→洗涤→注入→混匀→操作②→摇匀→装瓶贴标签
(1)操作①为
(2)用
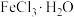 配制
配制 溶液时,应称量
溶液时,应称量(3)配置溶液时,不慎掉入镀层缺损的镀铜小铁钉,写出可能发生的反应的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 某同学为了验证Fe2+是否能将H2SO3氧化成 ,用50mL,0.1mol/LFeCl3溶液吸收一定量的
,用50mL,0.1mol/LFeCl3溶液吸收一定量的 气体后,进行以下实验:
气体后,进行以下实验:
(1)检验吸收液中是否含有 的操作为
的操作为_____________ 。
(2)请写出FeCl3吸收SO2的离子方程式:___________ ,反应中的氧化产物是__________ 。
(3)吸收液中除了含有H+、Cl-、 以外,该同学对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行了猜想和探究:
以外,该同学对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行了猜想和探究:
①提出假设。
假设1:溶液中存在Fe2+
假设2:溶液中存在Fe3+、Fe2+
假设3:溶液中存在__________ 。
②设计方案,进行实验,验证假设。
请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1mol/LKMnO4溶液、0.1mol/LKSCN溶液、品红溶液。
 ,用50mL,0.1mol/LFeCl3溶液吸收一定量的
,用50mL,0.1mol/LFeCl3溶液吸收一定量的 气体后,进行以下实验:
气体后,进行以下实验:(1)检验吸收液中是否含有
 的操作为
的操作为(2)请写出FeCl3吸收SO2的离子方程式:
(3)吸收液中除了含有H+、Cl-、
 以外,该同学对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行了猜想和探究:
以外,该同学对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行了猜想和探究:①提出假设。
假设1:溶液中存在Fe2+
假设2:溶液中存在Fe3+、Fe2+
假设3:溶液中存在
②设计方案,进行实验,验证假设。
请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1mol/LKMnO4溶液、0.1mol/LKSCN溶液、品红溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,滴入 | 若 |
| 步骤2: | 若 |
| 步骤3(可补充): |
您最近一年使用:0次
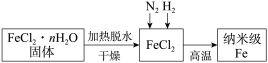
4 . 纳米材料一直是人们研究的重要课题,例如纳来级Fe粉表面积大,具有超强的磁性,高效的催化性等优良性质。
Ⅰ.实验室采用气相还原法制备纳米级Fe,其流程如图所示:____________ 。
Ⅱ.查阅资料得知:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570°C时生成FeO,高于570°C时生成Fe3O4。甲同学用图甲所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。________________ 。
(3)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。丙同学认为乙同学的结论不正确,他的理由是_________ (用简要文字描述)。
(4)丁同学称取5.60gFe粉,用乙装置反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为_______ (结果保留三位有效数字)。
Ⅰ.实验室采用气相还原法制备纳米级Fe,其流程如图所示:
Ⅱ.查阅资料得知:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570°C时生成FeO,高于570°C时生成Fe3O4。甲同学用图甲所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(3)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到的黑色粉末X(假定为均匀的)。取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
(4)丁同学称取5.60gFe粉,用乙装置反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 标准状况下,将SO2和Cl2组成的混合气体a L通入200mL 0.1mol·L-1 Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅(溶液体积近似不变)。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则下列分析错误的是(已知:SO2+2Fe3++2H2O=SO +2Fe2++4H+)
+2Fe2++4H+)
 +2Fe2++4H+)
+2Fe2++4H+)| A.a L混合气体的物质的量可能为0.08mol |
| B.混合气体中SO2的体积为0.896L |
| C.所得沉淀为0.1mol的BaSO4 |
| D.混合气体中Cl2的物质的量可能为0.03mol |
您最近一年使用:0次
2023-02-16更新
|
1813次组卷
|
3卷引用:上海市复旦大学附属中学2022-2023学年高一上学期2月期末考试化学试题
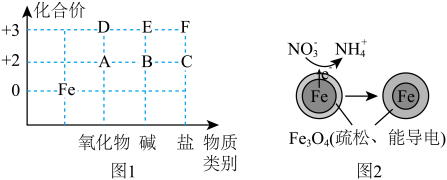
6 . 从化合价和物质类别两个视角认识元素及其化合物性质是重要的化学学习方式。图1是 及其化合物的化合价—物质类别二维图。
及其化合物的化合价—物质类别二维图。
回答下列问题:
(1)工业上冶炼 常用的方法是
常用的方法是_______ (填字母)。
a.电解法 b.还原法 c.热分解法 d.物理方法
(2)若图1中的F为硫酸盐,请写出由D生成F的离子方程式:_______ 。
(3)图1中的B在潮湿的空气中很容易发生化合反应变成E,该反应的化学方程式为_______ 。
(4)图1中的F与C在水溶液中转化的离子反应有: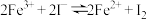 ,为了探究该反应存在一定的限度,某化学兴趣小组取
,为了探究该反应存在一定的限度,某化学兴趣小组取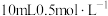 的
的 溶液于试管中,再加入
溶液于试管中,再加入 的
的 溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_______(填字母)。
溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_______(填字母)。
(5)用 可以去除水体中的
可以去除水体中的 (原理如图2)。若有
(原理如图2)。若有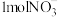 转化为
转化为 ,则参加反应的
,则参加反应的 失去的电子的物质的量为
失去的电子的物质的量为_______  。
。
 及其化合物的化合价—物质类别二维图。
及其化合物的化合价—物质类别二维图。
回答下列问题:
(1)工业上冶炼
 常用的方法是
常用的方法是a.电解法 b.还原法 c.热分解法 d.物理方法
(2)若图1中的F为硫酸盐,请写出由D生成F的离子方程式:
(3)图1中的B在潮湿的空气中很容易发生化合反应变成E,该反应的化学方程式为
(4)图1中的F与C在水溶液中转化的离子反应有:
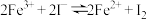 ,为了探究该反应存在一定的限度,某化学兴趣小组取
,为了探究该反应存在一定的限度,某化学兴趣小组取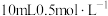 的
的 溶液于试管中,再加入
溶液于试管中,再加入 的
的 溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_______(填字母)。
溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_______(填字母)。| A.淀粉溶液 | B. 溶液 溶液 | C. | D.酸性高锰酸钾溶液 |
 可以去除水体中的
可以去除水体中的 (原理如图2)。若有
(原理如图2)。若有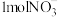 转化为
转化为 ,则参加反应的
,则参加反应的 失去的电子的物质的量为
失去的电子的物质的量为 。
。
您最近一年使用:0次
2023-02-08更新
|
291次组卷
|
2卷引用:上海市控江中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
7 . 某无色溶液中存在大量的Ba2+、OH-、I-,则该溶液中还可能大量存在的离子是
A. | B. | C. | D. |
您最近一年使用:0次
2023-01-04更新
|
201次组卷
|
3卷引用:上海市复旦大学附属中学2021-2022学年高一上学期期末考试化学试题
名校
8 . 按如图装置进行实验。在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,II中有气泡冒出;一段时间后,关闭止水夹,II中液面上升,原无色溶液变浑浊。符合以上实验现象的I和II中对应的试剂为
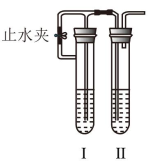

| A | B | C | D | |
| I | FeS、稀 | 铁粉、稀 | 铝片、浓 | Cu、浓 |
| II |  溶液 溶液 | 氨水 |  溶液 溶液 |  溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-15更新
|
258次组卷
|
3卷引用:上海市复旦大学附属中学2021-2022学年高一下学期期中考化学试题
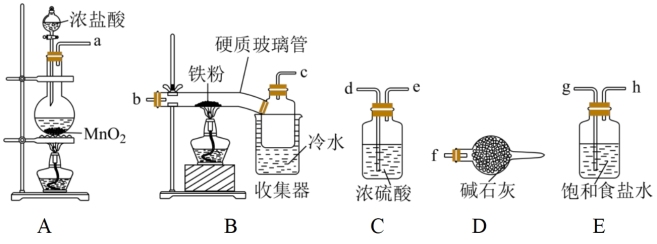
9 . 已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。_______ 。
(2)B中收集器里盛放冷水的作用是_______ 。D中碱石灰的作用是_______ 、_______ 。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸,充分反应后,进行如下实验:
固体混合物 淡黄色溶液
淡黄色溶液 淡红色溶液
淡红色溶液 深红色溶液
深红色溶液 红色褪去
红色褪去
①试剂X为_______ (填化学式)。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是_______ 。
(4)该小组同学对上述溶液红色褪去的原因进行探究。
①取褪色后的溶液三份,分别进行以下实验,研究溶液中存在的微粒。
a.一份中滴加FeCl3溶液无明显变化,说明_______ ;
b.另一份滴加试剂X,溶液出现红色,说明_______ ;
c.还有一份滴加稀盐酸和BaCl2溶液,产生白色沉淀,说明_______ 。
②另取FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。实验②的目的是_______ ;得出结论:_______ 。
(2)B中收集器里盛放冷水的作用是
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸,充分反应后,进行如下实验:
固体混合物
 淡黄色溶液
淡黄色溶液 淡红色溶液
淡红色溶液 深红色溶液
深红色溶液 红色褪去
红色褪去①试剂X为
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是
(4)该小组同学对上述溶液红色褪去的原因进行探究。
①取褪色后的溶液三份,分别进行以下实验,研究溶液中存在的微粒。
a.一份中滴加FeCl3溶液无明显变化,说明
b.另一份滴加试剂X,溶液出现红色,说明
c.还有一份滴加稀盐酸和BaCl2溶液,产生白色沉淀,说明
②另取FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。实验②的目的是
您最近一年使用:0次
2022-07-02更新
|
1043次组卷
|
4卷引用:上海市控江中学2021-2022学年高一下学期期末考试化学试题
上海市控江中学2021-2022学年高一下学期期末考试化学试题上海市复兴高级中学2022-2023学年高一下学期5月学科能力评估化学试题(已下线)专题01 金属及其化合物 -【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(上海专用)河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题
解题方法
10 . 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。
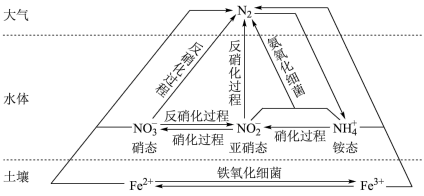
(1)氮循环中,属于氮的固定的有_______ (填字母序号,下同),属于氧化反应的有_______ 。
a. 转化为氨态氮 b.硝化过程 c.反硝化过程
转化为氨态氮 b.硝化过程 c.反硝化过程
(2)铵态氮肥是水体中铵根的主要来源之一。氨气溶于水也能产生铵根,此过程中发生的反应有(用方程式表示)_______ ,检验某固态氮肥中铵根的实验操作与相应的现象及结论为_______ 。
(3)铵态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移电子的物质的量为_______ 。
(4)土壤中的铁循环可用于水体脱氮(指将氮元素从水体中除去),原理为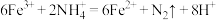 ,证明铁离子存在的实验操作及现象为:
,证明铁离子存在的实验操作及现象为:_______ 。
(5)实验室中也可以实现不同价态氮元素之间的转变,请写出符合以下要求的化学方程式:
①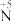 转化为
转化为 :
:_______
②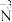 转化为
转化为 :
:_______

(1)氮循环中,属于氮的固定的有
a.
 转化为氨态氮 b.硝化过程 c.反硝化过程
转化为氨态氮 b.硝化过程 c.反硝化过程(2)铵态氮肥是水体中铵根的主要来源之一。氨气溶于水也能产生铵根,此过程中发生的反应有(用方程式表示)
(3)铵态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移电子的物质的量为
(4)土壤中的铁循环可用于水体脱氮(指将氮元素从水体中除去),原理为
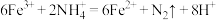 ,证明铁离子存在的实验操作及现象为:
,证明铁离子存在的实验操作及现象为:(5)实验室中也可以实现不同价态氮元素之间的转变,请写出符合以下要求的化学方程式:
①
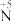 转化为
转化为 :
:②
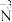 转化为
转化为 :
:
您最近一年使用:0次