1 . 根据所学知识填空
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:___________ 。
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
(3)向1mol KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀的物质的量最大时的离子方程式___________
(4)现有以下四种物质:
请根据题意选择恰当的选项用字母代号填空。
①可与KSCN溶液反应,溶液变红的是___________ ;
②常用于焙制糕点,也可用作抗酸药的是___________ ;
③可用于制备硅胶和木材防火剂的是___________ ;
④可用于制造计算机芯片的是___________ 。
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
| A.黄绿色 | B.洋红色 | C.紫红色 | D.绿色 |
(4)现有以下四种物质:
| A.Si | B.FeCl3 | C.NaHCO3 | D.Na2SiO3 |
①可与KSCN溶液反应,溶液变红的是
②常用于焙制糕点,也可用作抗酸药的是
③可用于制备硅胶和木材防火剂的是
④可用于制造计算机芯片的是
您最近一年使用:0次
名校
解题方法
2 . 研究人员拟设计黄铜矿(主要含CuFeS2)制备硝酸铜和绿矾晶体的流程如下:
(1)CuFeS2中铁元素的化合价为___________ 价,已知“焙烧”生成SO2、CuO和Fe2O3,则其化学反应方程式为___________ 。
(2)“置换”步骤中发生的所有反应的离子方程式有___________ 、Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑。
(3)流程中“操作 A”所需的玻璃仪器有_____________ 。
(4)“浸洗”步骤中加溶液A 的目的是_______________ 。
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:___________ 。
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为_______________ 。
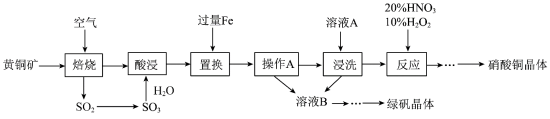
(1)CuFeS2中铁元素的化合价为
(2)“置换”步骤中发生的所有反应的离子方程式有
(3)流程中“操作 A”所需的玻璃仪器有
(4)“浸洗”步骤中加溶液A 的目的是
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为
您最近一年使用:0次
解题方法
3 . 纳米磁性 在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性
在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性 的工艺流程如下:
的工艺流程如下: 溶于强碱时生成
溶于强碱时生成 。
。
(1)“碱洗”废旧镀锌铁皮的目的是___________(填字母)。
(2)“酸溶”后的溶液中阳离子主要有___________ 。
(3)“氧化”时发生的总反应离子方程式为___________ 。在酸性条件下, 很容易发生反应:
很容易发生反应: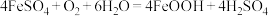 。为避免生成
。为避免生成 影响产品纯度,则“氧化”时应选择的加料方式为
影响产品纯度,则“氧化”时应选择的加料方式为___________ 。
(4)“氧化”后溶液中 的物质的量之比是1∶2,检验其中
的物质的量之比是1∶2,检验其中 可选用的试剂是___________。
可选用的试剂是___________。
(5)“分离”时 纳米粒子不能采用过滤法实现固液分离,理由是
纳米粒子不能采用过滤法实现固液分离,理由是___________ 。
(6)用重铬酸钾法(一种氧化还原滴定法)可测定产物 中的二价铁含量。若需配制浓度为
中的二价铁含量。若需配制浓度为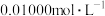 的
的 标准溶液
标准溶液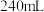 ,应准确称取
,应准确称取___________ g (保留4位有效数字,已知
(保留4位有效数字,已知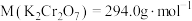 )。
)。
 在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性
在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性 的工艺流程如下:
的工艺流程如下:
 溶于强碱时生成
溶于强碱时生成 。
。(1)“碱洗”废旧镀锌铁皮的目的是___________(填字母)。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化铁皮 |
(2)“酸溶”后的溶液中阳离子主要有
(3)“氧化”时发生的总反应离子方程式为
 很容易发生反应:
很容易发生反应: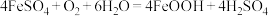 。为避免生成
。为避免生成 影响产品纯度,则“氧化”时应选择的加料方式为
影响产品纯度,则“氧化”时应选择的加料方式为(4)“氧化”后溶液中
 的物质的量之比是1∶2,检验其中
的物质的量之比是1∶2,检验其中 可选用的试剂是___________。
可选用的试剂是___________。A. 溶液 溶液 | B. 溶液 溶液 | C.酸性 溶液 溶液 | D. |
(5)“分离”时
 纳米粒子不能采用过滤法实现固液分离,理由是
纳米粒子不能采用过滤法实现固液分离,理由是(6)用重铬酸钾法(一种氧化还原滴定法)可测定产物
 中的二价铁含量。若需配制浓度为
中的二价铁含量。若需配制浓度为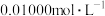 的
的 标准溶液
标准溶液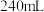 ,应准确称取
,应准确称取 (保留4位有效数字,已知
(保留4位有效数字,已知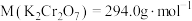 )。
)。
您最近一年使用:0次
4 . 某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、Fe、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取甲进行连续实验。实验过程及现象如下:
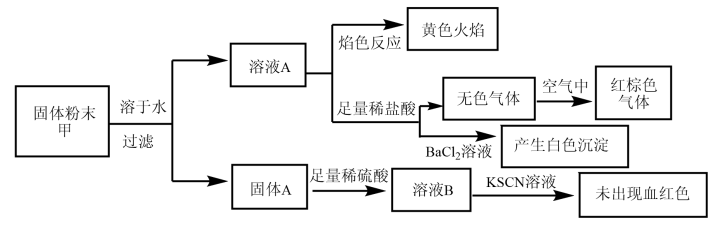
| A.固体粉末中含有钠元素,但不含钾元素 |
| B.固体粉末中无法确定是否含有K2SO3 |
| C.固体粉末中至少含有KNO3、NaNO2中的一种 |
| D.固体粉末中可能含有K2CO3、不含Fe2O3 |
您最近一年使用:0次
5 . Ⅰ.某小组利用数字化实验模拟制备Fe(OH)2并探究其相关性质。
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是_____ ,Na2SO3的作用是_____ 。
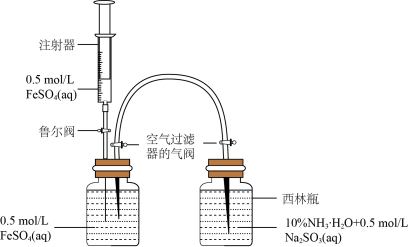
(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化, 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。

对比ab、bc段溶解氧的消耗速率,可以得出什么结论_____ 。
(3)已知:在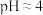 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且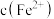 降低量大于
降低量大于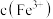 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因_____ ,检验反应后的溶液中是否存在 ,可以选择的试剂是
,可以选择的试剂是_____ 。
A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是_____ 。
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是

(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化,
 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。
对比ab、bc段溶解氧的消耗速率,可以得出什么结论
(3)已知:在
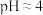 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且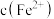 降低量大于
降低量大于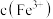 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因 ,可以选择的试剂是
,可以选择的试剂是A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
 |  | 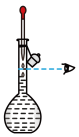 | 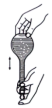 |
| A.称量 | B.转移 | C、定容 | D、摇匀 |
| A.A | B.B | C.C | D.D |
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
您最近一年使用:0次
解题方法
6 . 元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。

请回答以下问题:
(1)K2FeO4中Fe的化合价为_____ 。
(2) 是一种新型水处理剂,将
是一种新型水处理剂,将 溶液、
溶液、 溶液与
溶液与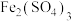 溶液混合可得到
溶液混合可得到 ,发生相应反应的离子方程式为
,发生相应反应的离子方程式为_____ ,当有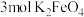 生成时,反应中转移的电子数目为
生成时,反应中转移的电子数目为_____  。
。
(3)Fe2O3是否为碱性氧化物_____ (填是或否),理由:_____ 。
(4)制备氢氧化亚铁时,观察到白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释该现象:_____ ,其中检验溶液中Fe3+的试剂是KSCN溶液,该反应的离子方程式为:_____ 。

请回答以下问题:
(1)K2FeO4中Fe的化合价为
(2)
 是一种新型水处理剂,将
是一种新型水处理剂,将 溶液、
溶液、 溶液与
溶液与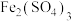 溶液混合可得到
溶液混合可得到 ,发生相应反应的离子方程式为
,发生相应反应的离子方程式为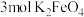 生成时,反应中转移的电子数目为
生成时,反应中转移的电子数目为 。
。(3)Fe2O3是否为碱性氧化物
(4)制备氢氧化亚铁时,观察到白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释该现象:
您最近一年使用:0次
名校
7 . 向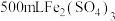 和
和 的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量的关系如图所示(忽略溶液体积的变化)。下列说法中正确的是
的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量的关系如图所示(忽略溶液体积的变化)。下列说法中正确的是
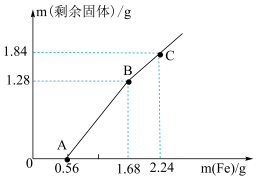
 和
和 的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量的关系如图所示(忽略溶液体积的变化)。下列说法中正确的是
的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量的关系如图所示(忽略溶液体积的变化)。下列说法中正确的是
A.AB段发生反应的离子方程式为 |
B.A点溶液中的金属阳离子为 |
C.原溶液中 与 与 的物质的量浓度之比为2:1 的物质的量浓度之比为2:1 |
D.C点溶液中溶质的物质的量浓度为 |
您最近一年使用:0次
2024-04-05更新
|
78次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高一下学期3月月考化学试题
名校
8 . 天然气是一种重要的化工原料和燃料,常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法不正确的是
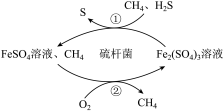

| A.脱硫过程中第①步会使溶液的酸性增强 |
| B.CH4是天然气脱硫过程的催化剂 |
| C.脱硫过程总反应方程式为:2H2S+O2=2S↓+2H2O |
| D.整个脱硫过程中参加反应的n(H2S)∶n(O2)=2∶1 |
您最近一年使用:0次
9 . 在一定条件下,某些物质具有如图所示的转化关系。丙为白色固体,其悬浊液在空气中会迅速变为灰绿色,最终变为红褐色。请回答下列问题: 表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
(1)根据分析可知丙为______ (填化学式);甲可能是______ (填标号,下同),乙可能是______ 。
A.稀硝酸 B. 溶液
溶液
C. D.
D. 溶液
溶液
(2)实验室保存 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量______ (填药品名称);可以用______ (填化学式)溶液来检验 溶液中的
溶液中的 是否被氧化。
是否被氧化。
(3)丙的悬浊液在空气中变色的原因为______ (填化学方程式);工业上高炉炼铁可以实现③的转化,所得到的炽热的铁水注入模具之前,模具必须进行充分的干燥处理,原因是______ (填化学方程式)。
(4)绿矾 常用于制备铁触媒催化剂。隔绝空气条件下,
常用于制备铁触媒催化剂。隔绝空气条件下, 绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至
绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至 时,绿矾发生反应的化学方程式为
时,绿矾发生反应的化学方程式为______ ;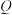 点对应的固体是一种金属氧化物,该物质的化学式为
点对应的固体是一种金属氧化物,该物质的化学式为______ 。
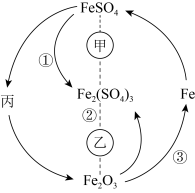
 表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。(1)根据分析可知丙为
A.稀硝酸 B.
 溶液
溶液C.
 D.
D. 溶液
溶液(2)实验室保存
 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量 溶液中的
溶液中的 是否被氧化。
是否被氧化。(3)丙的悬浊液在空气中变色的原因为
(4)绿矾
 常用于制备铁触媒催化剂。隔绝空气条件下,
常用于制备铁触媒催化剂。隔绝空气条件下, 绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至
绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至 时,绿矾发生反应的化学方程式为
时,绿矾发生反应的化学方程式为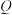 点对应的固体是一种金属氧化物,该物质的化学式为
点对应的固体是一种金属氧化物,该物质的化学式为
您最近一年使用:0次
2024-03-27更新
|
130次组卷
|
4卷引用:江西省部分地区2023-2024学年高一下学期3月月考化学试题
名校
10 . 下列物质的用途与性质不相对应的是
| 选项 | 物质的用途 | 物质的性质 |
| A | 博物馆将某些文物保存在N2中 | N2性质稳定 |
| B | 用FeCl3溶液刻蚀铜电路板 | 铁的金属性比铜强 |
| C | SO2用于保持葡萄酒的天然果香味 | SO2具有还原性 |
| D | 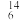 C用于测定文物年代 C用于测定文物年代 | 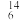 C具有放射性 C具有放射性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



