名校
解题方法
1 . 印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol/L,FeCl2 3.0 mol/L,FeCl3 1.0 mol/L,HCl 3.0 mol/L。取废腐蚀液200 mL按如下流程在实验室进行实验:

回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显_______ (填“红色”或“蓝色”、“紫色”),证明废液含有FeCl3。
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是_______ (填化学式)。
(3)操作Ⅰ是_______ ,该操作需用到的玻璃仪器有烧杯、普通漏斗和_______ 。
(4)FeCl2溶液中通入氯气,发生反应的离子方程式为_______ 。
(5)已知氧化性:Fe3+>Cu2+ >H+>Fe2+;往上述200 mL废腐蚀液中加入20g铁粉,边加边搅拌,是否有氢气产生_______ (填“是”、“否”)。

回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是
(3)操作Ⅰ是
(4)FeCl2溶液中通入氯气,发生反应的离子方程式为
(5)已知氧化性:Fe3+>Cu2+ >H+>Fe2+;往上述200 mL废腐蚀液中加入20g铁粉,边加边搅拌,是否有氢气产生
您最近一年使用:0次
2 . 硫酸亚铁在印染、医药、化肥等多个行业有广泛应用。某学习小组对硫酸亚铁晶体 的热分解产物进行探究。回答下列问题:
的热分解产物进行探究。回答下列问题:
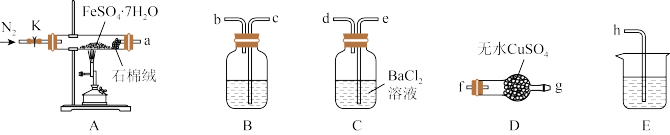
(1)装置A中石棉绒的作用为__________ 。
(2)按气流方向,上述装置合理的连接顺序为a→f、g→_____ →h(填装置口小写字母)。
(3)该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
(4)硫酸亚铁晶体分解的化学方程式为_________ 。
(5)设计实验证明A中得到的红色粉末不含+2价铁元素:_______ (简述实验操作及现象)。
 的热分解产物进行探究。回答下列问题:
的热分解产物进行探究。回答下列问题:
(1)装置A中石棉绒的作用为
(2)按气流方向,上述装置合理的连接顺序为a→f、g→
(3)该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
| 装置编号 | 填装试剂 | 实验现象 | 实验结论 |
| A | FeSO4·7H2O | 绿色固体逐渐变为红色粉末 | — |
| B | ① | ② | 分解产物中含有SO2 |
| C | BaCl2溶液 | 产生白色沉淀 | ③ |
| D | 无水CuSO4粉末 | 白色固体逐渐变为蓝色 | 分解产物中含有水蒸气 |
| E | ④ | — | — |
(5)设计实验证明A中得到的红色粉末不含+2价铁元素:
您最近一年使用:0次
2022-08-13更新
|
166次组卷
|
2卷引用:福建省龙岩北大附属实验学校2022-2023学年高三上学期第一次月考(平衡班)化学试题
名校
解题方法
3 . 硼泥主要由MgO和 组成,含有
组成,含有 、
、 、
、 、
、 等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
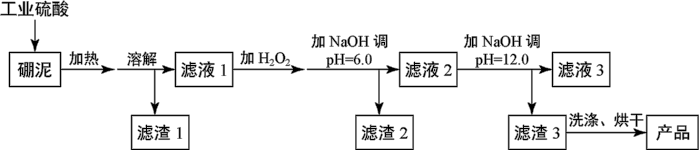
已知某些氢氧化物沉淀的pH如下表所示:
(1)滤渣1除含有 外,还含有
外,还含有___________ 。加入硫酸时 发生反应的离子方程式为:
发生反应的离子方程式为:___________ 。
(2)向滤液1中加入 ,发生反应的离子方程式为:
,发生反应的离子方程式为:___________ 。
(3)滤渣2的主要成分是___________ ,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为___________ 。
(4)证明滤渣3已洗涤干净的实验操作___________ 。
(5)若取a吨硼泥为原料,最后得到b吨 产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为
产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为___________ (用含有a、b的代数式表示)。
 组成,含有
组成,含有 、
、 、
、 、
、 等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
已知某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
 外,还含有
外,还含有 发生反应的离子方程式为:
发生反应的离子方程式为:(2)向滤液1中加入
 ,发生反应的离子方程式为:
,发生反应的离子方程式为:(3)滤渣2的主要成分是
(4)证明滤渣3已洗涤干净的实验操作
(5)若取a吨硼泥为原料,最后得到b吨
 产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为
产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为
您最近一年使用:0次
名校
4 . 选择合适的如下试剂组合,其中能证明Fe3+具有氧化性的是( )
供选试剂:①KSCN溶液 ②FeCl2溶液 ③氯水 ④NaOH溶液 ⑤Fe粉
供选试剂:①KSCN溶液 ②FeCl2溶液 ③氯水 ④NaOH溶液 ⑤Fe粉
| A.①⑤ | B.①③ | C.③④ | D.②③ |
您最近一年使用:0次
2019-12-26更新
|
57次组卷
|
2卷引用:福建省漳平市第一中学2019-2020学年高一上学期第二次月考化学试题
5 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
5620次组卷
|
40卷引用:【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题
【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省双流中学高三上学期10月月考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届海南省海南中学高三上学期月考三化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2017届四川省泸州市泸化中学高三上10月月考化学卷2016-2017学年北京五十六中九高三上学期期中考试化学试卷天津市南开区2017届高三高考二模化学试卷黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题甘肃省会宁县第一中学2018届高三上学期第三次月考理科综合化学试题青海省西宁二十一中2018届高三上学期12月月考化学试卷黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测广东省韶关市2019-2020学年高二下学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)四川省邻水实验学校2022届高三上学期入学考试理综化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)第三章 金属及其化合物 第13讲 铁及其重要化合物(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)第一部分 化学综合实验 热点6 物质性质探究实验
解题方法
6 . Fe、Ca是重要的金属元素。运用所学知识,回答下列问题。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:____________________ ;
(2)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是____________________ ;
②验证该溶液中含有Fe2+,正确的实验方法是____________________ ;
A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
C.观察溶液是否呈浅绿色
(3)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。
(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
①配制5.0×10-3 mol·L-1KMnO4200mL溶液,需要称取KMnO4固体的质量是____________________ g;
②每消耗草酸0.5mol,转移电子的物质的量为____________________ mol;
③此人血液中的Ca2+的浓度为____________________ mol·L-1。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:
(2)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是
②验证该溶液中含有Fe2+,正确的实验方法是
A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
C.观察溶液是否呈浅绿色
(3)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。
(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
①配制5.0×10-3 mol·L-1KMnO4200mL溶液,需要称取KMnO4固体的质量是
②每消耗草酸0.5mol,转移电子的物质的量为
③此人血液中的Ca2+的浓度为
您最近一年使用:0次
7 . 打印机墨粉中的Fe3O4含量是衡量墨粉质量优劣的重要指标之一,为测定墨粉中Fe3O4的含量,进行了如下实验:

已知:①墨粉中除了Fe3O4晶体粉粒外,其余成分均不溶于水且不与酸反应,
②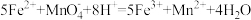 。下列有关说法正确的是
。下列有关说法正确的是

已知:①墨粉中除了Fe3O4晶体粉粒外,其余成分均不溶于水且不与酸反应,
②
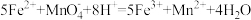 。下列有关说法正确的是
。下列有关说法正确的是| A.试剂是Zn粉,且要缓慢加入至观察到较多气泡产生时停止加入Zn粉 |
B.用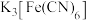 溶液能检验溶液②只含有Fe2+ 溶液能检验溶液②只含有Fe2+ |
| C.若溶解过滤后没有洗涤,则Fe3O4含量测定结果偏大 |
D.墨粉中的Fe3O4的含量为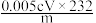 |
您最近一年使用:0次
名校
解题方法
8 . 下列有关离子大量共存的说法正确的是
A.H+、Fe2+、SO 、NO 、NO 因发生氧化还原反应而不能大量共存 因发生氧化还原反应而不能大量共存 |
B.澄清透明的无色溶液中,ClO-、MnO 、Al3+、SO 、Al3+、SO 可能大量共存 可能大量共存 |
C.在含大量Fe3+的溶液中,NH 、Na+、Cl-、SCN-可能大量共存 、Na+、Cl-、SCN-可能大量共存 |
D.使石蕊试液变红的溶液中,Na+、Cl-、SO 、HCO 、HCO 可以大量共存 可以大量共存 |
您最近一年使用:0次



