解题方法
1 . 下列关于物质或离子的检验,说法正确的是
A.在某溶液中加入 溶液出现白色沉淀,证明原溶液中有 溶液出现白色沉淀,证明原溶液中有 |
B.在某溶液中加入稀硫酸产生能使澄清石灰水变浑浊的气体,证明原溶液一定含 |
C.在实验室里可用 溶液检验两瓶无色溶液碳酸钠和碳酸氢钠 溶液检验两瓶无色溶液碳酸钠和碳酸氢钠 |
D.向某溶液里先加氯水再加KSCN溶液可以检验 存在 存在 |
您最近一年使用:0次
名校
解题方法
2 . 某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的花肥的主要成分及性质。首先对该花肥的主要成分进行了如下假设:
a.只含有 b.含有
b.含有 和
和 c.只含有
c.只含有
将花肥固体粉末溶于水中得到溶液 ,然后进行如下实验:
,然后进行如下实验:
(1)提出假设 的依据是
的依据是___________ (用离子方程式表示)。
(2)实验Ⅰ的预期现象是先产生白色沉淀,然后变成灰绿色,最后变成红褐色沉淀,产生该预期现象的依据是___________ (用化学方程式和离子方程式表示)。
(3)实验Ⅱ中所加试剂的名称是___________ ,由此得出的结论是___________ 。
(4)为进一步验证假设,该小组同学进行了如下实验:
实验Ⅳ中新制氯水参加反应的离子方程式是___________ 。
(5)通过以上实验,可得到的结论是___________ 。还可以通过实验___________ 证明 的存在(填具体的操作及现象)。
的存在(填具体的操作及现象)。
a.只含有
 b.含有
b.含有 和
和 c.只含有
c.只含有
将花肥固体粉末溶于水中得到溶液
 ,然后进行如下实验:
,然后进行如下实验:| 实验序号 | 操作 | 现象 |
| Ⅰ | 取 溶液 溶液 ,加入 ,加入 的 的 溶液 溶液 | 产生红褐色沉淀 |
| Ⅱ | 取 溶液 溶液 ,加入1滴___________溶液 ,加入1滴___________溶液 | 溶液显红色 |
 的依据是
的依据是(2)实验Ⅰ的预期现象是先产生白色沉淀,然后变成灰绿色,最后变成红褐色沉淀,产生该预期现象的依据是
(3)实验Ⅱ中所加试剂的名称是
(4)为进一步验证假设,该小组同学进行了如下实验:
| 实验序号 | 操作 | 现象 |
| Ⅲ | 取 溶液 溶液 ,加入1滴 ,加入1滴 溶液,再加入 溶液,再加入 水 水 | 溶液显红色 |
| Ⅳ | 取 溶液 溶液 ,加入1滴 ,加入1滴 溶液,再加入 溶液,再加入 新制氯水 新制氯水 | 溶液显红色,且颜色比实验而的深 |
(5)通过以上实验,可得到的结论是
 的存在(填具体的操作及现象)。
的存在(填具体的操作及现象)。
您最近一年使用:0次
名校
3 . 下列实验目的对应的方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 探究金属钠在氧气中燃烧所得固体成分 | 取少量加热后的固体,加入适量蒸馏水 | 若有气泡产生,则证明燃烧后的固体为 |
| B | 探究干燥 是否具有漂白性 是否具有漂白性 | 将鲜花投入盛有干燥氯气的集气瓶中 | 鲜花褪色,说明干燥氯气具有漂白性 |
| C | 检验 和浓盐酸反应后是否有酸剩余 和浓盐酸反应后是否有酸剩余 | 取少量反应后的溶液于试管中,依次加入稀硝酸、 溶液 溶液 | 产生大量白色沉淀,则盐酸有剩余 |
| D | 探究 固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,滴加KSCN溶液 | 若溶液变为红色,说明样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-23更新
|
97次组卷
|
2卷引用:陕西省西安高新第一中学2023-2024学年高一上学期第二次月考化学试题
名校
解题方法
4 . 工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: 难溶于水;
难溶于水;
②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1) 中Cu的化合价为
中Cu的化合价为___________ ,酸浸过程中, 反应的离子方程式
反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择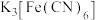 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)氧化后,从反应体系中分离出 粗产品的操作名称是
粗产品的操作名称是___________ 。
(4)上述流程中,基态原子未成对电子数最多的金属元素名称是___________ 。
(5)向 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式___________ 。
(6)已知常温下, ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: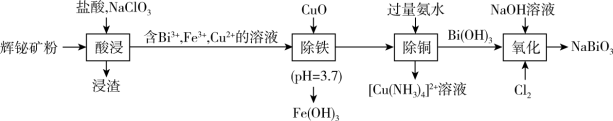
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择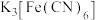 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=
您最近一年使用:0次
名校
5 . 高铁酸钾 是一种新型、高效、无毒的多功能水处理剂。已知:
是一种新型、高效、无毒的多功能水处理剂。已知: 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 。
。

①在装置A中发生的化学反应中 显示出来的性质为
显示出来的性质为__________ 。
②C为制备 装置,写出离子反应方程式
装置,写出离子反应方程式__________ 。
(2)探究 的性质。
的性质。
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 ,为证明
,为证明 是否氧化了
是否氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:
①方案ⅰ证明溶液a中含有 ,写出相应的操作及现象
,写出相应的操作及现象__________ ;但该离子的产生不能判断一定是 将
将 氧化,还可能是因为发生
氧化,还可能是因为发生__________ (填化学方程式)。
②方案ⅱ可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是__________ 。
(3)根据 的制备实验得出:氧化性
的制备实验得出:氧化性
______  (填“>”或“<”),而方案ⅱ表明,
(填“>”或“<”),而方案ⅱ表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是__________ 。
(4) 与水反应能产生具有强吸附性的
与水反应能产生具有强吸附性的 胶体,除去水中细微的悬浮物,写出
胶体,除去水中细微的悬浮物,写出 与水反应的化学方程式
与水反应的化学方程式__________ 。
 是一种新型、高效、无毒的多功能水处理剂。已知:
是一种新型、高效、无毒的多功能水处理剂。已知: 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 。
。
①在装置A中发生的化学反应中
 显示出来的性质为
显示出来的性质为②C为制备
 装置,写出离子反应方程式
装置,写出离子反应方程式(2)探究
 的性质。
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 ,为证明
,为证明 是否氧化了
是否氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:实验方案与现象 | |
方案ⅰ | |
方案ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 产生 产生 |
 ,写出相应的操作及现象
,写出相应的操作及现象 将
将 氧化,还可能是因为发生
氧化,还可能是因为发生②方案ⅱ可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是(3)根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案ⅱ表明,
(填“>”或“<”),而方案ⅱ表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(4)
 与水反应能产生具有强吸附性的
与水反应能产生具有强吸附性的 胶体,除去水中细微的悬浮物,写出
胶体,除去水中细微的悬浮物,写出 与水反应的化学方程式
与水反应的化学方程式
您最近一年使用:0次
2024-02-02更新
|
101次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
6 . 某研究小组查阅资料发现 与
与 的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在
的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在 ,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。

I、初步探究
实验2:用煮沸后的蒸馏水重新配制两种饱和溶液,并在注射器中进行实验,记录如下表。
(1)研究小组同学根据查阅资料写出的 与
与 反应的离子方程式为
反应的离子方程式为_____ 。
(2)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是_____ 。
Ⅱ、查阅资料,继续探究。
资料: 为不溶于水的白色固体。
为不溶于水的白色固体。
实验3:

(3)试管a的实验现象说明滤液1中含有_____ 。
(4)试管b中,加入 溶液后所产生实验现象的原因是
溶液后所产生实验现象的原因是_____ 。
(5)甲同学对实验3提出了质疑,认为其实验现象并不能证明 氧化了
氧化了 。他提出如下假设:
。他提出如下假设:
i、可能是 氧化了
氧化了 ;
;
ii、可能是空气中的 氧化了
氧化了 。
。
他设计实施了实验4,实验记录如下表。
①试剂a是_____ 。
②依据实验4,甲同学做出判断:假设_____ 不成立。
(6)根据实验1~4可得实验1溶液未变红的原因是_____ 。
 与
与 的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在
的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在 ,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
I、初步探究
实验2:用煮沸后的蒸馏水重新配制两种饱和溶液,并在注射器中进行实验,记录如下表。
| 编号 | 饱和 溶液 溶液 | 饱和碘水 | 操作 |  溶液 溶液 | 现象 |
| 2-1 | 1滴 |  | 不加热 | 1滴 | 无明显现象 |
| 2-2 | 1滴 |  | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(1)研究小组同学根据查阅资料写出的
 与
与 反应的离子方程式为
反应的离子方程式为(2)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是
Ⅱ、查阅资料,继续探究。
资料:
 为不溶于水的白色固体。
为不溶于水的白色固体。实验3:

(3)试管a的实验现象说明滤液1中含有
(4)试管b中,加入
 溶液后所产生实验现象的原因是
溶液后所产生实验现象的原因是(5)甲同学对实验3提出了质疑,认为其实验现象并不能证明
 氧化了
氧化了 。他提出如下假设:
。他提出如下假设:i、可能是
 氧化了
氧化了 ;
;ii、可能是空气中的
 氧化了
氧化了 。
。他设计实施了实验4,实验记录如下表。
| 编号 | 实验操作 | 实验现象 |
| 4 | 在试管中加入1滴 溶液, 溶液, 蒸馏水,1滴试剂a,一段时间后加入1滴 蒸馏水,1滴试剂a,一段时间后加入1滴 溶液 溶液 | 溶液不变红 |
②依据实验4,甲同学做出判断:假设
(6)根据实验1~4可得实验1溶液未变红的原因是
您最近一年使用:0次
名校
7 . 废旧金属的综合利用有利于节约资源、保护环境。现有废弃物(含 、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:

已知: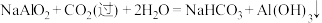
回答下列问题:
(1)“碱溶”时发生反应的离子方程式为_______ 。
(2)“操作1”用到的玻璃仪器有_______ 、玻璃棒。
(3)“沉铝”时加入适量盐酸,该步骤为避免因盐酸控制不当(过量)而导致 溶解,实际操作中可用过量
溶解,实际操作中可用过量_______ (填化学式)气体代替。
(4)“沉铁”时通入空气的目的是_____ ;证明“沉铁”的溶液中没有 的操作为
的操作为_______ 。
(5)“灼烧”时可在_______ (填仪器名称)中进行,写出该反应的化学方程式:_______ 。
 、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
、FeO、CuO),实验室要回收三种金属,工艺流程如图所示:
已知:
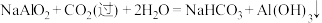
回答下列问题:
(1)“碱溶”时发生反应的离子方程式为
(2)“操作1”用到的玻璃仪器有
(3)“沉铝”时加入适量盐酸,该步骤为避免因盐酸控制不当(过量)而导致
 溶解,实际操作中可用过量
溶解,实际操作中可用过量(4)“沉铁”时通入空气的目的是
 的操作为
的操作为(5)“灼烧”时可在
您最近一年使用:0次
2023-03-06更新
|
213次组卷
|
2卷引用:陕西省西安市周至县第四中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
8 . 证明某溶液只含有Fe2+而不含有Fe3+的实验方法最好是
| A.先滴加氯水,再滴加KSCN溶液后显红色 |
| B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| C.滴加NaOH溶液,立即产生红褐色沉淀 |
| D.只需滴加KSCN溶液 |
您最近一年使用:0次
2022-12-21更新
|
667次组卷
|
21卷引用:陕西省西安市未央区2016-2017学年高一上学期期末质量检测化学试题
陕西省西安市未央区2016-2017学年高一上学期期末质量检测化学试题陕西省西安电子科技大学附属中学2019-2020学年高一上学期期末考试化学试题(已下线)2011-2012学年福建省晋江市季延中学高一上学期期末考试化学试卷(已下线)2012-2013学年福建省晋江市季延中学高一上学期期末考试化学试卷2016-2017学年河北石家庄辛集中学高一上阶段考二化学卷2016-2017学年天津静海一中高一12月学业调研化学卷云南省腾冲市第八中学2017-2018学年高一上学期期末考试化学试题【全国百强校】福建省仙游第一中学2016-2017学年高一下学期第一次月考化学试题河南省商城县上石桥高级中学2018-2019学年高二上学期12月月考化学试题云南省腾冲市第八中学2018-2019学年高一下学期开学考试化学试题甘肃省靖远县第二中学2018-2019学年高一下学期开学考试化学试题安徽省滁州市定远县育才学校2019-2020学年高一上学期期末考试(实验班)化学试题安徽省池州市江南中学2020-2021学年高一上学期期末考试化学试题河北省辛集市第一中学2021-2022学年高一上学期第四次月考化学试题江西省安福县第三中学2021-2022学年高一上学期第二次月考化学试题广西贺州市钟山县钟山中学2020-2021学年高一上学期期末考试化学试题安徽省宿州市萧县凤山中学2022-2023学年高一上学期期末检测化学试题江苏省南京市第五高级中学2022-2023学年高一上学期学情自测卷化学试题吉林省通化市梅河口市第五中学2022-2023学年高一上学期期末考试化学试题新疆乌鲁木齐市第四中学2022-2023学年高一上学期期末考试化学试题广东省惠州市龙门县高级中学2023-2024学年高一上学期12月月考化学试题
9 . 为探究化学反应“2Fe3++2I−⇌2Fe2++I2”存在限度及平衡移动与物质的浓度,性质的关系,甲、乙两同学进行如下实验。
已知:
a.含I2的溶液呈黄色或棕黄色。
b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
Ⅰ.甲同学设计下列实验进行相关探究,实验如图所示。

(1)甲同学利用实验②中ⅰ和ⅱ证明Fe2(SO4)3,溶液与KI溶液的反应存在限度,实验ⅰ中的现象是_________ ,实验ⅱ中a是_________ (填化学式)溶液。
(2)用离子方程式表示实验②ⅲ中产生黄色沉淀的原因_________ 。
Ⅱ.乙同学:利用色度计对Fe2(SO4)3,溶液与KI溶液的反应进行再次探究。
【实验过程】
实验中溶液的透光率数据变化如图所示。

(3)乙同学实验③的目的是_________ 。
(4)乙同学通过透光率变化推断FeCl3溶液与KI溶液的反应存在限度。其相应的推理过程是_________ 。
(5)乙同学根据氧化还原反应的规律,用如图装置(a、b均为石墨电极,盐桥中充满电解质溶液,构成闭合回路)探究化学平衡移动与I−、Fe2+浓度及还原性强弱的关系,操作过程如下:
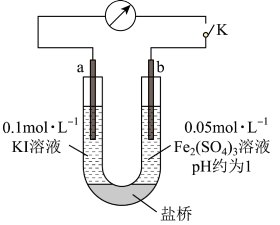
①K闭合时,电流计指针向右偏转,乙同学得出结论2Fe3++2I−⇌2Fe2++I2向正反应方向进行,b作_________ (填“正”或“负”)极,还原性I−>Fe2+。
②当指针归零(反应达到平衡)后,向U型管右管滴加0.1mol/L FeSO4溶液,电流计指针向左偏转,由此得出还原性Fe2+_________ I− (填“>”或“<”)。
(6)综合甲、乙两位同学的实验探究过程,得出的结论有反应“2Fe3++2I−⇌2Fe2++I2”存在限度,_________ 。
已知:
a.含I2的溶液呈黄色或棕黄色。
b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
Ⅰ.甲同学设计下列实验进行相关探究,实验如图所示。

(1)甲同学利用实验②中ⅰ和ⅱ证明Fe2(SO4)3,溶液与KI溶液的反应存在限度,实验ⅰ中的现象是
(2)用离子方程式表示实验②ⅲ中产生黄色沉淀的原因
Ⅱ.乙同学:利用色度计对Fe2(SO4)3,溶液与KI溶液的反应进行再次探究。
【实验过程】
| 序号 | 实验步骤1 | 实验步骤2 |
| 实验③ | 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 | 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.05mol·L-1 Fe2(SO4)3溶液,同时采集溶液的透光率数据 |
| 实验④ | 将盛有2mL 0.1 mol·L-1 KI溶液的比色皿放入色度计的槽孔中 | 同上 |
| 实验5 | 将盛有2mL 0.2 mol·L-1 KI溶液的比色皿放入色度计的槽孔中 | 同上 |

(3)乙同学实验③的目的是
(4)乙同学通过透光率变化推断FeCl3溶液与KI溶液的反应存在限度。其相应的推理过程是
(5)乙同学根据氧化还原反应的规律,用如图装置(a、b均为石墨电极,盐桥中充满电解质溶液,构成闭合回路)探究化学平衡移动与I−、Fe2+浓度及还原性强弱的关系,操作过程如下:

①K闭合时,电流计指针向右偏转,乙同学得出结论2Fe3++2I−⇌2Fe2++I2向正反应方向进行,b作
②当指针归零(反应达到平衡)后,向U型管右管滴加0.1mol/L FeSO4溶液,电流计指针向左偏转,由此得出还原性Fe2+
(6)综合甲、乙两位同学的实验探究过程,得出的结论有反应“2Fe3++2I−⇌2Fe2++I2”存在限度,
您最近一年使用:0次
解题方法
10 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。

回答下列问题:
(1)Mn的原子结构示意图为___________ 。
(2)“滤液a”的主要成分为NH4Cl,另外还含有少量ZnCl2等。
①用离子方程式表示“滤液a”呈酸性的原因___________ 。
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、___________ 、洗涤、干燥,得NH4Cl固体。

(3)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为___________ 。
(4)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
实验II.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是___________ ,实验II中H2O2的作用是___________ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是___________ 。
(5)加入MnO调pH时,证明MnSO4溶液中Fe3+沉淀完全的实验步骤及现象:取少量溶液,滴加___________ (填试剂),观察到___________ (填现象)。

回答下列问题:
(1)Mn的原子结构示意图为
(2)“滤液a”的主要成分为NH4Cl,另外还含有少量ZnCl2等。
①用离子方程式表示“滤液a”呈酸性的原因
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、

(3)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(4)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
实验II.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(5)加入MnO调pH时,证明MnSO4溶液中Fe3+沉淀完全的实验步骤及现象:取少量溶液,滴加
您最近一年使用:0次



