1 . 制备摩尔盐【 】的实验中,需对过滤出产品的母液【
】的实验中,需对过滤出产品的母液【 、
、 、
、 的混合溶液,
的混合溶液,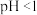 】进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是
】进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是
 】的实验中,需对过滤出产品的母液【
】的实验中,需对过滤出产品的母液【 、
、 、
、 的混合溶液,
的混合溶液,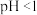 】进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是
】进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是A.通入过量 : : 、 、 、 、 、 、 、 、 |
B.加入少量NaClO溶液: 、 、 、 、 、 、 、 、 |
C.加入过量NaOH溶液: 、 、 、 、 、 、 、 、 |
D.加入过量NaClO和NaOH的混合溶液: 、 、 、 、 、 、 、 、 |
您最近一年使用:0次
2022-12-08更新
|
543次组卷
|
75卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第4节 离子反应 课时1 离子反应发生的条件
鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第4节 离子反应 课时1 离子反应发生的条件2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届河南省灵宝市第一高级中学高三上学期9月月考化学试卷2017届湖北省荆州中学高三上学期8月摸底化学试卷2017届湖北省沙市中学高三上学期第二次考试化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷2017届湖北省襄阳市四校高三上学期期中化学试卷山西省运城市2017届高三4月模拟调研测试理科综合化学试题山西省怀仁县第一中学2016-2017学年高一下学期期中考试化学试题广西南宁市第三中学2016-2017学年高一下学期期中考试(理)化学试题安徽省师范大学附属中学2016-2017学年高一下学期期末考试化学试题河南省安阳市第二中学2016-2017学年高二下学期期末考试化学试题内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习对接高考精练--电解质 离子反应新疆生产建设兵团第二中学2016-2017学年高二下学期第四次月考化学试题河北省定州中学2018届高三(承智班)上学期第一次调研化学试题贵州省遵义航天高级中学2018届高三第二次模拟(10月)理科综合化学试题安徽省六安市第一中学2018届高三上学期第三次月考化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题广西桂林市第十八中学2017-2018学年高一下学期开学考试化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)(已下线)《考前20天终极攻略》-5月20日 离子共存和离子方程式【全国百强校】河北省辛集中学2017-2018学年高二6月月考化学试题(已下线)解密04 离子反应——备战2018年高考化学之高频考点解密 张燕(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】广东省蓝精灵中学2018-2019学年高二上学期联考化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题安徽省白泽湖中学2017届高三上学期期中考试化学试题【全国百强校】江西省上高县第二中学2019届高三上学期第三次月考化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (教学案)山东省商河市第一中学2019届高三上学期11月月考理科综合化学试题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)2016年全国普通高等学校招生统一考试化学(江苏卷参考版)【全国百强校】江苏省海安高级中学2018-2019学年高一6月月考化学试题江苏省海安高级中学2019-2020学年高二上学期入学考试化学试题四川省棠湖中学2019-2020学年高二上学期开学考试化学试题内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存2020届高三化学大二轮增分强化练——离子共存贵州省罗甸县第一中学2019-2020学年高三上学期期末考试理综化学试题云南省玉溪市新平县一中2019-2020学年高三上学期1月月考理综化学试题(已下线)【新东方】2020-77河北省邯郸市第一中学2019-2020学年高一下学期第一次网上月考化学试题河北省承德市第一中学2019-2020学年高二下学期3月疫情期间直播课堂检测化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题安徽省马鞍山市2020届高考第二次模拟理综化学试题四川省宜宾市第四中学2021届高三上学期开学考试理综化学试题广西桂林市第十八中学2021届高三上学期第二次月考理科综合化学试题(已下线)湖南省湘潭县一中、双峰一中、邵东一中、永州四中2018-2019学年高一下学期优生联考化学试题(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练山西省太原市第五中学校2021-2022学年高三上学期9月月考化学试题江西省宁冈中学2021-2022学年高一上学期开学考试化学试题(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)湖南省隆回县第二中学2021-2022学年高三上学期第四次月考化学试题(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题01 物质及其变化-2023年高考化学一轮复习小题多维练(全国通用)湖南省常德市桃源县第一中学2022-2023学年高三上学期9月月考化学试题(已下线)易错点03 离子反应-备战2023年高考化学考试易错题河南省南阳市2022-2023学年高三上学期期中质量评估化学试题上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题重庆市长寿中学校2022-2023学年高三上学期期中考试化学试题江苏省南京师范大学附属中学2022-2023学年高一上学期12月月考化学试题河南省许昌市高级中学2022-2023学年高三上半年第一次模拟考试化学试题河南省南阳市2022-2023学年高三上学期11月期中考试化学试题(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)上海市金山中学2022-2023学年高二下学期期末考试(等级)化学试题山西大学附属中学校2023-2024学年高一上学期12月模块诊断化学试卷四川省射洪中学校2023-2024学年高一(强基班)上学期第三次月考化学试题江苏省南京师范大学附属中学2023-2024学年高一上学期1月期末化学试题
解题方法
2 . 电子工业中,人们常用 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。用耐腐油墨把预先设计好的电路印刷在覆铜板上,然后把覆铜板放到
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。用耐腐油墨把预先设计好的电路印刷在覆铜板上,然后把覆铜板放到 溶液中,未被油墨覆盖的铜被腐蚀掉,再将油墨清洗后就得到了电路板。
溶液中,未被油墨覆盖的铜被腐蚀掉,再将油墨清洗后就得到了电路板。
(1)为什么用上述方法可以制造印刷电路板________ ?
(2)为了从腐蚀废液中回收铜,并重新获得 溶液,可以采用下列步骤:
溶液,可以采用下列步骤:
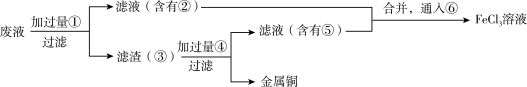
A.请写出上述过程中加入或生成的有关物质的化学式:
①_______ ,②_______ ,③_______ ,④_______ ,⑤_______ ,⑥_______
B.请写出相关反应的化学方程式_________ 。
 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。用耐腐油墨把预先设计好的电路印刷在覆铜板上,然后把覆铜板放到
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。用耐腐油墨把预先设计好的电路印刷在覆铜板上,然后把覆铜板放到 溶液中,未被油墨覆盖的铜被腐蚀掉,再将油墨清洗后就得到了电路板。
溶液中,未被油墨覆盖的铜被腐蚀掉,再将油墨清洗后就得到了电路板。(1)为什么用上述方法可以制造印刷电路板
(2)为了从腐蚀废液中回收铜,并重新获得
 溶液,可以采用下列步骤:
溶液,可以采用下列步骤:
A.请写出上述过程中加入或生成的有关物质的化学式:
①
B.请写出相关反应的化学方程式
您最近一年使用:0次
3 . 为探究 的性质,某学习小组进行了如下探究。
的性质,某学习小组进行了如下探究。
(1)向制得的 溶液中加入铁粉,其目的是
溶液中加入铁粉,其目的是_______ 。
(2)预测 既有氧化性又有还原性。你认为预测的依据是
既有氧化性又有还原性。你认为预测的依据是_______ 。
(3)进行实验探究。实验室提供了下列试剂: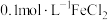 溶液、
溶液、 溶液、新制氯水、KSCN溶液、锌片、铜片。
溶液、新制氯水、KSCN溶液、锌片、铜片。
①向 溶液中滴入新制氯水,探究的是
溶液中滴入新制氯水,探究的是 的
的_______ 性(填“氧化”或“还原”),所发生反应的离子方程式为_______ 。
②在实验中,甲同学发现现象不太明显,老师分析可能是反应产物的含量太低,建议通过检验 反应产物的存在以获取证据。可选
反应产物的存在以获取证据。可选_______ 滴入甲同学所得的混合溶液中,并通过溶液出现_______ 的现象证明 具有还原性,能被氯水氧化。
具有还原性,能被氯水氧化。
③设计实验证明 具有氧化性:
具有氧化性:_______ 。
 的性质,某学习小组进行了如下探究。
的性质,某学习小组进行了如下探究。(1)向制得的
 溶液中加入铁粉,其目的是
溶液中加入铁粉,其目的是(2)预测
 既有氧化性又有还原性。你认为预测的依据是
既有氧化性又有还原性。你认为预测的依据是(3)进行实验探究。实验室提供了下列试剂:
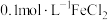 溶液、
溶液、 溶液、新制氯水、KSCN溶液、锌片、铜片。
溶液、新制氯水、KSCN溶液、锌片、铜片。①向
 溶液中滴入新制氯水,探究的是
溶液中滴入新制氯水,探究的是 的
的②在实验中,甲同学发现现象不太明显,老师分析可能是反应产物的含量太低,建议通过检验
 反应产物的存在以获取证据。可选
反应产物的存在以获取证据。可选 具有还原性,能被氯水氧化。
具有还原性,能被氯水氧化。③设计实验证明
 具有氧化性:
具有氧化性:
您最近一年使用:0次
2022-11-25更新
|
221次组卷
|
2卷引用:2019版鲁科化学必修第一册第3章第1节 铁的多样性课后习题
解题方法
4 . 某久置的 溶液略显黄色,某同学认为已有部分
溶液略显黄色,某同学认为已有部分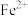 被空气中的氧气氧化为
被空气中的氧气氧化为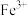 。
。
(1)写出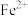 被空气中的氧气氧化的离子方程式
被空气中的氧气氧化的离子方程式________ 。
(2)请设计实验验证溶液中是否存在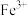
________ 。
(3)若溶液中存在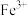 ,应如何除去
,应如何除去__________ ?
 溶液略显黄色,某同学认为已有部分
溶液略显黄色,某同学认为已有部分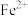 被空气中的氧气氧化为
被空气中的氧气氧化为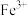 。
。(1)写出
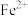 被空气中的氧气氧化的离子方程式
被空气中的氧气氧化的离子方程式(2)请设计实验验证溶液中是否存在
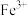
(3)若溶液中存在
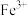 ,应如何除去
,应如何除去
您最近一年使用:0次
5 . 当人体缺铁时,往往需要服用补铁剂,人体能吸收的是+2价铁元素。查看一些补铁剂的主要成分,了解其中铁元素的价态。
(1)你认为可以采用什么方法检验补铁剂中铁元素的价态_________ ?
(2)天然食品中含有的大多是+3价铁元素,为了使+3价铁元素转化为+2价铁元素并被人体更好地吸收,你认为应该采取哪些措施?请查阅资料寻找办法__________ 。
(1)你认为可以采用什么方法检验补铁剂中铁元素的价态
(2)天然食品中含有的大多是+3价铁元素,为了使+3价铁元素转化为+2价铁元素并被人体更好地吸收,你认为应该采取哪些措施?请查阅资料寻找办法
您最近一年使用:0次
22-23高一上·全国·课时练习
6 . 混合物的除杂
| 混合物(括号内为杂质) | 除杂方法及试剂 |
| Fe2+(Fe3+) | ① |
| FeCl3溶液(FeCl2溶液) | ② |
| Fe2+(Cu2+) | ③ |
| Fe(Al) | ④ |
| Fe2O3(Al 2O3) | ⑤ |
您最近一年使用:0次
22-23高一上·全国·课后作业
7 . 二价铁(Fe3+)的性质
(1)化合价:+3价,处于_______ 价态。
(2)性质预测:只有_______ 。
(3)与还原剂的反应

①与Cu反应:_______ 。
②与Fe反应:_______ 。
(1)化合价:+3价,处于
(2)性质预测:只有
(3)与还原剂的反应

①与Cu反应:
②与Fe反应:
您最近一年使用:0次
22-23高一上·全国·阶段练习
名校
8 . 铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。
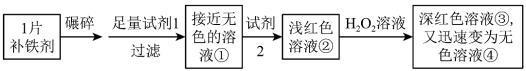
将补铁剂碾碎的目的是增大接触面积,使其充分溶解。
(1)试剂1是_______ ,试剂2是_______ 。
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(3)能证明溶液①中含有Fe2+的实验现象是_______ 。
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:_______ 。
_______H++_______Fe2++_______H2O2=_______ _______+_______ _______
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)计算每片该补铁剂含铁元素的质量为_______ g。
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是_______ 。
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。

将补铁剂碾碎的目的是增大接触面积,使其充分溶解。
(1)试剂1是
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有
(3)能证明溶液①中含有Fe2+的实验现象是
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:
_______H++_______Fe2++_______H2O2=_______ _______+_______ _______
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)计算每片该补铁剂含铁元素的质量为
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是
您最近一年使用:0次
2022-11-01更新
|
600次组卷
|
3卷引用:章末检测卷(三) 铁 金属材料
章末检测卷(三) 铁 金属材料(已下线)第二次月考测评卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)北京市海淀区第二十中学2022-2023学年高一上学期11月月考化学试题
21-22高一·全国·课时练习
9 . 电子工业常用FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某研究小组同学为了从腐蚀废液中回收铜,并重新获得FeCl3溶液,设计了如图流程:

请回答:
(1)FeCl3溶液与铜箔反应,生成FeCl2和CuCl2,反应的离子方程式是___________ ,若反应过程中有2mol电子发生转移,会有___________ g铜溶解。
(2)①~③所涉及的实验操作方法中,属于过滤的是___________ (填序号)。①中发生反应的离子方程式是___________ 。
(3)气体C的化学式是___________ ,检验FeCl3溶液中金属阳离子的操作和现象是___________ 。
(4)①中反应消耗铁粉11.2g,废液中Fe3+的物质的量浓度是___________ 。

请回答:
(1)FeCl3溶液与铜箔反应,生成FeCl2和CuCl2,反应的离子方程式是
(2)①~③所涉及的实验操作方法中,属于过滤的是
(3)气体C的化学式是
(4)①中反应消耗铁粉11.2g,废液中Fe3+的物质的量浓度是
您最近一年使用:0次
21-22高一·全国·课时练习
解题方法
10 . 化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价-类”二维图。铁元素的“价一类”二维图如图所示,下列说法正确的是


| A.工业上用CO还原Fe2O3炼铁,该反应为置换反应 |
B.Fe3O4中铁的化合价 显+2价, 显+2价, 显+3价 显+3价 |
| C.维生素C能将Fe3+转化为Fe2+,过程中维生素C作还原剂 |
| D.Fe(OH)2浊液露置于空气中,由白色迅速变为棕黄色 |
您最近一年使用:0次



