1 . 某学习小组对“ 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:
(1)如图所示将浸泡过 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。 溶液的操作为先加
溶液的操作为先加____________ 溶解 ,再稀释至所需浓度。
,再稀释至所需浓度。
②用化学方程式解释粉笔表面出现红褐色的原因:________________ 。
③溶液变铁锈色是因为生成了______________ (填化学式)。
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料: 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。
提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为________________ ,未呈现黑色。
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热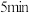 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是_______________ 。
限选试剂:黑色粉末样品、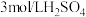 溶液、
溶液、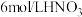 溶液、
溶液、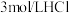 溶液、
溶液、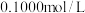 酸性
酸性 溶液、
溶液、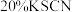 溶液、蒸馏水。
溶液、蒸馏水。
(4)由以上实验测得黑色粉末中铁元素的质量分数为_______________ (已知实验条件下所得 固体中
固体中 与
与 个数比为
个数比为 )。
)。
 溶液的灼烧”进行实验探究。回答下列问题:
溶液的灼烧”进行实验探究。回答下列问题:(1)如图所示将浸泡过
 溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。
溶液的粉笔夹持于酒精灯上灼烧,加热过程中观察到粉笔表面颜色变化:黄色→红褐色→铁锈色→黑色。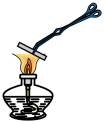
 溶液的操作为先加
溶液的操作为先加 ,再稀释至所需浓度。
,再稀释至所需浓度。②用化学方程式解释粉笔表面出现红褐色的原因:
③溶液变铁锈色是因为生成了
(2)针对粉笔表面颜色最终变为黑色的现象,设计实验探究黑色物质成分。
查阅资料:
 是一种黑色粉末,不稳定,在空气中加热可被氧化为
是一种黑色粉末,不稳定,在空气中加热可被氧化为 ;隔绝空气加热歧化为
;隔绝空气加热歧化为 和
和 。
。提出猜想:
猜想1:酒精与粉笔灼烧的产物;
猜想2:酒精还原铁锈色物质而得到的产物。
实验设计:
①实验1:利用一个简单的操作证明猜想1不成立,实验操作为
②实验2:如图所示密闭装置中,先在浸泡过酒精的粉笔处加热,再在铁锈色物质处加热,观察到铁锈色物质变为黑色后持续加热
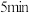 ,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
,取下试管加热,观察到有砖红色沉淀产生,先在粉笔处加热的目的是
限选试剂:黑色粉末样品、
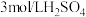 溶液、
溶液、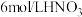 溶液、
溶液、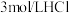 溶液、
溶液、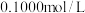 酸性
酸性 溶液、
溶液、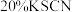 溶液、蒸馏水。
溶液、蒸馏水。实验序号 | 实验操作 | 实验现象 | 实验结论 |
| 3 | 取黑色粉末靠近磁铁 | 黑色粉末几乎全被磁铁吸引,未被吸收的黑色粉末经检验不含铁元素 | 黑色粉末不是 |
| 4 | 向盛有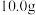 黑色粉末的试管中加入① 黑色粉末的试管中加入① | 固体全部溶解且无气泡产生 | ② |
| 5 | 将实验4的溶液分为四等份,用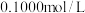 酸性 酸性 溶液滴定至终点,重复三次平均消耗 溶液滴定至终点,重复三次平均消耗 溶液 溶液 | 滴定终点现象是 ③ | 黑色粉末是 |
| 6 | 取实验5中剩余一等份溶液于洁净试管中,加入④ | ⑤ |
(4)由以上实验测得黑色粉末中铁元素的质量分数为
 固体中
固体中 与
与 个数比为
个数比为 )。
)。
您最近一年使用:0次
2 . 下列实验操作能达到实验目的是
| 选项 | 实验目的 | 实验操作 |
| A | 除去甲烷气体中混有的乙烯 | 将混合气体通入盛有酸性KMnO4溶液的洗气瓶 |
| B | 比较氯和碳的非金属性强弱 | 将盐酸与NaHCO3溶液混合 |
| C | 检验溶液中的Fe3+ | 向待测液中滴加KSCN溶液 |
| D | 比较HClO和CH3COOH酸性强弱 | 用pH试纸测定等浓度HClO和CH3COOH溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 物质的性质决定用途。下列两者对应关系不正确的是
A. 能吸收 能吸收 产生 产生 ,可用作呼吸面具供氧剂 ,可用作呼吸面具供氧剂 |
B. 溶液呈酸性,可用于腐蚀电路板上的 溶液呈酸性,可用于腐蚀电路板上的 |
C. 具有还原性,可用作抗氧化剂 具有还原性,可用作抗氧化剂 |
| D.液氨汽化需要吸收大量的热,可用作制冷剂 |
您最近一年使用:0次
名校
解题方法
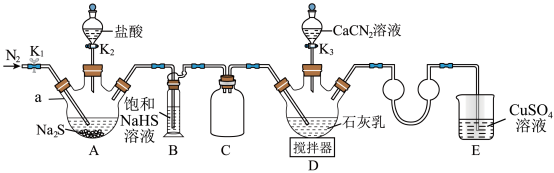
4 . 硫脲[CS(NH2)2]在药物制备、金属矿物浮选等方面有广泛应用。实验室可通过先制备Ca(HS)2,然后Ca(HS)2再与CaCN2合成CS(NH2)2实验装置(夹持及加热装置略)如图所示。回答下列问题:
(1)仪器a的名称是___________ ,装置B中饱和NaHS溶液的作用是___________ 。装置C的作用为___________ 。
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是___________ ;然后关闭K1,打开K2,待A中反应结束后关闭K2。
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是___________ 。待D中反应结束后,关闭K3,打开K1,通入一段时间N2,目的是___________ 。
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴___________ 溶液(填化学式),溶液变为红色,则可证明。
(5)装置E中CuSO4溶液的作用是___________ (用离子方程式表示)。
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和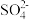 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为___________ (用含m、c、V的代数式表示)。
(1)仪器a的名称是
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴
(5)装置E中CuSO4溶液的作用是
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和
 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为
您最近一年使用:0次
2024-05-12更新
|
212次组卷
|
3卷引用:河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题
解题方法
5 . 一种以黄铁矿烧渣(主要成分为 等)为原料制取硫酸铁晶体的工艺流程如下:(已知:
等)为原料制取硫酸铁晶体的工艺流程如下:(已知: 不溶于水,不和硫酸反应。)
不溶于水,不和硫酸反应。)_____ 。
(2)已知:25.0%硫酸的密度 ,则25.0%硫酸的物质的量浓度为
,则25.0%硫酸的物质的量浓度为______ ;若实验室用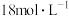 的浓硫酸配制
的浓硫酸配制 硫酸,则需用量筒量
硫酸,则需用量筒量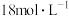 的浓硫酸的体积为
的浓硫酸的体积为_____  。
。
(3)写出“酸浸”中氧化铁与酸反应的离子方程式______ ,“酸浸”后过滤所得滤液中所含的阳离子有_______ (填离子符号)。
(4)“氧化”过程发生反应的离子方程式为_______ ;“氧化”时可用硝酸代替 ,优点是原料成本低,缺点是
,优点是原料成本低,缺点是_______ 。
(5)从“氧化”后的溶液中获得硫酸铁晶体,需经“一系列操作”,则“一系列操作”为______ 、过滤洗涤、烘干。
 等)为原料制取硫酸铁晶体的工艺流程如下:(已知:
等)为原料制取硫酸铁晶体的工艺流程如下:(已知: 不溶于水,不和硫酸反应。)
不溶于水,不和硫酸反应。)
(2)已知:25.0%硫酸的密度
 ,则25.0%硫酸的物质的量浓度为
,则25.0%硫酸的物质的量浓度为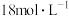 的浓硫酸配制
的浓硫酸配制 硫酸,则需用量筒量
硫酸,则需用量筒量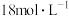 的浓硫酸的体积为
的浓硫酸的体积为 。
。(3)写出“酸浸”中氧化铁与酸反应的离子方程式
(4)“氧化”过程发生反应的离子方程式为
 ,优点是原料成本低,缺点是
,优点是原料成本低,缺点是(5)从“氧化”后的溶液中获得硫酸铁晶体,需经“一系列操作”,则“一系列操作”为
您最近一年使用:0次
6 . 高效净水剂聚合氯化铝铁(PAFC)的组成可表示为 ,该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
,该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。 中的A是
中的A是___________ 。
②步骤 中发生反应生成
中发生反应生成 中溶液离子方程式为
中溶液离子方程式为___________ 。
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:___________ , 的电子式为
的电子式为___________ 。
②所得酸性溶液中,一定大量存在的离子有___________ ;可能存在的离子有___________ ,证明该离子确实存在,可采用的操作(必须指明所采用的试剂及观察到的观象)是___________ 。
③步骤 中发生反应的离子方程式为
中发生反应的离子方程式为___________ 。
 ,该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
,该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。
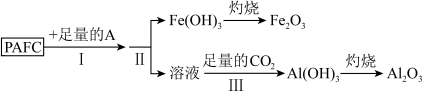
 中的A是
中的A是②步骤
 中发生反应生成
中发生反应生成 中溶液离子方程式为
中溶液离子方程式为(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:

 的电子式为
的电子式为②所得酸性溶液中,一定大量存在的离子有
③步骤
 中发生反应的离子方程式为
中发生反应的离子方程式为
您最近一年使用:0次
解题方法
7 . 工业上以铝土矿(主要成分为 ,含少量
,含少量 、FeO、
、FeO、 等杂质)为主要原料制备氧化铝,流程如下。
等杂质)为主要原料制备氧化铝,流程如下。 溶液浸取铝土矿中的铝元素和铁元素,
溶液浸取铝土矿中的铝元素和铁元素, 溶液的用量不宜过量太多,其原因是
溶液的用量不宜过量太多,其原因是___________ 。
(2)氧化:用 溶液将
溶液将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)沉淀:用1mol/L 溶液调节pH,将
溶液调节pH,将 、
、 转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。
转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。___________ 。
②实验室需要1mol/L 溶液450mL,配制时需要使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和
溶液450mL,配制时需要使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和___________ 。
③检验 沉淀完全的操作为:静置,
沉淀完全的操作为:静置,___________ 。
(4)碱溶:用NaOH溶液溶解沉淀,分离出 。
。
①该反应的离子方程式为:___________ 。
②下列措施中能提高单位时间内铝元素浸出率的有___________ (填序号)。
A.适当增大NaOH溶液浓度 B.适当加快搅拌速率 C.适当降低温度
(5)碳分:向“碱溶”后的溶液中通入足量 气体,生成
气体,生成 沉淀和
沉淀和 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
 ,含少量
,含少量 、FeO、
、FeO、 等杂质)为主要原料制备氧化铝,流程如下。
等杂质)为主要原料制备氧化铝,流程如下。
 溶液浸取铝土矿中的铝元素和铁元素,
溶液浸取铝土矿中的铝元素和铁元素, 溶液的用量不宜过量太多,其原因是
溶液的用量不宜过量太多,其原因是(2)氧化:用
 溶液将
溶液将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为(3)沉淀:用1mol/L
 溶液调节pH,将
溶液调节pH,将 、
、 转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。
转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。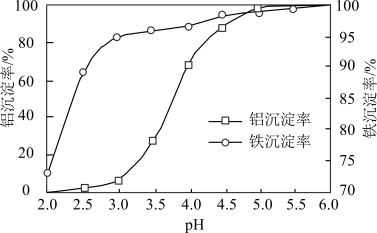
②实验室需要1mol/L
 溶液450mL,配制时需要使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和
溶液450mL,配制时需要使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和③检验
 沉淀完全的操作为:静置,
沉淀完全的操作为:静置,(4)碱溶:用NaOH溶液溶解沉淀,分离出
 。
。①该反应的离子方程式为:
②下列措施中能提高单位时间内铝元素浸出率的有
A.适当增大NaOH溶液浓度 B.适当加快搅拌速率 C.适当降低温度
(5)碳分:向“碱溶”后的溶液中通入足量
 气体,生成
气体,生成 沉淀和
沉淀和 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 下列实验方案设计正确的是
| 目的 | 设计方案 | |
| A | 探究 元素的存在 元素的存在 | 用洁净的玻璃棒蘸取待测液在酒精灯火焰上灼烧,观察火焰颜色 |
| B | 探究铁与水蒸气发生反应后的产物中铁元素的价态 | 取少量固体产物溶于足量稀硫酸后,再取上层清液,依次加入 溶液和双氧水 溶液和双氧水 |
| C | 探究 氧化性比 氧化性比 强 强 | 用硫酸酸化的 溶液滴入 溶液滴入 溶液中,观察溶液颜色变化 溶液中,观察溶液颜色变化 |
| D | 探究镁和铝的金属性强弱 | 两支试管中分别加入 的 的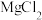 溶液和 溶液和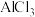 溶液,再各逐滴加入氢氧化钠溶液至过量,比较实验现象 溶液,再各逐滴加入氢氧化钠溶液至过量,比较实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 聚合硫酸铁是一种新型高效净水剂。以黄铁矿(主要成分: ,铁的化合价为
,铁的化合价为 价)烧渣(主要成分为
价)烧渣(主要成分为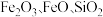 等)为原料制取聚合硫酸铁(铁的化合价为
等)为原料制取聚合硫酸铁(铁的化合价为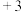 价)的实验步骤如图:
价)的实验步骤如图:
(1)“煅烧”过程发生反应的氧化产物是______ 。
(2)写出“酸浸”过程中发生反应的离子方程式______ 。
(3)“氧化”过程中先产生无色气体,最终变成红棕色气体,写出加入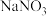 产生无色气体反应的离子方程式
产生无色气体反应的离子方程式_______ ,若用 代替
代替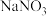 达到相同氧化效果,消耗
达到相同氧化效果,消耗 和
和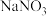 的物质的量之比
的物质的量之比_____ 。
(4)为确定产品是否合格,需测定聚合硫酸铁中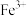 和
和 的物质的量之比,测定时需要的试剂为______(填写序号)。
的物质的量之比,测定时需要的试剂为______(填写序号)。
 ,铁的化合价为
,铁的化合价为 价)烧渣(主要成分为
价)烧渣(主要成分为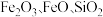 等)为原料制取聚合硫酸铁(铁的化合价为
等)为原料制取聚合硫酸铁(铁的化合价为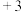 价)的实验步骤如图:
价)的实验步骤如图: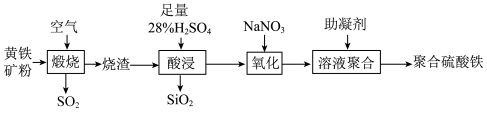
(1)“煅烧”过程发生反应的氧化产物是
(2)写出“酸浸”过程中发生反应的离子方程式
(3)“氧化”过程中先产生无色气体,最终变成红棕色气体,写出加入
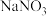 产生无色气体反应的离子方程式
产生无色气体反应的离子方程式 代替
代替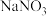 达到相同氧化效果,消耗
达到相同氧化效果,消耗 和
和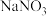 的物质的量之比
的物质的量之比(4)为确定产品是否合格,需测定聚合硫酸铁中
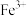 和
和 的物质的量之比,测定时需要的试剂为______(填写序号)。
的物质的量之比,测定时需要的试剂为______(填写序号)。A.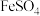 | B. | C. | D. |
您最近一年使用:0次
10 . 根据所学知识填空
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:___________ 。
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
(3)向1mol KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀的物质的量最大时的离子方程式___________
(4)现有以下四种物质:
请根据题意选择恰当的选项用字母代号填空。
①可与KSCN溶液反应,溶液变红的是___________ ;
②常用于焙制糕点,也可用作抗酸药的是___________ ;
③可用于制备硅胶和木材防火剂的是___________ ;
④可用于制造计算机芯片的是___________ 。
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
| A.黄绿色 | B.洋红色 | C.紫红色 | D.绿色 |
(4)现有以下四种物质:
| A.Si | B.FeCl3 | C.NaHCO3 | D.Na2SiO3 |
①可与KSCN溶液反应,溶液变红的是
②常用于焙制糕点,也可用作抗酸药的是
③可用于制备硅胶和木材防火剂的是
④可用于制造计算机芯片的是
您最近一年使用:0次



