名校
1 .  和
和 是
是 的两种重要的氯化物。
的两种重要的氯化物。
Ⅰ.某研究小组用如图装置模拟工业上生产无水 的过程。利用该装置制备
的过程。利用该装置制备 的原理可表示为:
的原理可表示为:
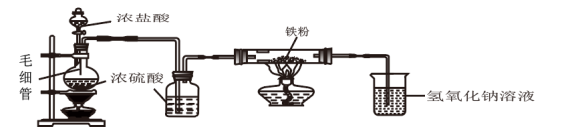
(1)装置中毛细管的作用是___________ 。
(2)从安全角度看,本装置的缺点是___________ 。(任答一条即可)
Ⅱ.现代工业生产中常用电解 溶液的方法制取
溶液的方法制取 溶液,用于吸收有毒的
溶液,用于吸收有毒的 气体。
气体。
(3)工艺原理如图所示,回答下列问题:
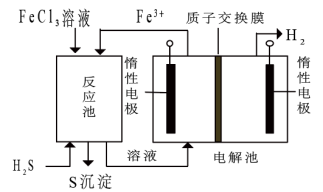
①解池中的总反应离子方程式___________ 。
②工艺中,___________ 溶液可以循环利用(填“ ”或“
”或“ ”)
”)
Ⅲ.探究 的各种平衡表现:
的各种平衡表现:
(4)25℃时,向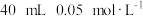 的
的 溶液中一次性加入
溶液中一次性加入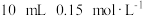 的
的 溶液,发生反应,混合溶液中
溶液,发生反应,混合溶液中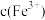 与反应时间(
与反应时间( )的变化如图所示。下列说法正确的是___________。
)的变化如图所示。下列说法正确的是___________。
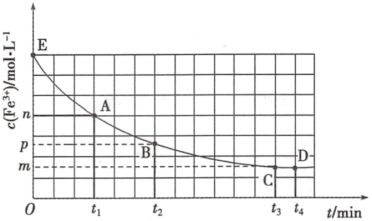
(5) 溶液与
溶液与 的反应体系中存在下列两种化学变化:
的反应体系中存在下列两种化学变化:
(ⅰ) 与
与 发生络合反应生成
发生络合反应生成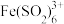 (红棕色);
(红棕色);
(ⅱ) 与
与 发生氧化还原反应,其离子方程式为①
发生氧化还原反应,其离子方程式为①___________ 。
④实验结论:反应(ⅰ)、(ⅱ)的活化能大小关系是:
___________ 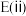 (填“>”“<”或“=”,下同),平衡常数大小关系:
(填“>”“<”或“=”,下同),平衡常数大小关系: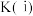
___________ 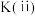 。
。
 和
和 是
是 的两种重要的氯化物。
的两种重要的氯化物。Ⅰ.某研究小组用如图装置模拟工业上生产无水
 的过程。利用该装置制备
的过程。利用该装置制备 的原理可表示为:
的原理可表示为:

(1)装置中毛细管的作用是
(2)从安全角度看,本装置的缺点是
Ⅱ.现代工业生产中常用电解
 溶液的方法制取
溶液的方法制取 溶液,用于吸收有毒的
溶液,用于吸收有毒的 气体。
气体。(3)工艺原理如图所示,回答下列问题:

①解池中的总反应离子方程式
②工艺中,
 ”或“
”或“ ”)
”) Ⅲ.探究
 的各种平衡表现:
的各种平衡表现:(4)25℃时,向
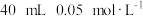 的
的 溶液中一次性加入
溶液中一次性加入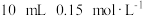 的
的 溶液,发生反应,混合溶液中
溶液,发生反应,混合溶液中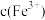 与反应时间(
与反应时间( )的变化如图所示。下列说法正确的是___________。
)的变化如图所示。下列说法正确的是___________。
A.该反应的离子方程式为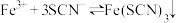 |
B.E点对应的坐标为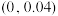 |
C.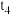 时向溶液中加入 时向溶液中加入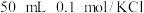 溶液,平衡不移动 溶液,平衡不移动 |
D.若该反应是可逆反应,在25℃时平衡常数的数值为: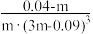 |
 溶液与
溶液与 的反应体系中存在下列两种化学变化:
的反应体系中存在下列两种化学变化:(ⅰ)
 与
与 发生络合反应生成
发生络合反应生成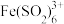 (红棕色);
(红棕色);(ⅱ)
 与
与 发生氧化还原反应,其离子方程式为①
发生氧化还原反应,其离子方程式为①| 步骤 | 现象 | 结论 |
Ⅰ.取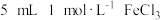 溶液于试管中,通入 溶液于试管中,通入 至饱和 至饱和 | 溶液很快由黄色变为红棕色 | — |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液 | 溶液中无明显光路 | ②红棕色物质不是 |
| Ⅲ.将步骤Ⅰ中的溶液静置 | 1小时后,溶液逐渐变为浅绿色 | — |
Ⅳ.向步骤Ⅲ中所得溶液加入2滴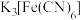 溶液 溶液 | ③ | 溶液中含有 |
 (填“>”“<”或“=”,下同),平衡常数大小关系:
(填“>”“<”或“=”,下同),平衡常数大小关系: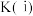
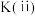 。
。
您最近一年使用:0次
2 . 室温下,下列实验探究方案能达到实验目的的是
| 选项 | 探究方案 | 实验目的 |
| A | 将铁锈溶于足量浓盐酸,再向溶液中滴入几滴 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 检验铁锈中是否含有二价铁 |
| B | 将 溶液与 溶液与 溶液混合,观察现象 溶液混合,观察现象 | 验证结合质子能力: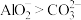 |
| C | 向 溶液中滴入硫酸酸化的 溶液中滴入硫酸酸化的 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 验证氧化性: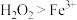 |
| D | 用pH计分别测定等体积的 溶液和 溶液和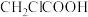 溶液的pH 溶液的pH | 探究键的极性对羟酸酸性的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-27更新
|
302次组卷
|
2卷引用:重庆市第八中学2024届高三上学期高考适应性月考卷(三)化学试题
3 . 下列实验现象和结论正确的是
| 选项 | 实验目的 | 实验操作 | 实验现象、结论 |
| A | 探究化学反应的限度 | 取5mL0.1mol/LFeCl3溶液,滴加0.1mol/LKI溶液5~6滴,充分反应后,取溶液分别加入KSCN溶液和淀粉溶液中 | 若溶液呈现血红色和蓝色,则该反应是有限度 |
| B | 醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体[Ka(CH3COOH)=Kb(NH3·H2O)],观察溶液颜色变化 | 若溶液颜色加深,则存在水解平衡 |
| C | 比较AgCl和AgI的Ksp大小 | 向NaCl和NaI的混合溶液中滴加少量AgNO3溶液,观察现象 | 若溶液中产生黄色沉淀,则Ksp(AgI)<Ksp(AgCl) |
| D | 卤代烃中卤原子的检验 | 将C(CH3)3CH2Br加入NaOH乙醇溶液中,充分加热:冷却后,取混合液加足量硝酸酸化后滴加AgNO3溶液 | 若不产生浅黄色沉淀,则卤代烃中不含有溴元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 下列实验设计、现象和结论都正确的是
| 选项 | 实验目的 | 实验设计和现象 | 实验结论 |
| A | 探究淀粉的水解程度 | 将淀粉溶液在酸性条件下加热一段时间后,向水解液中滴加银氨溶液,加热,未出现光亮的银镜 | 淀粉尚未水解 |
| B | 判断久置的亚硫酸钠是否变质 | 取一定质量的亚硫酸钠固体于试管中,加蒸馏水完全溶解后,滴加BaCl2溶液,出现白色沉淀 | 亚硫酸钠已变质 |
| C | 检验溶液中是否含Fe2+ | 向待测液中通入氯气并加入KSCN溶液,溶液变红 | 溶液中含有Fe2+ |
| D | 探究 和 和 反应原理 反应原理 | 向 溶液中滴加 溶液中滴加 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | 溶液中 结合 结合 的能力比 的能力比 强 强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 根据实验目的,下列方案设计、现象和结论不正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 验证NaCl、Na2SO4混合溶液中的Cl- | 取少量混合溶液于试管中,加入过量的Ba(NO3)2溶液,静置,向上层清液中滴加AgNO3溶液 | 若上层清液变浑浊,则混合溶液中含有Cl- |
| B | 探究碳酸钠溶液显碱性是由 水解导致 水解导致 | 取2.0mL0.1 mol∙L-1Na2CO3溶液,滴入3滴酚酞,观察现象,再滴入几滴1mol/L BaCl2溶液 | 滴入酚酞溶液变红,再滴入BaCl2后出现白色沉淀,溶液颜色变浅 |
| C | 探究铝在浓硝酸中会发生钝化 | 将去除氧化膜的铝片放入浓硝酸中,一段时间后取出用水洗净,放入硫酸铜溶液 | 铝片表面未见紫红色固体,说明铝片已钝化 |
| D | 证明氧化性:Cl2>Fe3+> | 向2支盛有FeCl2溶液的试管中分别通入氯气。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液和BaCl2溶液 | 第一支试管中溶液变成血红色,第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+> |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 向浓碱溶液中滴入FeCl3饱和溶液,煮沸,溶液变红褐色 | 制备 Fe(OH)3胶体 |
| B | 向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 比较氧化性:Fe3+<I2 |
| C | 向盛有2 g碳酸钠粉末的试管中加入少量水后,碳酸钠粉末结块变成晶体,用手触摸试管壁 | 验证碳酸钠粉末遇水生成碳酸钠晶体是放热反应 |
| D | 向盛有5 mL 0.05 mol·L-1FeCl3溶液中加入1 mL 0.15 mol·L-1 KSCN 溶液,溶液显红色,再加入1mol· L-1 KSCN溶液 | 验证 Fe3+和SCN-的反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 检验补铁剂硫酸亚铁片是否被氧化 | 将K3[Fe(CN)6]溶液滴入硫酸亚铁片的水溶液 |
| B | 验证SO2的漂白性 | 将SO2通入酸性KMnO4溶液 |
| C | 制备少量的NH3 | 将浓氨水滴加到生石灰上 |
| D | 检验洁厕剂的主要成分是盐酸 | 向待测液中滴加硝酸银溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . SO2是硫元素中一种重要物质。在生产生活中有着重要用途。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。_____ 。根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
a.请设计实验方案检验溶液中是否还有Fe3+:_____ 。
b.该小组同学向C试管反应后的溶液中先加入稀硝酸,后加入BaCl2溶液,发现出现白色沉淀,即可证明反应生成了SO 。该做法
。该做法_____ (填“合理”或“不合理”),理由是_____ 。
②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有_____ (填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
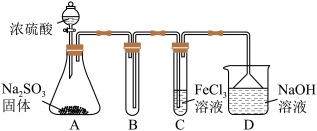
(2)某同学利用如图所示的装置研究SO2的性质:(已知熔点:SO2:-76.1℃,SO3:16.8℃,沸点:SO2:-10℃,SO3:45℃)_____ 。
②乙同学按Ⅰ、Ⅱ、III顺序连接装置,发现装置III溶液褪色,出现该现象的原因是_____ (用离子方程式表示)。
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL2.5mol·L-1NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是_____ 。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
a.请设计实验方案检验溶液中是否还有Fe3+:
b.该小组同学向C试管反应后的溶液中先加入稀硝酸,后加入BaCl2溶液,发现出现白色沉淀,即可证明反应生成了SO
 。该做法
。该做法②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(已知熔点:SO2:-76.1℃,SO3:16.8℃,沸点:SO2:-10℃,SO3:45℃)
②乙同学按Ⅰ、Ⅱ、III顺序连接装置,发现装置III溶液褪色,出现该现象的原因是
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL2.5mol·L-1NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是
您最近一年使用:0次
2024-04-03更新
|
271次组卷
|
2卷引用:重庆市万州第二高级中学2023-2024学年高一下学期3月月考试题 化学试题
名校
解题方法
9 . 巴蜀中学趣味化学实验小组的同学通过“ 被浓
被浓 氧化”的实验,验证
氧化”的实验,验证 的还原性.
的还原性.
实验一:验证 的还原性
的还原性
(1)红棕色气体是__________ 。(写化学式)
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加 溶液,溶液变为红色,该现象说明
溶液,溶液变为红色,该现象说明__________ 。
实验二:探究溶液变为深棕色的原因
【资料与猜想】
查阅资料后猜想,可能是生成的 或
或 与溶液中的
与溶液中的 或
或 反应,而使溶液变为深棕色。
反应,而使溶液变为深棕色。
【实验与探究】
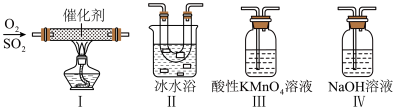
用如图所示装置进行实验(气密性已检验,尾气处理已略去)
ii.向甲中加入适量浓 ,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
iii.关闭b、打开c,更换丙、丁中的溶液(试剂不变);
iv.继续向甲中加入浓 ,一段时间后观察到了与ⅱ相同的实验现象。
,一段时间后观察到了与ⅱ相同的实验现象。
(3)通入 的目的是
的目的是__________ 。
(4)铜与浓硝酸反应的化学方程式是__________________ 。
(5)装置乙的作用是_______________________ 。
(6)实验结论:溶液的深棕色可能是因为__________。
【反思与改进】
实验三:验证 的还原性
的还原性
(7)该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是向盛有__________ 的试管中滴入几滴__________ ,振荡。
 被浓
被浓 氧化”的实验,验证
氧化”的实验,验证 的还原性.
的还原性.实验一:验证
 的还原性
的还原性实验操作 | 预期现象 | 实验现象 |
向盛有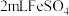 溶液的试管中,滴入几滴浓硝酸,振荡。 溶液的试管中,滴入几滴浓硝酸,振荡。 | 试管中产生红棕色气体,溶液变为黄色。 | 试管中产生红棕色气体,溶液变为深棕色。 |
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加
 溶液,溶液变为红色,该现象说明
溶液,溶液变为红色,该现象说明实验二:探究溶液变为深棕色的原因
【资料与猜想】
查阅资料后猜想,可能是生成的
 或
或 与溶液中的
与溶液中的 或
或 反应,而使溶液变为深棕色。
反应,而使溶液变为深棕色。【实验与探究】
用如图所示装置进行实验(气密性已检验,尾气处理已略去)
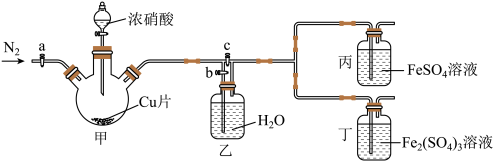
ii.向甲中加入适量浓
 ,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;iii.关闭b、打开c,更换丙、丁中的溶液(试剂不变);
iv.继续向甲中加入浓
 ,一段时间后观察到了与ⅱ相同的实验现象。
,一段时间后观察到了与ⅱ相同的实验现象。(3)通入
 的目的是
的目的是(4)铜与浓硝酸反应的化学方程式是
(5)装置乙的作用是
(6)实验结论:溶液的深棕色可能是因为__________。
A. 与 与 发生了反应 发生了反应 | B. 与 与 发生了反应 发生了反应 |
C.Fe3+与 发生了反应 发生了反应 | D. 与 与 发生了反应 发生了反应 |
【反思与改进】
实验三:验证
 的还原性
的还原性(7)该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是向盛有
您最近一年使用:0次
2023-09-10更新
|
405次组卷
|
3卷引用:重庆市巴蜀中学校2022-2023学年高一下学期3月月考化学试题
名校
解题方法
10 . 铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定

实验结果:将20.0 g铁矿石放入硬质玻璃管中完全反应,测得装置B增重6.30 g
Ⅱ.铁矿石中含铁量的测定

Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
(2)步骤④中煮沸的作用是_____________________________________________
(3)向步骤⑥反应后的溶液中滴加淀粉溶液,溶液变蓝,写出该反应的离子方程式______ 。
(4)请通过实验Ⅰ、Ⅱ计算出该铁矿石中铁的氧化物的化学式________ (写出计算过程)。
Ⅰ.铁矿石中含氧量的测定

实验结果:将20.0 g铁矿石放入硬质玻璃管中完全反应,测得装置B增重6.30 g
Ⅱ.铁矿石中含铁量的测定

Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 | 滤液A中有Fe2+ | |
| 步骤2:在滤液A中加入 | 滤液A中有Fe3+ |
(3)向步骤⑥反应后的溶液中滴加淀粉溶液,溶液变蓝,写出该反应的离子方程式
(4)请通过实验Ⅰ、Ⅱ计算出该铁矿石中铁的氧化物的化学式
您最近一年使用:0次
2020-11-25更新
|
432次组卷
|
4卷引用:重庆市第七中学校2021-2022高一上学期第四次月检测化学试题



