名校
解题方法
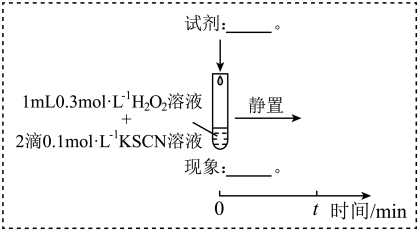
1 . 某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验I:
(1)实验I中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是__ 。
(2)探究实验I中红色褪去的原因:取反应后溶液,___ (填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:__ 。
实验II:
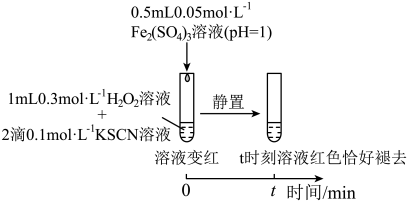
实验III:
(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,___ 。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:____ 。
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有___ 。
实验I:
| 装置与操作 | 现象 |
 | 溶液立即变红,继续滴加H2O2溶液,红色变浅并逐渐褪去 |
(2)探究实验I中红色褪去的原因:取反应后溶液,
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:
实验II:

实验III:

(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有
您最近一年使用:0次
2021-08-13更新
|
633次组卷
|
7卷引用:考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)
名校
解题方法
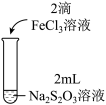
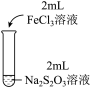
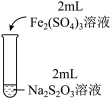
2 . 某实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
资料:ⅰ.Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ⅱ.Fe3++ ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象
(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:_______ 。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到_______ 。
②实验I中紫色褪去时 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是_______ 。
③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是_______ 。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是_______ 。
②由实验Ⅳ和实验Ⅴ得出的结论是_______ 。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
| 实验编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验操作 |
|
|
|
| 实验现象 | 溶液呈紫色, 静置后紫色迅速褪去, 久置后出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色褪去, 久置后不出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色缓慢褪去, 久置后不出现淡黄色浑浊 |
ⅱ.Fe3++
 ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到
②实验I中紫色褪去时
 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | Ⅳ | Ⅴ |
| 实验操作 | 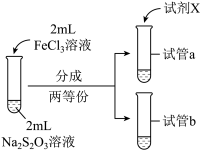 |  |
| 实验现象 | 紫色褪去时间a>b | 紫色褪去时间c<d |
②由实验Ⅳ和实验Ⅴ得出的结论是
您最近一年使用:0次
2021-01-20更新
|
1043次组卷
|
7卷引用:解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练北京市东城区2021届高三上学期期末教学统一检测化学试题辽宁省葫芦岛市2021届高考第一次模拟考试化学试题北京市清华大学附属中学2022-2023学年高二上学期期末化学试题北京理工大学附属中学2023-2024学年高三上学期10月月考化学试题
名校
3 . 化学与生产、生活密切相关。下列有关物质的性质与用途对应关系错误的是
| A.FeCl3溶液具有酸性,可用于蚀刻铜制品 |
| B.过氧乙酸具有强氧化性,可用于杀菌消毒 |
| C.甘油具有吸水性,可用作化妆品的保湿剂 |
| D.Na具有还原性,可用于高温下与TiCl4反应制备Ti |
您最近一年使用:0次
2021-03-03更新
|
452次组卷
|
5卷引用:2023年1月浙江省普通高校招生选考变式题(选择题1-5)
(已下线)2023年1月浙江省普通高校招生选考变式题(选择题1-5)(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(选择题1-5)江苏省常州市2021届高三下学期期初调研考试化学试题河北省张家口市宣化第一中学2021届高三下学期阶段模拟(五)化学试题吉林省松原市实验高级中学2020-2021学年高三下学期第三次摸底测试化学试题
名校
4 . 甘氨酸亚铁[(H2NCH2COO)2Fe]可有效改善缺铁性贫血,化学兴趣小组的同学设计了如下两个实验:装置1制备碳酸亚铁晶体;装置2制备甘氨酸亚铁。已知:柠檬酸易溶于水,具有较强的酸性和还原性。回答下列问题:
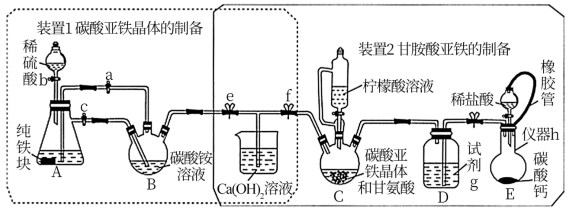
I.碳酸亚铁晶体(FeCO3·nH2O)的制备
(1)实验操作如下:关闭f,打开e,然后关闭活塞a,打开活塞b、c,加入适量稀硫酸反应一段时间后,关闭活塞b、c,打开活塞a,以上操作的目的为_______ 并使A产生的硫酸亚铁压入到B装置中发生反应;实验结束后,若装置B中没有出现碳酸亚铁晶体,可能的原因是_______ 。
(2)反应结束后,对装置B中的反应液进行静置、过滤、洗涤、干燥,得到碳酸亚铁晶体。过滤操作过程中用到的玻璃仪器有烧杯_______ ;干燥过程中可能有少量碳酸亚铁晶体被氧化为FeOOH,检验该氧化产物中阳离子所用的化学试剂为_______
II.甘氨酸亚铁[(H2NCH2COO)2Fe]的制备
实验操作如下:将装置1制取的碳酸亚铁晶体与甘氨酸的水溶液混合加入C中,关闭e,打开f,然后利用E中盐酸和碳酸钙反应生成的气体排尽装置中的空气,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。
(3)仪器h的名称为_______ ;试剂g为_______
(4)为了提高(H2NCH2COO)2Fe的产率,需要控制C中反应溶液的pH在5.6~6.0之间。若pH过低,(H2NCH2COO)2Fe的产率将降低,其原因为_______ ,滴入柠檬酸溶液的作用除了促进FeCO3的溶解,调节溶液的pH外,还有_______ 。
(5)(H2NCH2COO)2Fe中Fe2+含量的测定:使用电子天平准确称取3.440g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,向其中加入一定量的稀硫酸酸化,用0.05000mol·L-1KMnO4;标准溶液滴定至终点(已知滴定过程中只有Fe2+被氧化),消耗KMnO4标准溶液的体积为17.20mL。则产品中Fe2+的质量分数为_______

I.碳酸亚铁晶体(FeCO3·nH2O)的制备
(1)实验操作如下:关闭f,打开e,然后关闭活塞a,打开活塞b、c,加入适量稀硫酸反应一段时间后,关闭活塞b、c,打开活塞a,以上操作的目的为
(2)反应结束后,对装置B中的反应液进行静置、过滤、洗涤、干燥,得到碳酸亚铁晶体。过滤操作过程中用到的玻璃仪器有烧杯
II.甘氨酸亚铁[(H2NCH2COO)2Fe]的制备
实验操作如下:将装置1制取的碳酸亚铁晶体与甘氨酸的水溶液混合加入C中,关闭e,打开f,然后利用E中盐酸和碳酸钙反应生成的气体排尽装置中的空气,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。
(3)仪器h的名称为
(4)为了提高(H2NCH2COO)2Fe的产率,需要控制C中反应溶液的pH在5.6~6.0之间。若pH过低,(H2NCH2COO)2Fe的产率将降低,其原因为
(5)(H2NCH2COO)2Fe中Fe2+含量的测定:使用电子天平准确称取3.440g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,向其中加入一定量的稀硫酸酸化,用0.05000mol·L-1KMnO4;标准溶液滴定至终点(已知滴定过程中只有Fe2+被氧化),消耗KMnO4标准溶液的体积为17.20mL。则产品中Fe2+的质量分数为
您最近一年使用:0次
解题方法
5 . 某同学看到“利用零价铁还原 脱除地下水中硝酸盐”的相关资料后,利用如图装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:
脱除地下水中硝酸盐”的相关资料后,利用如图装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:
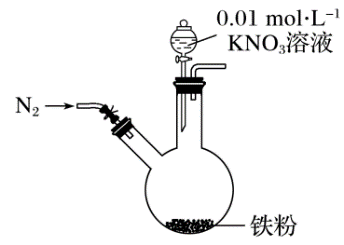
(1)通入N2并保持后续反应均在N2氛围中进行的实验目的是_______ 。
(2)白色物质是_______ (写化学式)。
(3)为了探究滤液的成分,该同学进一步设计了下述实验:
(ⅰ)根据以上实验现象,可以判断滤液中存在_______ (填离子符号)。
(ⅱ)步骤②中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因:_______ (写第一步反应)。
(ⅲ)步骤③中生成气体的离子方程式为_______ 。
 脱除地下水中硝酸盐”的相关资料后,利用如图装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:
脱除地下水中硝酸盐”的相关资料后,利用如图装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:
| 实验步骤 | 实验现象 |
| ①打开弹簧夹,缓慢通入N2 | |
| ②加入0.01mol·L-1的酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色;铁粉不再溶解后,剩余铁粉表面附着少量白色物质 |
| ③反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化 |
| ④将剩余固体过滤 | 表面的白色物质变为红褐色 |
(2)白色物质是
(3)为了探究滤液的成分,该同学进一步设计了下述实验:
| 实验步骤 | 实验现象 |
| ①取部分滤液于试管中,向其中加入KSCN溶液 | 溶液无变化 |
| ②将上述溶液分为两份,一份中滴入氯水,另一份中滴加稀硫酸 | 两份溶液均变为红色 |
| ③另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸 | 有气体生成,该气体使湿润的红色石蕊试纸变蓝 |
(ⅱ)步骤②中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因:
(ⅲ)步骤③中生成气体的离子方程式为
您最近一年使用:0次
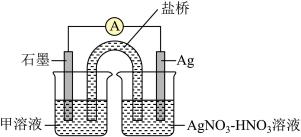
6 . 某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,_______ (填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有Fe2+。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________ (用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测,同时发现有白色沉淀生成,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________ (用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______ 现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________ 溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________ ,操作及现象是________________ 。_______________ 。
(1)检验产物
①取出少量黑色固体,洗涤后,
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有Fe2+。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测,同时发现有白色沉淀生成,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较30min时变浅 |
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的
实验Ⅱ:装置如图。其中甲溶液是
您最近一年使用:0次
2017-08-08更新
|
5139次组卷
|
23卷引用:考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价(已下线)解密18 物质的制备、实验方案的设计与评价——备战2018年高考化学之高频考点解密(已下线)考点07 元素化合物综合——《备战2020年高考精选考点专项突破题集》(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)专题16 化学实验综合应用-备战2021届高考化学二轮复习题型专练(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)题型48 实验原理探究型综合实验2017年全国普通高等学校招生统一考试理综化学(北京卷精编版)贵州省遵义航天高级中学2018届高三第一次模拟考试(9月月考)理科综合化学试题辽宁省实验中学分校2018届高三12月月考理科综合化学试题湖南长沙长郡中学2020届高三2月份网络教学质量监测卷理综化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题河北省衡水中学2020年高中毕业班教学质量监测卷理科综合化学试题湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题北京市第四十三中学2021-2022学年高三上学期期中考试化学试题北京市中国人民大学附属中学2023-2024学年高三上学期期末考前化学练习 广东省广州市普通高中2024届高三下学期毕业班冲刺训练题(二)化学试题北京市第二十二中学2023-2024学年高一下学期期中考试化学试题北京市丰台区第二中学2024届高三下学期三模化学试题
名校
解题方法
7 . 铁及其化合物可制得FeSO4·7H2O、FeCl3、K2FeO4等化工产品,它们在生产、生活中具有广泛应用,印刷电路板原理:2FeCl3+Cu=2FeCl2+CuCl2。下列关于物质的性质与用途具有对应关系的是
| A.Fe具有还原性,可用作抗氧化剂 | B.Fe具有导电性,可用于湿法炼铜 |
| C.FeCl3溶液具有氧化性,可用于净水 | D.FeCl3溶液呈酸性,可用于刻蚀铜板 |
您最近一年使用:0次
2022-03-22更新
|
335次组卷
|
4卷引用:2019年高考浙江卷化学试题变式题(单选题21-25)
(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题江苏省靖江高级中学、丹阳中学、沭阳中学三校2021-2022学年高三上学期12月联考化学试题广东省梅州市大埔县虎山中学2022-2023学年高三上学期12月月考化学试题
2021高三·全国·专题练习
8 . 判断正误
(1)金属阳离子只有氧化性,不可能有还原性_______
(2)FeCl3可与铜发生置换反应_______
(3)氯化铁溶液有较强氧化性,故可用作净水剂_______
(4)Fe3O4中Fe的化合价有+2价和+3价,因而Fe3O4是FeO与Fe2O3的混合物_______
(5)FeCl3、FeCl2和Fe(OH)3都可以通过化合反应制取_______
(6)氢氧化铁与HI溶液反应仅能发生中和反应_______
(7)中性溶液中可能大量存在Fe3+、Cl-、K+、
_______
(8)FeCl3腐蚀Cu刻制印刷电路板,说明铁比铜金属性强_______
(9)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释_______
(10)Fe和Fe2O3等物质的量混合物溶于稀盐酸时无气体放出_______
(11)Fe2O3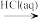 FeCl3(aq)
FeCl3(aq) 无水FeCl3,在给定的条件下能实现转化
无水FeCl3,在给定的条件下能实现转化_______
(12)给定条件下,能实现转化:Fe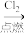 FeCl2
FeCl2 Fe(OH)2
Fe(OH)2_______
(13)将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体_______
(1)金属阳离子只有氧化性,不可能有还原性
(2)FeCl3可与铜发生置换反应
(3)氯化铁溶液有较强氧化性,故可用作净水剂
(4)Fe3O4中Fe的化合价有+2价和+3价,因而Fe3O4是FeO与Fe2O3的混合物
(5)FeCl3、FeCl2和Fe(OH)3都可以通过化合反应制取
(6)氢氧化铁与HI溶液反应仅能发生中和反应
(7)中性溶液中可能大量存在Fe3+、Cl-、K+、

(8)FeCl3腐蚀Cu刻制印刷电路板,说明铁比铜金属性强
(9)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
(10)Fe和Fe2O3等物质的量混合物溶于稀盐酸时无气体放出
(11)Fe2O3
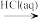 FeCl3(aq)
FeCl3(aq) 无水FeCl3,在给定的条件下能实现转化
无水FeCl3,在给定的条件下能实现转化(12)给定条件下,能实现转化:Fe
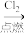 FeCl2
FeCl2 Fe(OH)2
Fe(OH)2(13)将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体
您最近一年使用:0次
2021高三·浙江·专题练习
9 . 某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
①实验Ⅰ的现象为_______________________________________________ 。
②FeCl2溶液与新制氯水反应的离子方程式为________________________________________________ 。
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
根据实验Ⅲ,该同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由:_____________________________________________________________ 。
(3)该同学认为需要进一步设计实验,证明根据实验Ⅲ中现象得出的结论。请补全下表中的实验方案:
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红的原因,认为Fe3+与I-反应的离子方程式应写为_______________________________________________________________ 。
(1)该同学最初的实验操作和现象如下:
编号 | 操作 | 现象 |
Ⅰ | 先向2 mL 0.1 mol·L-1 FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
Ⅱ | 先向2 mL 0.1 mol·L-1 FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol·L-1 KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加KI溶液后,血红色无明显变化 |
②FeCl2溶液与新制氯水反应的离子方程式为
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
编号 | 操作 | 现象 |
Ⅲ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL 0.1 mol·L-1 FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
(3)该同学认为需要进一步设计实验,证明根据实验Ⅲ中现象得出的结论。请补全下表中的实验方案:
编号 | 操作 | 预期现象及结论 |
Ⅳ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL0.1 mol·L-1 FeCl3溶液, |
您最近一年使用:0次
2021高三·浙江·专题练习
解题方法
10 . 茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
【查阅部分资料】草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。

试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是__________________________________________ 。
(2)写出检验Ca2+的离子方程式:__________________________________ 。
(3)写出沉淀C所含主要物质的化学式:________________________________ 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式:___________________ 。
(5)步骤⑨的作用是_________________________________________ ;猜测步骤⑩的目的是______________________________________________ 。
【查阅部分资料】草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。

试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是
(2)写出检验Ca2+的离子方程式:
(3)写出沉淀C所含主要物质的化学式:
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式:
(5)步骤⑨的作用是
您最近一年使用:0次