名校
1 . 完成下列问题
(1)检验NH 的实验方法
的实验方法___________ ;
(2)检验FeCl2、FeCl3混合溶液中的Fe2+的实验方法___________ ;
(3)解释生石灰和浓氨水反应能放出NH3的原因___________ ;
(4)SO2通入品红溶液中,一段时间后加热的现象及原因___________ 。
(1)检验NH
 的实验方法
的实验方法(2)检验FeCl2、FeCl3混合溶液中的Fe2+的实验方法
(3)解释生石灰和浓氨水反应能放出NH3的原因
(4)SO2通入品红溶液中,一段时间后加热的现象及原因
您最近一年使用:0次
23-24高二上·全国·课时练习
解题方法
2 . 对于反应FeCl3+3KSCN Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
Fe(SCN)3+3KCl,加入KCl固体平衡是否移动________ ?为什么________ ?
 Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
您最近一年使用:0次
3 . 中国“奋斗号”载人潜水器在马里亚纳海沟成功坐底深度10909米,挑战了全球海洋最深处。国产新型钛合金、能源供给锂电池等功不可没。磷酸亚铁锂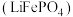 可作为锂电池的正极材料,请回答下列问题:
可作为锂电池的正极材料,请回答下列问题:
(1)潜水器外壳使用的钛合金不可能具有的性质是______(单选).
(2)锂电池工作时,将化学能转化为______ 。
(3)锂位于元素周期表中第______ 周期______ 族;磷酸亚铁锂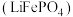 中
中 的化合价为
的化合价为______ .
(4)铁的原子结构示意图为 .由此可知,铁的原子序数为
.由此可知,铁的原子序数为______ ;x为______ ;铁元素是______ (双选).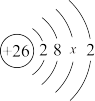 A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是______(单选).
(6)能与 反应,且可证明
反应,且可证明 具有氧化性的是______(双选).
具有氧化性的是______(双选).
(7)除去氯化亚铁溶液中的氯化铁,需加入______ ,发生的离子反应为______ ,要检验废液中是否还存在 ,实验方案是
,实验方案是____________ 。
(8) 可作载人潜水器供氧剂,下列关于
可作载人潜水器供氧剂,下列关于 说法正确的是______(单选)。
说法正确的是______(单选)。
钛因为具有神奇的性能越来越引起人们的关注.常温下钛不与非金属、强酸反应。目前大规模生产钛的方法是,第一步将金红石(含 )、炭粉混合,在高温条件下通入
)、炭粉混合,在高温条件下通入 制得
制得 :
: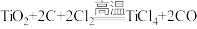 ①;第二步在氩气的气氛中,用过量的镁在加热条件下与
①;第二步在氩气的气氛中,用过量的镁在加热条件下与 反应制得金属钛:
反应制得金属钛: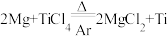 ②。
②。
(9)反应①的还原剂为______ ,反应消耗了标准状况下 氯气,则反应①转移的电子数为
氯气,则反应①转移的电子数为___ 。
(10)简述从反应②所得产物中获取金属钛的步骤:______________ 。
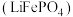 可作为锂电池的正极材料,请回答下列问题:
可作为锂电池的正极材料,请回答下列问题:(1)潜水器外壳使用的钛合金不可能具有的性质是______(单选).
| A.耐高压 | B.耐腐蚀 | C.硬度小 | D.密度小 |
(3)锂位于元素周期表中第
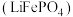 中
中 的化合价为
的化合价为(4)铁的原子结构示意图为
 .由此可知,铁的原子序数为
.由此可知,铁的原子序数为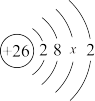 A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
A.主族元素 B.副族元素 C.短周期元素 D.长周期元素(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是______(单选).
A. | B. | C. | D. |
 反应,且可证明
反应,且可证明 具有氧化性的是______(双选).
具有氧化性的是______(双选).A. | B. | C. | D. |
 ,实验方案是
,实验方案是(8)
 可作载人潜水器供氧剂,下列关于
可作载人潜水器供氧剂,下列关于 说法正确的是______(单选)。
说法正确的是______(单选)。| A.只有离子键 | B.可在常温下由 与 与 反应制得 反应制得 |
C.与 发生化合反应 发生化合反应 | D.与 反应有 反应有 生成 生成 |
钛因为具有神奇的性能越来越引起人们的关注.常温下钛不与非金属、强酸反应。目前大规模生产钛的方法是,第一步将金红石(含
 )、炭粉混合,在高温条件下通入
)、炭粉混合,在高温条件下通入 制得
制得 :
: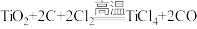 ①;第二步在氩气的气氛中,用过量的镁在加热条件下与
①;第二步在氩气的气氛中,用过量的镁在加热条件下与 反应制得金属钛:
反应制得金属钛: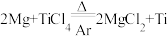 ②。
②。(9)反应①的还原剂为
 氯气,则反应①转移的电子数为
氯气,则反应①转移的电子数为(10)简述从反应②所得产物中获取金属钛的步骤:
您最近一年使用:0次
名校
解题方法
4 . 金属及其材料在人类文明进步和社会发展中起着至关重要的作用。
(1)下列性质中,不属于金属的物理性质的是_______。
(2)下列属于金属材料的是_______。
(3)合金具有许多优良的性能,我国C919大型飞机上就使用了大量新型材料铝合金。下列物质属于合金的是_______。
(4)室温下金属钠长期露置在空气中,最终将变为_______。
(5)为了检验FeCl2溶液是否被氧化,可向溶液中加入_______。
(6)金属钠在空气中受热,先熔化成银色的小球,然后剧烈燃烧,写出发生反应的化学方程式:_______ 。
(7)写出铁和水蒸气在高温下发生反应的方程式_______ 。
(8)向FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间,写出反应过程中产生的现象_______ ,并依次写出发生反应的化学方程式_______ 、_______ 。
(1)下列性质中,不属于金属的物理性质的是_______。
| A.反应中易失去电子 | B.良好的延展性 |
| C.良好的导电性和传热性 | D.有光泽 |
| A.塑料 | B.陶瓷 | C.金刚石 | D.钢铁 |
| A.水银 | B.青铜 | C.白银 | D.黄金 |
| A.Na2O | B.Na2O2 | C.Na2CO3 | D.NaOH |
| A.新制氯水 | B.铁片 | C.KSCN溶液 | D.石蕊试液 |
(7)写出铁和水蒸气在高温下发生反应的方程式
(8)向FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间,写出反应过程中产生的现象
您最近一年使用:0次
2023-01-12更新
|
182次组卷
|
2卷引用:上海市闵行(文绮)中学2022-2023学年高二上学期期末学情调研化学试题
5 . 回答下列问题
(1)向少量新制的氯化亚铁溶液中,加入几滴硫氰化钾溶液,溶液_______ 色;再加几滴氯水,溶液呈_______ 色,该实验体现了Fe2+的_______ 性。已知Fe(SCN)3中N为−3价,可推测S元素的化合价为_______ 价。
(2)FeCl2溶液与Cl2反应的化学方程式为_______ ,上述生成Fe(SCN)3反应的离子方程式为_______ 。
(3)除去FeCl2溶液中的少量FeCl3,可采用的试剂是_______ (填写化学式),该反应的离子方程式为_______ 。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为_______ ,反应的化学方程式为_______ 。
(1)向少量新制的氯化亚铁溶液中,加入几滴硫氰化钾溶液,溶液
(2)FeCl2溶液与Cl2反应的化学方程式为
(3)除去FeCl2溶液中的少量FeCl3,可采用的试剂是
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
您最近一年使用:0次
解题方法
6 . 缺铁性贫血是指人体内贮存的铁不足,影响血红蛋白合成而引起的一种细胞低血素贫血。
(1)已知某种硫酸盐可以用来治疗缺铁性贫血,制药厂在药片外包一层特制的糖衣,以防止它在空气中变质、失效。
①该药品的化学式为________ 。
②怎样证明该药品溶液中含有Fe2+?________________________________ 。
③请你设计一个实验,以证明该药片是否变质。__________________________ 。
(2)已知Fe2+更容易被人体吸收。服用补铁剂的同时,服用一定量的维生素C效果更好,其原因是________________________ 。
(1)已知某种硫酸盐可以用来治疗缺铁性贫血,制药厂在药片外包一层特制的糖衣,以防止它在空气中变质、失效。
①该药品的化学式为
②怎样证明该药品溶液中含有Fe2+?
③请你设计一个实验,以证明该药片是否变质。
(2)已知Fe2+更容易被人体吸收。服用补铁剂的同时,服用一定量的维生素C效果更好,其原因是
您最近一年使用:0次
名校
7 . 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]又称莫尔盐,是一种浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如图:
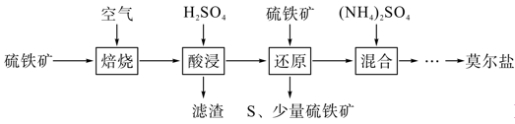
(1)“焙烧”时发生的主要反应是4FeS2+11O2 2Fe2O3+8SO2,则“酸浸”时,滤渣的主要成分是
2Fe2O3+8SO2,则“酸浸”时,滤渣的主要成分是_____ (写化学式)。
(2)“酸浸”时发生的主要反应的离子方程式为_____ 。
(3)证明“还原”后所得溶液中不含有Fe3+的实验方法是:取少许晶体置于试管中,加少量水溶解,滴加_____ 溶液,若无明显现象,则不含有Fe3+。

(1)“焙烧”时发生的主要反应是4FeS2+11O2
 2Fe2O3+8SO2,则“酸浸”时,滤渣的主要成分是
2Fe2O3+8SO2,则“酸浸”时,滤渣的主要成分是(2)“酸浸”时发生的主要反应的离子方程式为
(3)证明“还原”后所得溶液中不含有Fe3+的实验方法是:取少许晶体置于试管中,加少量水溶解,滴加
您最近一年使用:0次
名校
8 . 有四种常见药物①维生素C;②青霉素;③胃舒平;④麻黄碱。回答下列问题:
(1)某同学胃酸过多,应选用的药物是_______ (填序号)。抗酸药是治疗胃酸过多的一类药物,写出一种抗酸药与胃酸反应的化学方程式_______ 。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是_______ (填序号)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是_______ (填序号)。
(4)_______ (填序号)又称为抗坏血酸,它的分子式为_______ 。
(5)为预防缺铁性贫血,一些食品中加入了铁元素(含Fe2+物质)。若向铁强化牛奶中滴加KSCN溶液,发现牛奶变为红色,说明_______ ,此时若向其中加入一片维生素C,则发现红色消失,该实验说明维生素C具有_______ 性。
(1)某同学胃酸过多,应选用的药物是
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是
(4)
(5)为预防缺铁性贫血,一些食品中加入了铁元素(含Fe2+物质)。若向铁强化牛奶中滴加KSCN溶液,发现牛奶变为红色,说明
您最近一年使用:0次
名校
解题方法
9 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
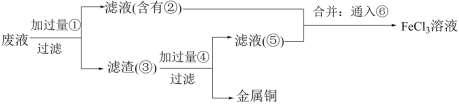
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
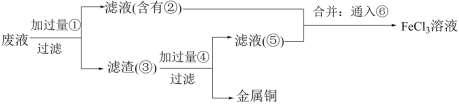
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
408次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
10 . 实验探究浓度对化学平衡的影响
| 实验原理 | Fe3++3SCN- Fe(SCN)3(血红色) Fe(SCN)3(血红色) | |
| 步骤1 | 向盛有5 mL 0.010 mol·L-1 FeCl3溶液的试管中加入5 mL 0.01 mol·L-1 KSCN溶液,将溶液均分置于两支试管中 | |
| 现象 | 溶液 | |
| 步骤2 | 向其中一支试管滴加1 mol·L-1 FeCl3溶液4滴,振荡 | 向另一支试管中滴加1 mol·L-1 KSCN溶液4滴 |
| 现象 | 溶液 | 溶液 |
| 步骤 | 向上述两支试管中各加入少量铁粉,振荡 | |
| 现象 | 两试管中溶液的红色均 | |
| 实验结论 | 增大c(Fe3+)和c(SCN-),化学平衡均向正反应方向移动;加入铁粉,减小Fe3+浓度,平衡逆向移动 | |
您最近一年使用:0次



