解题方法
1 . 以废旧锌锰干电池的炭包(含炭粉、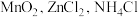 和少量
和少量 等物质)为原料回收
等物质)为原料回收 的工艺流程如下:回答下列问题:
的工艺流程如下:回答下列问题:
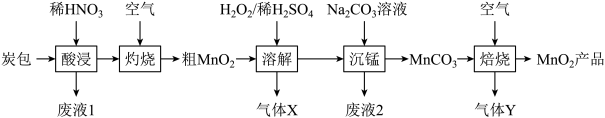
(1)在“酸浸”时为了加快浸出速率,可采取的措施有___________ 、___________ 。(写出两点),“酸浸”过程中稀硝酸是过量的,用于检验 和稀硝酸反应生成的金属阳离子的试剂是
和稀硝酸反应生成的金属阳离子的试剂是___________ 。
(2)在粗 溶解过程中所用的
溶解过程中所用的 高于理论用量,原因是
高于理论用量,原因是___________ 。(用化学方程式表示)
(3)沉锰后焙烧时,发生反应的化学方程式为___________ 。
(4)一种 打印机的柔性电池以碳纳米管作电极材料,以吸收
打印机的柔性电池以碳纳米管作电极材料,以吸收 溶液的有机高聚物为固态电解质,工作原理示意图如图1,电池总反应为
溶液的有机高聚物为固态电解质,工作原理示意图如图1,电池总反应为
 (不溶于水)
(不溶于水) 。
。
请回答下列问题。
①放电时正极质量___________ (填“增大”、“减小”或“不变”);充电时, 向
向___________ (填“锌膜”或“ 膜”)移动。
膜”)移动。
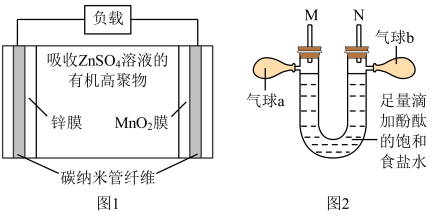
②以该电池为电源电解如图2所示的饱和食盐水。若 膜连接
膜连接 极,锌膜连接
极,锌膜连接 极,工作一段时间,图2中右侧的现象为
极,工作一段时间,图2中右侧的现象为___________ , 极的电极反应为
极的电极反应为___________ 。
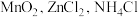 和少量
和少量 等物质)为原料回收
等物质)为原料回收 的工艺流程如下:回答下列问题:
的工艺流程如下:回答下列问题:
(1)在“酸浸”时为了加快浸出速率,可采取的措施有
 和稀硝酸反应生成的金属阳离子的试剂是
和稀硝酸反应生成的金属阳离子的试剂是(2)在粗
 溶解过程中所用的
溶解过程中所用的 高于理论用量,原因是
高于理论用量,原因是(3)沉锰后焙烧时,发生反应的化学方程式为
(4)一种
 打印机的柔性电池以碳纳米管作电极材料,以吸收
打印机的柔性电池以碳纳米管作电极材料,以吸收 溶液的有机高聚物为固态电解质,工作原理示意图如图1,电池总反应为
溶液的有机高聚物为固态电解质,工作原理示意图如图1,电池总反应为 (不溶于水)
(不溶于水) 。
。请回答下列问题。
①放电时正极质量
 向
向 膜”)移动。
膜”)移动。
②以该电池为电源电解如图2所示的饱和食盐水。若
 膜连接
膜连接 极,锌膜连接
极,锌膜连接 极,工作一段时间,图2中右侧的现象为
极,工作一段时间,图2中右侧的现象为 极的电极反应为
极的电极反应为
您最近一年使用:0次
2 . 至今为止,铁是人类冶炼和使用最多的金属。铁及其化合物在生产生活中,乃至国防建设等都发挥着重要作用。某校化学社成员对铁的部分重要化合物进行了系列实验。
Ⅰ.四氧化三铁的光热效应在热量感应、电磁波吸收和纳米材料加热方面具有广泛的应用。例如,在医学领域中,可以利用四氧化三铁的光热效应进行热疗,用于治疗肿瘤等疾病。该校化学社成员利用如图所示装置进行了“铁与水蒸气反应”的实验制备 ,请回答下列问题:
,请回答下列问题:
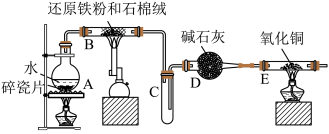
(1)装有碱石灰的仪器D的名称是________ ;装置A的作用是________ 。
(2)装置B中发生反应的化学方程式是________ 。
(3)实验结束后,某成员甲同学认为可以用磁铁吸引产物来确定产物中有未反应的铁粉,有另一成员乙同学认为用此方法判断不妥,你觉得乙同学的依据是________ 。
Ⅱ.氯化铁主要用于金属蚀刻,污水处理。该校化学社成员将Ⅰ中得到的产物溶于稀盐酸中得到溶液a,向溶液a中通入氯气后用此溶液制备 晶体。
晶体。
(4)检验溶液a中是否含 的具体操作及现象为
的具体操作及现象为________ 。
Ⅲ.胶体可以吸附水中悬浮颗粒并沉降而常用来作净水剂。该校化学社成员将得到的 晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
(5)制备方法:在小烧杯中加入50mL蒸馏水,加热至沸腾,向沸水中加入5~6滴饱和 溶液,继续煮沸至液体呈红褐色,停止加热,即可得到
溶液,继续煮沸至液体呈红褐色,停止加热,即可得到 胶体,其反应的化学方程式为
胶体,其反应的化学方程式为________ 。鉴别 胶体和
胶体和 溶液除了观察颜色外,最好的方法是通过
溶液除了观察颜色外,最好的方法是通过________ 判断。
(6)高铁酸钠溶液杀灭病菌后也可以得到氢氧化铁胶体,进而起到净水的作用。其化学反应主要为 (未配平),
(未配平), 的化学式为
的化学式为________ ,请写出配平的化学方程式:________ 。
Ⅰ.四氧化三铁的光热效应在热量感应、电磁波吸收和纳米材料加热方面具有广泛的应用。例如,在医学领域中,可以利用四氧化三铁的光热效应进行热疗,用于治疗肿瘤等疾病。该校化学社成员利用如图所示装置进行了“铁与水蒸气反应”的实验制备
 ,请回答下列问题:
,请回答下列问题:
(1)装有碱石灰的仪器D的名称是
(2)装置B中发生反应的化学方程式是
(3)实验结束后,某成员甲同学认为可以用磁铁吸引产物来确定产物中有未反应的铁粉,有另一成员乙同学认为用此方法判断不妥,你觉得乙同学的依据是
Ⅱ.氯化铁主要用于金属蚀刻,污水处理。该校化学社成员将Ⅰ中得到的产物溶于稀盐酸中得到溶液a,向溶液a中通入氯气后用此溶液制备
 晶体。
晶体。(4)检验溶液a中是否含
 的具体操作及现象为
的具体操作及现象为Ⅲ.胶体可以吸附水中悬浮颗粒并沉降而常用来作净水剂。该校化学社成员将得到的
 晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。(5)制备方法:在小烧杯中加入50mL蒸馏水,加热至沸腾,向沸水中加入5~6滴饱和
 溶液,继续煮沸至液体呈红褐色,停止加热,即可得到
溶液,继续煮沸至液体呈红褐色,停止加热,即可得到 胶体,其反应的化学方程式为
胶体,其反应的化学方程式为 胶体和
胶体和 溶液除了观察颜色外,最好的方法是通过
溶液除了观察颜色外,最好的方法是通过(6)高铁酸钠溶液杀灭病菌后也可以得到氢氧化铁胶体,进而起到净水的作用。其化学反应主要为
 (未配平),
(未配平), 的化学式为
的化学式为
您最近一年使用:0次
名校
3 . 按要求完成下列各题:
Ⅰ.用 和
和 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①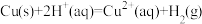 △H1=+64.39kJ/mol
△H1=+64.39kJ/mol
②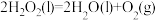 △H2=-196.46kJ/mol
△H2=-196.46kJ/mol
③ △H3=-285.84kJ/mol
△H3=-285.84kJ/mol
(1)在 溶液中,Cu与
溶液中,Cu与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为________ 。
Ⅱ.硫有多种化合物,如H2S、SO2等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(2)将 通入以下溶液,均会发生颜色变化,其中体现
通入以下溶液,均会发生颜色变化,其中体现 还原性的是________(填字母)。
还原性的是________(填字母)。
(3)有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成 而实现SO2的回收利用,写出Fe3+将
而实现SO2的回收利用,写出Fe3+将 氧化成
氧化成 反应的离子方程式
反应的离子方程式________ 。
(4)含有Fe2+、Fe3+的硫酸盐混合溶液可用于吸收H2S回收硫单质,其转化关系如图所示。该图示中总反应的化学方程式为________ 。

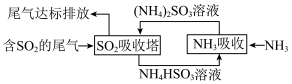
(5)某企业利用下列流程(如图)综合处理工厂排放的含 的烟气,以减少其对环境造成的污染。“
的烟气,以减少其对环境造成的污染。“ 吸收塔”中发生反应的化学方程式为
吸收塔”中发生反应的化学方程式为________ ,该流程中可循环利用的物质为________ (填化学式)。
Ⅰ.用
 和
和 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:①
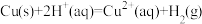 △H1=+64.39kJ/mol
△H1=+64.39kJ/mol②
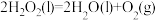 △H2=-196.46kJ/mol
△H2=-196.46kJ/mol③
 △H3=-285.84kJ/mol
△H3=-285.84kJ/mol(1)在
 溶液中,Cu与
溶液中,Cu与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为Ⅱ.硫有多种化合物,如H2S、SO2等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(2)将
 通入以下溶液,均会发生颜色变化,其中体现
通入以下溶液,均会发生颜色变化,其中体现 还原性的是________(填字母)。
还原性的是________(填字母)。| A.使溴水褪色 | B.使品红溶液褪色 |
| C.使滴有酚酞的氢氧化钠溶液褪色 | D.使氢硫酸溶液中出现淡黄色浑浊 |
(3)有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成
 而实现SO2的回收利用,写出Fe3+将
而实现SO2的回收利用,写出Fe3+将 氧化成
氧化成 反应的离子方程式
反应的离子方程式(4)含有Fe2+、Fe3+的硫酸盐混合溶液可用于吸收H2S回收硫单质,其转化关系如图所示。该图示中总反应的化学方程式为

(5)某企业利用下列流程(如图)综合处理工厂排放的含
 的烟气,以减少其对环境造成的污染。“
的烟气,以减少其对环境造成的污染。“ 吸收塔”中发生反应的化学方程式为
吸收塔”中发生反应的化学方程式为
您最近一年使用:0次
2023-12-11更新
|
68次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高三上学期12月考试化学试卷
名校
解题方法
4 . 已知A是一种常见金属,B的俗称为磁性氧化铁,C溶液呈浅绿色。试根据图中转化关系,回答下列问题。

(1)写出B和G的化学式:B______________ 、G______________ ;
(2)检验D中少量阳离子的最佳试剂的化学式是_______________ ;
(3)实验室在长期保存C溶液的过程中会加入少量_____________ ;
(4)写出下列转化的化学方程式:
① D→C_________________ ;
② C→D_______________________ ;
(5)E在空气中放置容易转化为F,产生的现象为______________ 。

(1)写出B和G的化学式:B
(2)检验D中少量阳离子的最佳试剂的化学式是
(3)实验室在长期保存C溶液的过程中会加入少量
(4)写出下列转化的化学方程式:
① D→C
② C→D
(5)E在空气中放置容易转化为F,产生的现象为
您最近一年使用:0次
2023-07-18更新
|
203次组卷
|
2卷引用:广西百色市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
5 . 石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)和Fe2O3(3.1%)等杂质,提纯与综合利用工艺流程如下:
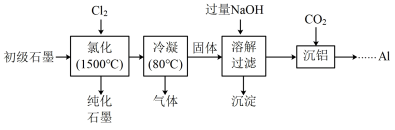
已知:①氯化后,石墨中氧化物杂质均转变为相应的氯化物;
②SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃。
(1)“氯化”时,先向反应器中通入Cl2一段时间,再加热,主要目的是________ 。
(2)“冷凝”后,所得“气体”的成分有Cl2和______ ( 填化学式)。
(3)“溶解过滤”时,加过量NaOH溶液的目的是________ ;取少量滤液于试管中,________________ (实验操作及现象),证明沉淀已完全。
(4)“沉铝”时,通入过量的CO2得到Al(OH)3沉淀,该反应的离子方程式为________________ ;工业上由Al(OH)3得到Al,需发生以下两步反应,写出第二步的化学方程式:2Al(OH)3 Al2O3+3H2O、
Al2O3+3H2O、___________ 。
(5)工业上利用100kg初级石墨经上述流程,可生产出2.43kgAl,其产率为__________ 。

已知:①氯化后,石墨中氧化物杂质均转变为相应的氯化物;
②SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃。
(1)“氯化”时,先向反应器中通入Cl2一段时间,再加热,主要目的是
(2)“冷凝”后,所得“气体”的成分有Cl2和
(3)“溶解过滤”时,加过量NaOH溶液的目的是
(4)“沉铝”时,通入过量的CO2得到Al(OH)3沉淀,该反应的离子方程式为
 Al2O3+3H2O、
Al2O3+3H2O、(5)工业上利用100kg初级石墨经上述流程,可生产出2.43kgAl,其产率为
您最近一年使用:0次
2023-07-07更新
|
140次组卷
|
2卷引用:广西壮族自治区玉林市2022-2023学年高一下学期7月期末化学试题
名校
解题方法
6 . 金属钛在航天、医疗等领域有着广泛的应用。工业上用钛铁矿(主要成分为FeTiO3,含有Fe2O3、CaO、SiO2等杂质)为原料制备金属钛的工艺流程如下:
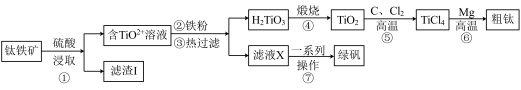
已知:FeTiO3中Fe为+2价;高温下钛易与N2、H2反应。
(1)提高①中浸取反应速率可采取的措施有___________ (答两条)。
(2)“滤渣I”的主要成分为___________ 。
(3)钛铁矿与硫酸发生非氧化还原反应,生成TiOSO4,试写出该反应的化学方程式________ 。
(4)⑥中镁与TiCl4高温下反应制备粗钛时需加保护气,下列可作为保护气的是________ (填标号)。
a.H2 b.Ar c.Cl2 d.N2
(5)⑦中经过“一系列操作”可获得副产品绿矾( ),其过程包括
),其过程包括_____ 、洗涤、干燥。
(6)绿矾易被氧化而变质。现取在空气中放置一段时间的某绿矾样品,请选择合适的试剂,设计实验方案,证明该样品被部分氧化:___________ 。

已知:FeTiO3中Fe为+2价;高温下钛易与N2、H2反应。
(1)提高①中浸取反应速率可采取的措施有
(2)“滤渣I”的主要成分为
(3)钛铁矿与硫酸发生非氧化还原反应,生成TiOSO4,试写出该反应的化学方程式
(4)⑥中镁与TiCl4高温下反应制备粗钛时需加保护气,下列可作为保护气的是
a.H2 b.Ar c.Cl2 d.N2
(5)⑦中经过“一系列操作”可获得副产品绿矾(
 ),其过程包括
),其过程包括(6)绿矾易被氧化而变质。现取在空气中放置一段时间的某绿矾样品,请选择合适的试剂,设计实验方案,证明该样品被部分氧化:
您最近一年使用:0次
7 . FeCl3是重要的化工产品,某小组设计如图实验装置制备氯化铁并探究其性质。
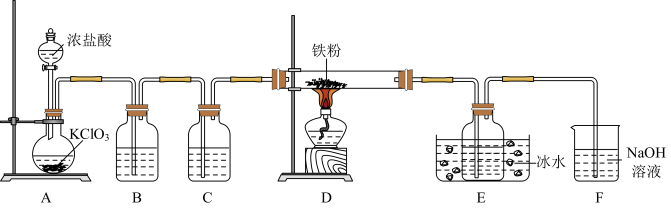
已知:FeCl3易升华、遇水蒸气易潮解。
(1)A中反应的化学方程式为______ ,该反应中,浓盐酸表现的性质是______ 。
(2)B中的试剂是______ ;C的作用是______ 。
(3)E装置中冰水浴的作用是______ 。
(4)上述实验装置存在两处缺陷:一是D与E间的导气管太细,易堵塞:二是______ 。
(5)经改进,继续完成实验。实验完毕后,取产品探究其性质:
根据上述实验现象,______ (填“能”或“不能”)确定产品中是否含有铁单质,理由是_______ (用文字描述)。

已知:FeCl3易升华、遇水蒸气易潮解。
(1)A中反应的化学方程式为
(2)B中的试剂是
(3)E装置中冰水浴的作用是
(4)上述实验装置存在两处缺陷:一是D与E间的导气管太细,易堵塞:二是
(5)经改进,继续完成实验。实验完毕后,取产品探究其性质:
| 实验 | 操作 | 现象 |
| ① | 取少量固体溶于蒸馏水,滴加KSCN溶液 | 溶液变红色 |
| ② | 取少量固体溶于稀硫酸 | 固体溶解,无气泡产生 |
您最近一年使用:0次
8 . 实验小组发现新配制的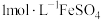 溶液放置一段时间,由浅绿色溶液变为黄色浊液A,进行如下探究。
溶液放置一段时间,由浅绿色溶液变为黄色浊液A,进行如下探究。
资料:i.胶体可以透过滤纸。 ii. 与
与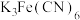 溶液反应,生成蓝色沉淀。
溶液反应,生成蓝色沉淀。
(1)探究A中的成分,进行如下实验。
①取少量A,过滤得到红褐色沉淀和黄色透明液体B。
②取少量B于试管中,加入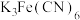 溶液,
溶液,_______ (填现象)。
③取少量B于试管中,加入_______ (填试剂),液体变为红色。
④用激光笔照射B,看到一条光亮的“通路”。
综合上述实验,说明A中铁元素的存在形态有 、
、 、
、_______ 和_______ 。
(2)进一步探究B显黄色的原因。_______ (用离子方程式表示)。
②由上述实验得出:B显黄色的主要原因不是因为含有 ,而是因为含有
,而是因为含有_______ 。理由是: _______ 。
(3)测定A的变质程度并分析对后续实验的影响。
①取25.00mL A,加入足量稀硫酸,可与24.00mL 溶液恰好完全反应。已知
溶液恰好完全反应。已知 在酸性环境下被还原为
在酸性环境下被还原为 ,A中
,A中 的浓度为
的浓度为_______  ,说明其主要成分仍然是
,说明其主要成分仍然是 。
。
②下列实验可以使用A进行的是_______ (填字母)。
a.向A中滴入NaOH溶液,制备纯净的 沉淀
沉淀
b.用A处理含有+6价Cr的酸性废水,将剧毒的+6价Cr还原至低毒的+3价
经过上述探究,实验小组对 溶液的配制与使用有了更深入的理解。
溶液的配制与使用有了更深入的理解。
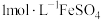 溶液放置一段时间,由浅绿色溶液变为黄色浊液A,进行如下探究。
溶液放置一段时间,由浅绿色溶液变为黄色浊液A,进行如下探究。资料:i.胶体可以透过滤纸。 ii.
 与
与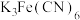 溶液反应,生成蓝色沉淀。
溶液反应,生成蓝色沉淀。(1)探究A中的成分,进行如下实验。
①取少量A,过滤得到红褐色沉淀和黄色透明液体B。
②取少量B于试管中,加入
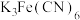 溶液,
溶液,③取少量B于试管中,加入
④用激光笔照射B,看到一条光亮的“通路”。
综合上述实验,说明A中铁元素的存在形态有
 、
、 、
、(2)进一步探究B显黄色的原因。

②由上述实验得出:B显黄色的主要原因不是因为含有
 ,而是因为含有
,而是因为含有(3)测定A的变质程度并分析对后续实验的影响。
①取25.00mL A,加入足量稀硫酸,可与24.00mL
 溶液恰好完全反应。已知
溶液恰好完全反应。已知 在酸性环境下被还原为
在酸性环境下被还原为 ,A中
,A中 的浓度为
的浓度为 ,说明其主要成分仍然是
,说明其主要成分仍然是 。
。②下列实验可以使用A进行的是
a.向A中滴入NaOH溶液,制备纯净的
 沉淀
沉淀b.用A处理含有+6价Cr的酸性废水,将剧毒的+6价Cr还原至低毒的+3价
经过上述探究,实验小组对
 溶液的配制与使用有了更深入的理解。
溶液的配制与使用有了更深入的理解。
您最近一年使用:0次
2023-01-07更新
|
363次组卷
|
3卷引用:广西柳州高级中学2023-2024学年高一上学期寒假月考化学试题(二)
名校
解题方法
9 . 某工厂的酸性废水中主要含有 、
、 等离子,为了减少污染并变废为宝,工程师设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。
等离子,为了减少污染并变废为宝,工程师设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

(1)酸性废水中加入铁粉后,发生反应的离子方程式是: 、
、_____ 、______ 。
(2)操作1是_______ 。
(3)试剂甲是_______ 。
(4)检验溶液B中 是否除尽的实验方法是
是否除尽的实验方法是_______ 。
(5)获得的 需密闭保存,原因是
需密闭保存,原因是______ 。
(6)绿矾可消除某种酸性工业废水中 价铬(
价铬( )的污染,使之转化为毒性较小的
)的污染,使之转化为毒性较小的 ,该反应的离子方程式是
,该反应的离子方程式是_____ 。
 、
、 等离子,为了减少污染并变废为宝,工程师设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。
等离子,为了减少污染并变废为宝,工程师设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。
(1)酸性废水中加入铁粉后,发生反应的离子方程式是:
 、
、(2)操作1是
(3)试剂甲是
(4)检验溶液B中
 是否除尽的实验方法是
是否除尽的实验方法是(5)获得的
 需密闭保存,原因是
需密闭保存,原因是(6)绿矾可消除某种酸性工业废水中
 价铬(
价铬( )的污染,使之转化为毒性较小的
)的污染,使之转化为毒性较小的 ,该反应的离子方程式是
,该反应的离子方程式是
您最近一年使用:0次
2021-01-27更新
|
483次组卷
|
3卷引用:广西南宁市第十四中学2022-2023学年高一下学期6月月考化学试题



