名校
1 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:
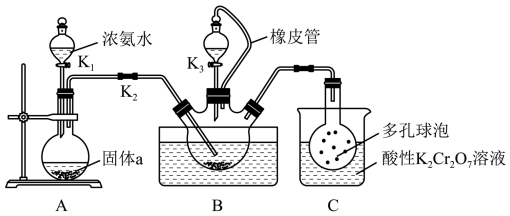
已知: 是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
Ⅰ.制备 溶液
溶液
(1)装置A用于制备 ,圆底烧瓶内的固体a是
,圆底烧瓶内的固体a是_______ (填名称)。
(2)三颈烧瓶内盛放有 、水和固体催化剂,发生反应
、水和固体催化剂,发生反应 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入 中,其目的是使反应更充分且
中,其目的是使反应更充分且_______ 。
(3)一段时间后,当观察到三颈烧瓶内_______ 时,停止通入气体,反应完成。
Ⅱ.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待 完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为_______ ;酸性 溶液除可以吸收
溶液除可以吸收 外,还能吸收的气体是
外,还能吸收的气体是_______ 。
Ⅲ.制备KSCN晶体
先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液。量取25.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000 mol/L 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液20.00 mL。
标准溶液20.00 mL。
①滴定时发生的反应: (白色),则指示剂的化学式为
(白色),则指示剂的化学式为_______ (填序号)。则滴定终点的现象是_______ 。
A. B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为_______ (计算结果保留三位有效数字)。

已知:
 是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:Ⅰ.制备
 溶液
溶液(1)装置A用于制备
 ,圆底烧瓶内的固体a是
,圆底烧瓶内的固体a是(2)三颈烧瓶内盛放有
 、水和固体催化剂,发生反应
、水和固体催化剂,发生反应 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入 中,其目的是使反应更充分且
中,其目的是使反应更充分且(3)一段时间后,当观察到三颈烧瓶内
Ⅱ.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待
 完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为 溶液除可以吸收
溶液除可以吸收 外,还能吸收的气体是
外,还能吸收的气体是Ⅲ.制备KSCN晶体
先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液。量取25.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000 mol/L
 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液20.00 mL。
标准溶液20.00 mL。①滴定时发生的反应:
 (白色),则指示剂的化学式为
(白色),则指示剂的化学式为A.
 B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为
您最近一年使用:0次
2022-12-31更新
|
473次组卷
|
5卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题
黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(实验探究题)福建省三明市2022-2023学年高三上学期期末考试化学试题江苏省盐城市北京师范大学盐城附属学校2023届高三上学期期末考试化学试题
名校
解题方法
2 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:

已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
I.制备NH4SCN溶液
(1)装置A用于制备NH3,圆底烧瓶内的固体a是_______ (填名称)。
(2)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应CS2+3NH3 NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是
NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是_______ 。
(3)一段时间后,当观察到三颈烧瓶内_______ 时,停止通入气体,反应完成。
II.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液,发生反应的化学方程式为_______ ;酸性K2Cr2O7溶液除可以吸收NH3外,还能将H2S气体氧化成硫酸,其离子方程式为_______ 。
III.制备KSCN晶体
(5)先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体,该提取过程中一定不用的仪器有_______ (填序号)。
①坩埚②蒸发皿③分液漏斗④玻璃棒⑤烧杯
(6)测定晶体中KSCN的含量:称取5.0g样品,配成500mL溶液;量取25.00mL溶液加入锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液21.00mL。
①滴定时发生的反应:SCN—+Ag+=AgSCN↓(白色),则指示剂的化学式为_______ (填序号)。
A.FeCl3 B.Fe(SCN)3 C.Fe(NO3)3
②晶体中KSCN的质量分数为_______ (计算结果保留三位有效数字)。

已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
I.制备NH4SCN溶液
(1)装置A用于制备NH3,圆底烧瓶内的固体a是
(2)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应CS2+3NH3
 NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是
NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是(3)一段时间后,当观察到三颈烧瓶内
II.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液,发生反应的化学方程式为
III.制备KSCN晶体
(5)先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体,该提取过程中一定不用的仪器有
①坩埚②蒸发皿③分液漏斗④玻璃棒⑤烧杯
(6)测定晶体中KSCN的含量:称取5.0g样品,配成500mL溶液;量取25.00mL溶液加入锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液21.00mL。
①滴定时发生的反应:SCN—+Ag+=AgSCN↓(白色),则指示剂的化学式为
A.FeCl3 B.Fe(SCN)3 C.Fe(NO3)3
②晶体中KSCN的质量分数为
您最近一年使用:0次
3 . 回答下列问题
(1)图为实验室某浓盐酸试剂瓶标签上的有关数据,根据数据计算该浓盐酸中HCl的物质的量浓度为___________ 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸,需量取___________ mL上述浓盐酸,最终确定所配溶液体积的容器是___________ (填名称)。
Ⅱ、已知有以下物质相互转化
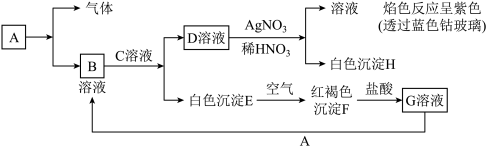
试回答:
(4)写出B的化学式______________ ,怎样检验B溶液中的阳离子__________ (合理答案均给分),D的化学式________ 。
(5)写出由E转变成F的化学方程式____________________ 。
(6)写出用KSCN鉴别G溶液的离子方程式________________ ;向G溶液加入A的有关化学反应方程式_________________ 。
(7)写出F受热分解的化学方程式________________ 。
(1)图为实验室某浓盐酸试剂瓶标签上的有关数据,根据数据计算该浓盐酸中HCl的物质的量浓度为
盐酸 分子式: HCl 相对分子质量: 36.5 密度: 1.19g/mL HCl的质量分数: 36.5%| |
| A.溶液中HCl的物质的量 | B.溶液的浓度 | C.溶液中Cl-的数目 | D.溶液的密度 |
Ⅱ、已知有以下物质相互转化

试回答:
(4)写出B的化学式
(5)写出由E转变成F的化学方程式
(6)写出用KSCN鉴别G溶液的离子方程式
(7)写出F受热分解的化学方程式
您最近一年使用:0次
名校
解题方法
4 . 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,M为红褐色。
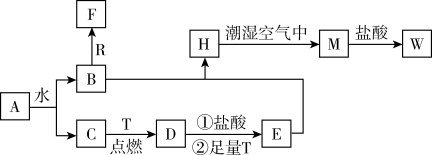
请回答下列问题:
(1)A的电子式是_____ ,R元素在元素周期表中位置为______ ,D的俗称是_____ 。
(2)A与水反应的离子方程式为______ 。
(3)检验W溶液中金属阳离子的操作方法是_______ 。
(4)H转化为M的化学方程式为_______ 。
(5)B生成F的反应中氧化剂是_____ ,反应的离子方程式为______ 。

请回答下列问题:
(1)A的电子式是
(2)A与水反应的离子方程式为
(3)检验W溶液中金属阳离子的操作方法是
(4)H转化为M的化学方程式为
(5)B生成F的反应中氧化剂是
您最近一年使用:0次
2022-01-05更新
|
582次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
5 . 实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】
I.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
II.KSCN中的硫元素为-2价。
III.Fe(OH)3受热分解生成Fe2O3。
实验I.检验该补铁剂中铁元素的价态。
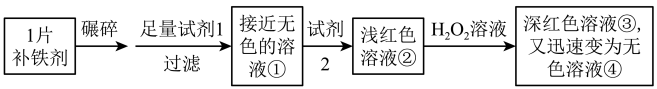
(1)试剂2是_______ 。
(2)能证明溶液①中含有Fe2+的实验现象是_______ 。
(3)①补全在上述条件下Fe2+与 H2O2发生反应的离子方程式_______ 。
_______H+ + _______Fe2+ + _______H2O2 =_______+_______
②甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。甲同学猜测的理论依据是_______ 。
【查阅资料】
I.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
II.KSCN中的硫元素为-2价。
III.Fe(OH)3受热分解生成Fe2O3。
实验I.检验该补铁剂中铁元素的价态。

(1)试剂2是
(2)能证明溶液①中含有Fe2+的实验现象是
(3)①补全在上述条件下Fe2+与 H2O2发生反应的离子方程式
_______H+ + _______Fe2+ + _______H2O2 =_______+_______
②甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。甲同学猜测的理论依据是
您最近一年使用:0次
名校
6 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
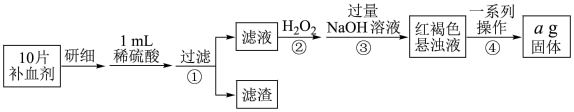
请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有___________ (填离子符号),检验滤液中还存在Fe2+的方法为___________ (说明试剂、现象)。
(2)步骤②加入过量H2O2的目的是___________ 。涉及的反应离子方程式:___________ 。
(3)步骤③中反应的离子方程式为___________ 。
(4)步骤④中一系列处理的操作步骤包括:过滤、______ 、干燥、灼烧、_______ 、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为___________ g。
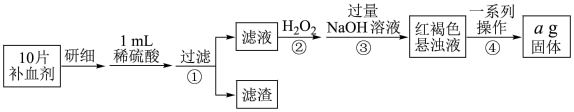
请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有
(2)步骤②加入过量H2O2的目的是
(3)步骤③中反应的离子方程式为
(4)步骤④中一系列处理的操作步骤包括:过滤、
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
您最近一年使用:0次



