名校
解题方法
1 . 某研究小组欲探究 能否与
能否与 溶液反应。
溶液反应。
【查阅资料】
i. 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。
ii. 遇
遇 可生成
可生成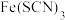 ,
,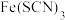 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。
【提出猜想】
(1)小组同学经过讨论后,认为 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:___________ 。
【设计实验】
(2)实验I:在试管中加入 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液_____ ,小组同学认为 和
和 溶液反应生成了
溶液反应生成了 。
。
(3)甲同学注意到盛放 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是______ 。
重新设计实验:
实验II:在试管中加入 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。
【获得结论】
(4)过氧化氢___________ (填“能”或者“不能”)氧化 。
。
【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。
(5)补全实验III的方案:在试管中加入 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入___________ ,产生___________ 。
【总结反思】
(6)小组同学经过讨论后,提出了 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中,___________ ,证明待测液含有 。
。
(7)从上述实验中可以得出结论,在物质性质的检验中,应注意___________ (至少写出两条)对实验结果的影响。
 能否与
能否与 溶液反应。
溶液反应。【查阅资料】
i.
 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。ii.
 遇
遇 可生成
可生成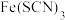 ,
,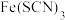 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。【提出猜想】
(1)小组同学经过讨论后,认为
 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:【设计实验】
(2)实验I:在试管中加入
 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液 和
和 溶液反应生成了
溶液反应生成了 。
。(3)甲同学注意到盛放
 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是重新设计实验:
实验II:在试管中加入
 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。【获得结论】
(4)过氧化氢
 。
。【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将
 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。(5)补全实验III的方案:在试管中加入
 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入【总结反思】
(6)小组同学经过讨论后,提出了
 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中, 。
。(7)从上述实验中可以得出结论,在物质性质的检验中,应注意
您最近一年使用:0次
2021-11-07更新
|
1003次组卷
|
4卷引用:第一节 铁及其化合物 第2课时 铁盐、亚铁盐
解题方法
2 . 下列关于补铁剂中铁元素的价态探究实验说法正确的是
| A.可在中性条件下,用KSCN溶液检验补铁剂是否含有Fe3+ |
| B.将补铁剂溶解在水中,加入KMnO4溶液,溶液褪色可证明补铁剂中含有Fe2+ |
| C.将补铁剂溶解在浓盐酸中并稀释至pH=5,加入邻二氮菲,溶液变为橙红色可证明补铁剂中含有Fe2+ |
| D.将补铁剂溶解在水中,加入K3[Fe(CN)6]生成蓝色沉淀,可证明补铁剂中含有Fe3+ |
您最近一年使用:0次
名校
解题方法
3 . 铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近一年使用:0次
4 . 资料显示:FeCl (亮黄色)只有在Cl-浓度较大的溶液中才能稳定存在,为了验证该事实,某实验小组取三份2mL黄色的工业盐酸分别做了一系列实验,记录如下:
(亮黄色)只有在Cl-浓度较大的溶液中才能稳定存在,为了验证该事实,某实验小组取三份2mL黄色的工业盐酸分别做了一系列实验,记录如下:
下列说法不正确的是
 (亮黄色)只有在Cl-浓度较大的溶液中才能稳定存在,为了验证该事实,某实验小组取三份2mL黄色的工业盐酸分别做了一系列实验,记录如下:
(亮黄色)只有在Cl-浓度较大的溶液中才能稳定存在,为了验证该事实,某实验小组取三份2mL黄色的工业盐酸分别做了一系列实验,记录如下:| 操作 | 现象 |
| 实验I:直接滴加2滴KSCN溶液 | 无明显变化 |
| 实验II:加10mL蒸馏水稀释,后滴入2滴浓KSCN溶液 | 稀释后溶液几乎变为无色,加KSCN溶液显红色 |
| 实验III:滴加2滴AgNO3饱和溶液 | 产生白色沉淀,溶液亮黄色消失 |
A.工业盐酸显黄色是因为其中混有FeCl |
| B.实验I中,未检测到Fe3+ |
| C.实验Ⅲ中,AgNO3溶液稀释了样品是溶液亮黄色消失的主要原因 |
D.通过上述实验,可以证明FeCl 只有在Cl-浓度较大的溶液中才能稳定存在 只有在Cl-浓度较大的溶液中才能稳定存在 |
您最近一年使用:0次
名校
解题方法
5 . 工业上由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备高纯碳酸锰。其主要工艺流程如下:

下列有关说法不正确 的是

下列有关说法
| A.可以通过搅拌的方式提高“酸浸”时粗锰粉的浸取率 |
B.向酸浸后的滤液中加入 ,反应的离子方程式为: ,反应的离子方程式为: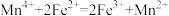 |
C.除铁时加入的物质X可以为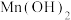 ,使 ,使 转化为 转化为 沉淀而除去 沉淀而除去 |
D.取除铁后的滤液,加入几滴KSCN溶液,无明显现象证明 已除尽 已除尽 |
您最近一年使用:0次
2022-01-23更新
|
216次组卷
|
3卷引用:江苏省盐城市2021-2022学年高二上学期期末考试化学试题
6 . 研究小组探究可逆反应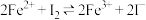 ,进行如图实验。
,进行如图实验。
已知: 为不溶于水的白色固体。
为不溶于水的白色固体。

下列说法中,不正确 的是。
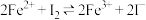 ,进行如图实验。
,进行如图实验。已知:
 为不溶于水的白色固体。
为不溶于水的白色固体。
下列说法中,
A.试管a中的现象说明滤液1中含有 |
| B.试管c中的红色可能比试管a中的深 |
C.试管a、b中的现象可以证明“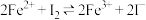 ”为可逆反应 ”为可逆反应 |
D.试管c中的现象说明,实验中 与 与 的反应速率更快,而与 的反应速率更快,而与 的反应限度更大 的反应限度更大 |
您最近一年使用:0次
2022-01-21更新
|
664次组卷
|
3卷引用:北京市丰台区2021~2022学年高二上学期期末考试化学试题
7 . 下列方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 证明 和 和 光照下发生取代反应 光照下发生取代反应 | 将装有干燥 的集气瓶倒扣在装有干燥 的集气瓶倒扣在装有干燥 的集气瓶上,抽出玻璃片,置于光照条件下反应 的集气瓶上,抽出玻璃片,置于光照条件下反应 | 观察到集气瓶内出现白雾,则可证明 和 和 光照下发生取代反应 光照下发生取代反应 |
| B | 检验 溶液中是否含有 溶液中是否含有 | 将 溶液滴入到酸性 溶液滴入到酸性 溶液中 溶液中 | 观察到 溶液由紫红色变无色,证明 溶液由紫红色变无色,证明 溶液中含有 溶液中含有 |
| C | 探究 、 、 、 、 的氧化性强弱 的氧化性强弱 | ①向NaBr溶液中通入足量 ②将①通入  后的溶液加入KI淀粉溶液中 后的溶液加入KI淀粉溶液中 | NaBr溶液变橙黄色,KI淀粉溶液变蓝色,证明氧化性 |
| D | 探究 、 、 对 对 分解的催化效果 分解的催化效果 | 在a、b两支试管中各加 溶液,分别滴入 溶液,分别滴入 溶液和 溶液和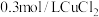 溶液各5滴 溶液各5滴 | a中产生气泡速率快于b中,说明 的催化效果要好于 的催化效果要好于 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-23更新
|
245次组卷
|
2卷引用:浙江省9+1高中联盟2022-2023学年高二上学期11月期中联考化学试题
8 . 下列单质或化合物性质的描述错误的是
| A.钠燃烧时发出黄色的火焰 |
| B.将废铁屑加入FeCl3溶液中,可用于除去工业废气中的Cl2 |
| C.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 |
| D.稀释浓硫酸时,将水沿器壁缓慢注入浓硫酸中并用玻璃棒不断搅拌 |
您最近一年使用:0次
2023-02-14更新
|
194次组卷
|
3卷引用:山东省聊城市2022-2023学年高一上学期期末考试化学试题
山东省聊城市2022-2023学年高一上学期期末考试化学试题山东省聊城市2022-2023学年高一上学期期末教学质量抽测化学试题(已下线)专项05 常见物质的性质、用途与转化-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
解题方法
9 . 化学在医学上起到至关重要的作用。如:小苏打、氢氧化铝等可治疗胃酸(主要成分为稀盐酸)过多;硫酸亚铁可补铁、防治贫血;三价铬用于加强胰岛素的作用。试回答下列问题:
(1)写出小苏打与胃酸作用的离子方程式:_______ ,但该药剂缺点是易导致胃胀气,胃溃疡患者不能使用,而氢氧化铝很好的解决了这个问题,它在中和胃酸的同时,保护溃疡面,写出氢氧化铝与胃酸作用的化学方程式为_______ 。
(2)利用提供试剂设计实验证明补铁剂中铁元素都以+2存在(可选试剂:硫氰化钾、过氧化氢):_______ (填写实验操作、现象和结论)。
(3)三价铬是人体必需的微量元素,六价铬则严重危害人体健康,铬元素化合价循环示意图如下【已知: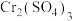 可溶于水;
可溶于水;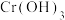 难溶于水】:
难溶于水】:
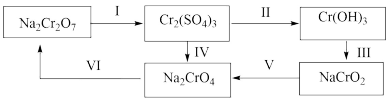
①步骤I所用的试剂是硫酸酸化的 ,请写出该反应的离子方程式;
,请写出该反应的离子方程式;_______
②现有含 和
和 的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是
的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是_______ 、_______ ;
③向50mL0.03mol/L的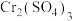 溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式_______ 。
(1)写出小苏打与胃酸作用的离子方程式:
(2)利用提供试剂设计实验证明补铁剂中铁元素都以+2存在(可选试剂:硫氰化钾、过氧化氢):
(3)三价铬是人体必需的微量元素,六价铬则严重危害人体健康,铬元素化合价循环示意图如下【已知:
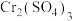 可溶于水;
可溶于水;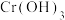 难溶于水】:
难溶于水】:
①步骤I所用的试剂是硫酸酸化的
 ,请写出该反应的离子方程式;
,请写出该反应的离子方程式;②现有含
 和
和 的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是
的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是③向50mL0.03mol/L的
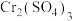 溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
您最近一年使用:0次
2023-01-12更新
|
424次组卷
|
2卷引用:重庆市南开中学2022-2023学年高一上期期末考试化学试题
名校
10 . 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。小组同学利用化学实验进行菠菜中铁元素的检验和铁元素含量测定。
实验1.菠菜中铁元素的检验

(1)操作1的名称是_______ 。
(2)溶液②为浅红色,说明溶液①中含有_______ (填离子符号)。
(3)溶液③中_______ (填实验现象),证明溶液②中还含有 ,其推理过程是
,其推理过程是_______ 。
实验2.测定菠菜中铁元素的含量
i.沉淀法:向实验1滤液①中加入足量NaOH溶液,过滤、洗涤沉淀、加热烘干、称量。
(4)滤液①中加入足量NaOH溶液后生成的沉淀有_______ 、_______ ;在沉淀生成或后续处理过程中,沉淀转化发生的氧化还原 反应为_______ 。
ii.比色法:利用色度传感器测定其对光的透过率或者吸收率,颜色越深,吸收率越高。
测得不同浓度 的标准液吸收率如下图。
的标准液吸收率如下图。

(5)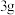 菠菜处理后得到溶液(3)
菠菜处理后得到溶液(3) ,色度传感器测得吸收率为上图中a点,则
,色度传感器测得吸收率为上图中a点,则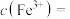
_______  ,
,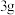 菠菜中含铁
菠菜中含铁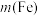 =
=_______ g。
实验1.菠菜中铁元素的检验

(1)操作1的名称是
(2)溶液②为浅红色,说明溶液①中含有
(3)溶液③中
 ,其推理过程是
,其推理过程是实验2.测定菠菜中铁元素的含量
i.沉淀法:向实验1滤液①中加入足量NaOH溶液,过滤、洗涤沉淀、加热烘干、称量。
(4)滤液①中加入足量NaOH溶液后生成的沉淀有
ii.比色法:利用色度传感器测定其对光的透过率或者吸收率,颜色越深,吸收率越高。
测得不同浓度
 的标准液吸收率如下图。
的标准液吸收率如下图。
(5)
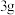 菠菜处理后得到溶液(3)
菠菜处理后得到溶液(3) ,色度传感器测得吸收率为上图中a点,则
,色度传感器测得吸收率为上图中a点,则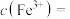
 ,
,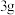 菠菜中含铁
菠菜中含铁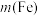 =
=
您最近一年使用:0次
2023-01-05更新
|
244次组卷
|
2卷引用:北京市大兴区2022-2023学年高一上学期期末考试化学试题



