名校
解题方法
1 . 下列离子方程式书写正确的是
| A.向氧化亚铁中加入稀盐酸:FeO+2H+ = Fe3++H2O |
| B.向FeI2溶液中通入足量的Cl2:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 |
C.AlCl3溶液中滴加过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH |
D.向NaHCO3溶液中滴入少量澄清石灰水:HCO +Ca2++OH-=CaCO3↓+H2O +Ca2++OH-=CaCO3↓+H2O |
您最近一年使用:0次
2022-12-30更新
|
945次组卷
|
5卷引用:广东实验中学2022-2023学年高一上学期期末考试化学试题
2 . 某磁铁矿石A的主要成分是磁性氧化铁( ),还含少量的
),还含少量的 、
、 。某工厂利用此矿石进行有关物质的回收利用,工艺流程如下:(已知
。某工厂利用此矿石进行有关物质的回收利用,工艺流程如下:(已知 不溶于水和碱,但溶于酸:
不溶于水和碱,但溶于酸: )。根据流程回答下列问题:
)。根据流程回答下列问题:

(1)溶液C的主要成分是___________ 。
(2)溶液D中的金属阳离子与过量试剂X反应的离子方程式是___________ 。
(3)在溶液F中滴加 溶液的现象是
溶液的现象是___________ ;发生的化学反应方程式为___________ 。
(4)聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分 ,含少量碳及二氧化硅)为原料制备的流程如图:
,含少量碳及二氧化硅)为原料制备的流程如图:

①加热条件下酸浸时, 与硫酸反应。酸浸时,通入
与硫酸反应。酸浸时,通入 的目的是
的目的是___________ 。
②“ 浓度检测”是先将100mL含
浓度检测”是先将100mL含 溶液用适量的
溶液用适量的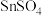 还原为
还原为 ;再用酸性
;再用酸性 标准溶液测定
标准溶液测定 的量(
的量( 被还原为
被还原为 ),此时发生反应的离子方程式为:
),此时发生反应的离子方程式为:___________ 。若用掉
 溶液50mL,则
溶液50mL,则 的物质的量浓度为
的物质的量浓度为___________ 。
 ),还含少量的
),还含少量的 、
、 。某工厂利用此矿石进行有关物质的回收利用,工艺流程如下:(已知
。某工厂利用此矿石进行有关物质的回收利用,工艺流程如下:(已知 不溶于水和碱,但溶于酸:
不溶于水和碱,但溶于酸: )。根据流程回答下列问题:
)。根据流程回答下列问题:
(1)溶液C的主要成分是
(2)溶液D中的金属阳离子与过量试剂X反应的离子方程式是
(3)在溶液F中滴加
 溶液的现象是
溶液的现象是(4)聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分
 ,含少量碳及二氧化硅)为原料制备的流程如图:
,含少量碳及二氧化硅)为原料制备的流程如图:
①加热条件下酸浸时,
 与硫酸反应。酸浸时,通入
与硫酸反应。酸浸时,通入 的目的是
的目的是②“
 浓度检测”是先将100mL含
浓度检测”是先将100mL含 溶液用适量的
溶液用适量的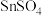 还原为
还原为 ;再用酸性
;再用酸性 标准溶液测定
标准溶液测定 的量(
的量( 被还原为
被还原为 ),此时发生反应的离子方程式为:
),此时发生反应的离子方程式为:
 溶液50mL,则
溶液50mL,则 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
2022-01-26更新
|
1128次组卷
|
4卷引用:广东省广州市三校2021-202学年高一上学期期末联考化学试题
20-21高三上·广东·阶段练习
3 . NiSO4·6H2O广泛应用于镀镍电镀液、催化剂和金属着色剂。某科研小组用富含镍(NiS)的工业废渣(含SiO2、FeO、Al2O3等杂质)制备NiSO4·6H2O,设计流程图如下:

已知:Ksp[Ni(OH)2]=1.0×10-15,Ksp[Fe(OH)2]=1.0×10-16,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=1.0×10-39。
根据要求回答下列问题:
(1)酸浸过程中,1 mol NiS失去8NA个电子,同时生成一种无色有毒气体,写出该反应的化学方程式:_______ 。
(2)“氧化”保持滤液温度在40 ℃左右,加入6%的H2O2溶液,加入H2O2溶液的目的是_______ ,若上述流程省去“氧化”步骤,后果是_______ 。
(3)常温下,调节pH除去铁和铝元素,若溶液中c(Ni2+)=0.1 mol·L−1,溶液的pH范围应调节为4.3~_______ 之间。
(4)小火煮沸的作用是使沉淀颗粒长大,这样做有利于_______ 。
(5)沉镍后,加入硫酸发生反应的离子方程式为_______ 。
(6)为得到NiSO4·6H2O,操作X为_______ 。

已知:Ksp[Ni(OH)2]=1.0×10-15,Ksp[Fe(OH)2]=1.0×10-16,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=1.0×10-39。
根据要求回答下列问题:
(1)酸浸过程中,1 mol NiS失去8NA个电子,同时生成一种无色有毒气体,写出该反应的化学方程式:
(2)“氧化”保持滤液温度在40 ℃左右,加入6%的H2O2溶液,加入H2O2溶液的目的是
(3)常温下,调节pH除去铁和铝元素,若溶液中c(Ni2+)=0.1 mol·L−1,溶液的pH范围应调节为4.3~
(4)小火煮沸的作用是使沉淀颗粒长大,这样做有利于
(5)沉镍后,加入硫酸发生反应的离子方程式为
(6)为得到NiSO4·6H2O,操作X为
您最近一年使用:0次
解题方法
4 . 某化学小组对卤素及其化合物的制备和性质进行如下探究实验,根据实验回答问题。
I.探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应:12FeCl2+3O2 2Fe2O3+8FeCl3,4FeCl2+3O2
2Fe2O3+8FeCl3,4FeCl2+3O2 2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
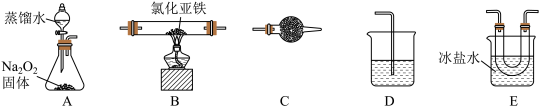
(1)实验装置的合理连接顺序为:A→__________ →D,装置E的作用是___________ 。
(2)D中发生反应的离子方程式_______ 。
(3)某化学兴趣小组在控制在500℃下发生反应,一段时间后的产物进行了如下实验探究:
①对B中反应剩余固体的成分开展实验探究,并作出以下两种假设:
假设一:产物为Fe2O3;
假设二:产物为________ (填化学式)。
以下针对上述假设一,展开实验研究,请完善下面表格:
②对固体产物(标准状况下)成分含量进行了如下实验探究:B中反应剩余固体的质量经测定为m1g ,E中生成物的质量经测定为m2g。B中反应剩余固体按探究①的实验步骤进行操作,并最终得到干燥纯净的固体质量为m3g。则固体产物中Fe2O3所占的质量分数为______ 。
Ⅱ.卤素化合物之间反应实验条件控制探究
(4)室温下,KClO3可将KI氧化为I2或KIO3。下面是该小组设计的一组实验数据记录表:
①根据实验数据,结合所学化学知识,下列说法正确的是______
A.该实验目的是探究其它条件相同时,酸的浓度对反应产物的影响
B.实验1和实验4说明硫酸浓度太低或太浓,KClO3与KI均不反应
C.实验2的现象说明在该硫酸浓度下KClO3将KI氧化为I2
D.实验3蓝色较2浅的原因是在该硫酸浓度下淀粉部分水解
②2号试管反应完全后,假设还原产物只有KC1,写出反应的离子方程式___________ 。
I.探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应:12FeCl2+3O2
 2Fe2O3+8FeCl3,4FeCl2+3O2
2Fe2O3+8FeCl3,4FeCl2+3O2 2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
(1)实验装置的合理连接顺序为:A→
(2)D中发生反应的离子方程式
(3)某化学兴趣小组在控制在500℃下发生反应,一段时间后的产物进行了如下实验探究:
①对B中反应剩余固体的成分开展实验探究,并作出以下两种假设:
假设一:产物为Fe2O3;
假设二:产物为
以下针对上述假设一,展开实验研究,请完善下面表格:
| 实验操作 | 预期现象与结论 |
| 取少量固体样品于一支洁净的试管中,加入足量的蒸馏水。 |
Ⅱ.卤素化合物之间反应实验条件控制探究
(4)室温下,KClO3可将KI氧化为I2或KIO3。下面是该小组设计的一组实验数据记录表:
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20 mol·L-1KI溶液/ mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0 mol·L-1H2SO4溶液/ mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 反应完全后,滴加2滴淀粉溶液 | 无色 | 蓝色 | 蓝色较2浅 | 无色 |
A.该实验目的是探究其它条件相同时,酸的浓度对反应产物的影响
B.实验1和实验4说明硫酸浓度太低或太浓,KClO3与KI均不反应
C.实验2的现象说明在该硫酸浓度下KClO3将KI氧化为I2
D.实验3蓝色较2浅的原因是在该硫酸浓度下淀粉部分水解
②2号试管反应完全后,假设还原产物只有KC1,写出反应的离子方程式
您最近一年使用:0次



