名校
解题方法
1 . 部分氧化的 合金样品(氧化产物为
合金样品(氧化产物为 、
、 )共
)共 ,经如图处理:
,经如图处理:
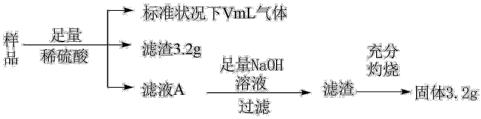
下列说法正确的是
 合金样品(氧化产物为
合金样品(氧化产物为 、
、 )共
)共 ,经如图处理:
,经如图处理: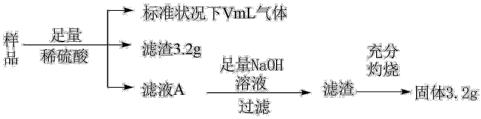
下列说法正确的是
A.滤液A中的阳离子为 | B.样品中 的质量为 的质量为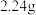 |
C.参与反应的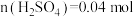 | D.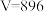 |
您最近一年使用:0次
名校
解题方法
2 . 重铬酸钾(K2Cr2O7)在皮革、火柴、印染化学、电镀等方面应用广泛。回答下列问题:
(1)酒驾严重危害社会安全,早期用重铬酸钾测定是否饮酒。橙红色的重铬酸钾具有强氧化性,遇到有机物如乙醇会激烈反应,本身被还原成绿色的Cr3+,乙醇被氧化成乙酸。请写出用酸性重铬酸钾检验酒驾的离子方程式______ 。
(2)用铬铁矿(FeO·Cr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺流程如下:
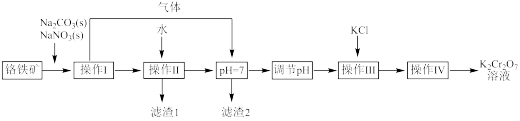
已知:
i.上述工艺流程图中的操作I的主要反应为:
2FeO·Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
ⅱ.有关物质的溶解度曲线如图:

①写出生成滤渣2的离子方程式______ 。
②工艺流程图中,操作“调节pH”的作用是______ 。
③操作Ⅲ,在Na2Cr2O7溶液中加入固体KCl进行复分解反应即可制得橙色的K2Cr2O7,请分析此反应能发生的原因______ ;实验室中,操作IV用到的玻璃仪器有酒精灯、烧杯、______ 。
(1)酒驾严重危害社会安全,早期用重铬酸钾测定是否饮酒。橙红色的重铬酸钾具有强氧化性,遇到有机物如乙醇会激烈反应,本身被还原成绿色的Cr3+,乙醇被氧化成乙酸。请写出用酸性重铬酸钾检验酒驾的离子方程式
(2)用铬铁矿(FeO·Cr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺流程如下:

已知:
i.上述工艺流程图中的操作I的主要反应为:
2FeO·Cr2O3+4Na2CO3+7NaNO3
 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2Al2O3+Na2CO3
 2NaAlO2+CO2↑
2NaAlO2+CO2↑ⅱ.有关物质的溶解度曲线如图:

①写出生成滤渣2的离子方程式
②工艺流程图中,操作“调节pH”的作用是
③操作Ⅲ,在Na2Cr2O7溶液中加入固体KCl进行复分解反应即可制得橙色的K2Cr2O7,请分析此反应能发生的原因
您最近一年使用:0次
名校
解题方法
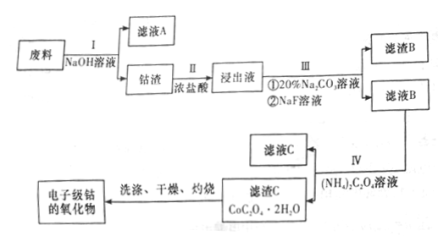
3 . 电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。现从废料(含Co3O4、Al、Si、Li2O、Fe2O3等物质)中提纯电子级钴的氧化物,其工业制取流程如下:
已知:
①物质的溶解性:LiF难溶于水,Li2CO3微溶于水;②钴元素常见的化合价为+ 2和+ 3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
(1)废料在处理前要粉碎,其主要目的是(回答两个方面)___________ ;
步骤I得到的滤液A中的溶质为___________ (填化学式)。
(2)步骤II中有黄绿色气体生成,有关含钴化合物发生反应的离子方程式为_________ 。
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为___________ ;滤渣B的主要成分为____________ 。
(4)步骤I、III、IV中均用到的分离提纯方法为_______ ,在实验室中完成该操作用到的玻璃仪器是__ 。
(5)5.49gCoC2O4·2H2O(其相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,其热重分析如下表。
290℃~320℃时若生成两种气体,则发生反应的化学方程式为___________ ,400℃~500℃所得固体的化学式为__________ 。
已知:
①物质的溶解性:LiF难溶于水,Li2CO3微溶于水;②钴元素常见的化合价为+ 2和+ 3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
步骤I得到的滤液A中的溶质为
(2)步骤II中有黄绿色气体生成,有关含钴化合物发生反应的离子方程式为
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为
(4)步骤I、III、IV中均用到的分离提纯方法为
(5)5.49gCoC2O4·2H2O(其相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,其热重分析如下表。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.25 |
| 400~500 | 2.41 |
您最近一年使用:0次
11-12高二上·广西南宁·期中
解题方法
4 . 粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.2 L 6.0 mol· 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,有气体放出,同时生成溶液D,还残留有固体物质B。请回答:
(1)①产物中的单质B是__________________ 。
(2)②中所发生的各反应的化学方程式是__________ 、_______ 。
(3)③中所发生的各反应的离子方程式是___________ 、________ 。
(4)若溶液D的体积仍视为0.2L,则该溶液中c(Mg2+)为_____________ ,c(Fe2+)为___________ 。
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.2 L 6.0 mol·
 盐酸中,得溶液C;
盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,有气体放出,同时生成溶液D,还残留有固体物质B。请回答:
(1)①产物中的单质B是
(2)②中所发生的各反应的化学方程式是
(3)③中所发生的各反应的离子方程式是
(4)若溶液D的体积仍视为0.2L,则该溶液中c(Mg2+)为
您最近一年使用:0次



