1 . 某固体粉末X可能含有 、
、 、
、 、Fe、
、Fe、 中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
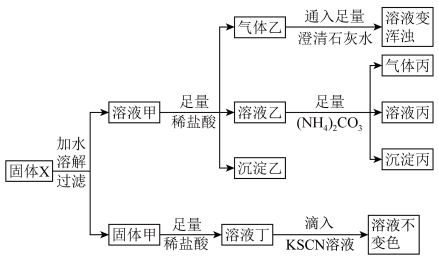
已知:① ;
;
② 。
。
(1)溶液甲中的溶质是_______ (填化学式),产生气体乙的离子方程式为_______ 。
(2)若向澄清石灰水中通入过量的气体乙,发生反应的化学方程式是_______ 。
(3)溶液乙中含有的阳离子除 还有
还有_______ (填离子符号)。
(4)分离溶液丙和沉淀丙需用到的玻璃仪器为_______ 。
(5)某同学根据实验现象猜测固体甲含铁元素的成分错误的是_______ (填标号),理由是_______ 。
①只有Fe ②只有 ③Fe,
③Fe,
 、
、 、
、 、Fe、
、Fe、 中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
已知:①
 ;
;②
 。
。(1)溶液甲中的溶质是
(2)若向澄清石灰水中通入过量的气体乙,发生反应的化学方程式是
(3)溶液乙中含有的阳离子除
 还有
还有(4)分离溶液丙和沉淀丙需用到的玻璃仪器为
(5)某同学根据实验现象猜测固体甲含铁元素的成分错误的是
①只有Fe ②只有
 ③Fe,
③Fe,
您最近一年使用:0次
2023-02-15更新
|
295次组卷
|
3卷引用:河北省邢台市2022-2023学年高一上学期教学质量检测化学试题
名校
解题方法
2 . 下列离子方程式正确的是
A. 的 的 溶液和 溶液和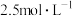 的 的 溶液等体积均匀混合: 溶液等体积均匀混合: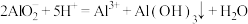 |
B.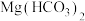 溶液与足量的 溶液与足量的 溶液反应: 溶液反应: |
C.向次氯酸钙溶液中通入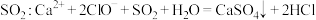 |
D. 溶于 溶于 溶液: 溶液: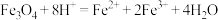 |
您最近一年使用:0次
2023-01-22更新
|
1083次组卷
|
3卷引用:吉林省长春市东北师大附属中学2022-2023学年高一上学期期末考试化学试题
吉林省长春市东北师大附属中学2022-2023学年高一上学期期末考试化学试题吉林省东北师范大学附属中学2022-2023学年高一上学期1月期末考试化学试题(已下线)专题02 离子反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
解题方法
3 . 以石灰石矿(主要成分为 ,含少量
,含少量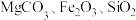 等)为原料制备高纯轻质碳酸钙的一种工艺流程如下。
等)为原料制备高纯轻质碳酸钙的一种工艺流程如下。

已知:固体B中含有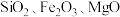 及
及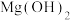
下列说法不正确 的是
 ,含少量
,含少量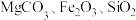 等)为原料制备高纯轻质碳酸钙的一种工艺流程如下。
等)为原料制备高纯轻质碳酸钙的一种工艺流程如下。
已知:固体B中含有
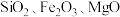 及
及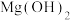
下列说法
A.过程Ⅱ中, 溶液浸出 溶液浸出 而非 而非 是因为 是因为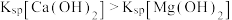 |
B.过程Ⅲ中,反应的离子方程式为 |
| C.过程Ⅱ和过程Ⅲ的操作均应在较高温度下进行 |
D.整个流程中,“变废为宝、循环利用”的物质是 |
您最近一年使用:0次
2023-01-06更新
|
436次组卷
|
4卷引用:北京市朝阳区2022-2023学年高二上学期期末考试化学试题
北京市朝阳区2022-2023学年高二上学期期末考试化学试题北京市第一0一中学2022-2023学年高二下学期3月统练化学试题(已下线)第15讲 沉淀溶解平衡-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)北京市清华大学附属中学2023-2024学年高二上学期第三单元化学统练
名校
4 . 某实验小组测定铁的氧化物FexOy的化学式,已知该氧化物中铁元素只有+2和+3两种价态,实验步骤如图,下列说法正确的是
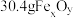

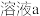
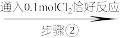
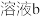
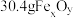

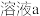
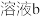
| A.步骤①和步骤②都发生了氧化还原反应 | B.溶液a中阳离子只有Fe3+和Fe2+ |
| C.溶液b中n(Fe3+):n(Cl-)=1:3 | D.通过计算可得该氧化物的化学式为:Fe4O5 |
您最近一年使用:0次
2022-03-03更新
|
635次组卷
|
3卷引用:河南省信阳市2021-2022学年高一上学期期末考试化学试题
河南省信阳市2021-2022学年高一上学期期末考试化学试题(已下线)第13讲 铁和铁的氧化物-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)江西省南昌市第二中学2023-2024学年高一上学期12月月考考试化学试题
5 . 确定Fe2O3和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别加入30.0 mL某浓度的稀硫酸中,充分反应后, 每组样品剩余固体的质量与原样品质量的关系如图所示。

(1)该混合物中,n(Fe2O3):n(Cu)=___________ 。
(2)稀硫酸的物质的量浓度为___________ 。

(1)该混合物中,n(Fe2O3):n(Cu)=
(2)稀硫酸的物质的量浓度为
您最近一年使用:0次
2021-05-29更新
|
962次组卷
|
5卷引用:考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题
(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题【省级联考】浙江省2020届普通高校招生选考科目化学模拟试题(六)(已下线)【浙江新东方】【2021.5.19】【SX】【高三下】【高中化学】【SX00147】浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题浙江省舟山市舟山中学2022-2023学年高一上学期12月质量检测化学试题
名校
解题方法
6 . 实验小组探究FeCl3溶液灼烧的变化。
已知:FeO是一种黑色粉末,不稳定,在空气中加热,可被氧化成Fe3O4,隔绝空气加热会歧化为Fe和Fe3O4。
Ⅰ.FeCl3溶液的灼烧。
实验ⅰ:将一只白粉笔浸泡在FeCl3溶液中,用坩埚钳夹持粉笔于酒精灯上灼烧,很快观察到粉笔表面颜色的变化:黄色→红褐色→铁锈色→黑色。

(1)配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度。结合化学用语解释将氯化铁晶体溶于盐酸的目的_______ 。
(2)“黄色→红褐色→铁锈色→黑色”颜色变化中的“铁锈色”物质是_______ 。(填化学式)
(3)针对“黑色”物质,小组成员提出猜想。
猜想1:酒精灼烧粉笔的产物;
猜想2:酒精还原“铁锈色”物质得到的产物。
通过实验排除了猜想①,实验操作和现象是_______ 。
Ⅱ.探究“黑色”物质的成分。
实验ⅱ:先用酒精蒸气排尽装置中的空气,再在“铁锈色”物质处加热,充分反应至“铁锈色”物质完全变成“黑色”物质。取下装有新制Cu(OH)2的试管,加热,有砖红色沉淀生成。
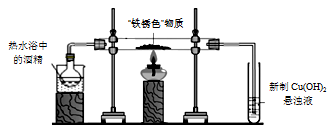
实验ⅲ:在“黑色”物质中加入热的硫酸,“黑色”物质溶解,无气泡产生。
(4)甲同学根据实验ⅱ和ⅲ的现象,判断“黑色”物质中含有二价铁,其理由是_______ 。
(5)乙同学用实验ⅲ中所得溶液进行实验iv,证实了甲的判断,实验iv的离子反应方程式为_______ 。
(6)丙同学发现“黑色”物质完全被磁铁吸引,推测“黑色”物质是Fe3O4,写出“铁锈色”物质变成Fe3O4的化学方程式_______ 。
(7)丁同学为证明“黑色”物质是Fe3O4,设计实验方案并预测:取实验ⅲ中少量清液滴入足量的Na2S溶液,认为得到物质的量之比为3∶1的FeS和S沉淀,即可证明。你认为是否合理,并说明理由_______ 。
已知:FeO是一种黑色粉末,不稳定,在空气中加热,可被氧化成Fe3O4,隔绝空气加热会歧化为Fe和Fe3O4。
Ⅰ.FeCl3溶液的灼烧。
实验ⅰ:将一只白粉笔浸泡在FeCl3溶液中,用坩埚钳夹持粉笔于酒精灯上灼烧,很快观察到粉笔表面颜色的变化:黄色→红褐色→铁锈色→黑色。

(1)配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度。结合化学用语解释将氯化铁晶体溶于盐酸的目的
(2)“黄色→红褐色→铁锈色→黑色”颜色变化中的“铁锈色”物质是
(3)针对“黑色”物质,小组成员提出猜想。
猜想1:酒精灼烧粉笔的产物;
猜想2:酒精还原“铁锈色”物质得到的产物。
通过实验排除了猜想①,实验操作和现象是
Ⅱ.探究“黑色”物质的成分。
实验ⅱ:先用酒精蒸气排尽装置中的空气,再在“铁锈色”物质处加热,充分反应至“铁锈色”物质完全变成“黑色”物质。取下装有新制Cu(OH)2的试管,加热,有砖红色沉淀生成。

实验ⅲ:在“黑色”物质中加入热的硫酸,“黑色”物质溶解,无气泡产生。
(4)甲同学根据实验ⅱ和ⅲ的现象,判断“黑色”物质中含有二价铁,其理由是
(5)乙同学用实验ⅲ中所得溶液进行实验iv,证实了甲的判断,实验iv的离子反应方程式为
(6)丙同学发现“黑色”物质完全被磁铁吸引,推测“黑色”物质是Fe3O4,写出“铁锈色”物质变成Fe3O4的化学方程式
(7)丁同学为证明“黑色”物质是Fe3O4,设计实验方案并预测:取实验ⅲ中少量清液滴入足量的Na2S溶液,认为得到物质的量之比为3∶1的FeS和S沉淀,即可证明。你认为是否合理,并说明理由
您最近一年使用:0次
2021-01-21更新
|
759次组卷
|
4卷引用:北京市石景山区2021届高三上学期期末考试化学试题
北京市石景山区2021届高三上学期期末考试化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)重庆市黔江新华中学校2021届高三毕业班第二次联合考试化学试题(已下线)2020年天津卷化学高考真题变式题13-16
解题方法
7 . 下列离子方程式中,正确的是
A.铁钉放入硫酸铜溶液中:Fe + SO = FeSO4 = FeSO4 |
| B.氧化铁和稀硫酸反应:Fe2O3 + 6H+ = 2Fe2+ + 3H2O |
C.向Ba(OH)2溶液中滴加H2SO4溶液至恰好为中性:Ba2+ + OH-+ H+ + SO = BaSO4↓+H2O = BaSO4↓+H2O |
| D.氢氧化铁与盐酸反应:Fe (OH)3 + 3H+ = Fe3+ + 3H2O |
您最近一年使用:0次
2020-11-12更新
|
1612次组卷
|
3卷引用:北京市第四十三中学2020—2021学年高一上学期学期中考试化学试题
名校
解题方法
8 . 二水合草酸亚铁(FeC2O4•2H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是


| A.b点的固体成分为FeC2O4•H2O |
B.b→c 的方程式为 FeC2O4 FeCO3+CO↑ FeCO3+CO↑ |
| C.从a→d, 生成的CO、CO2的物质的量相等 |
| D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C |
您最近一年使用:0次
2020-01-29更新
|
483次组卷
|
5卷引用:专题9 本专题达标检测-高中化学必修第二册苏教版2019
解题方法
9 . 某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,一氧化碳与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和二氧化碳,他们不禁产生了疑问:一氧化碳与氧化铁反应生成的黑色物质真的是铁粉吗?于是他们进行了以下探究:
[查阅资料]
资料一:铁粉和四氧化三铁粉末能被磁铁吸引而氧化亚铁(黑色)不能;
资料二:四氧化三铁中铁元素有+2、+3两种化合价,其化学式可用FeO·Fe2O3的形式表示。
[提出猜想]黑色物质可能是四氧化三铁、氧化亚铁和铁粉中的一种或几种。
[进行实验]兴趣小组收集了一氧化碳与氧化铁反应生成的黑色物质进行了下列实验:
[实验结论]
(1)甲实验现象说明黑色物质中没有_______ ,乙、丙实验现象说明黑色物质中没有______ ;
(2)生成的黑色物质应为四氧化三铁;
(3)写出黑色粉末和热的盐酸反应的化学方程式_______________________________ 。
[拓展研究]
同学们对四氧化三铁产生了兴趣,从参考资料中找到氧化沉淀法生产复印用高档四氧化三铁粉的工艺流程简图。
[生产流程]
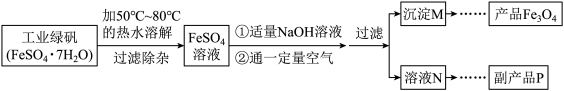
[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
资料二:氢氧化亚铁受氧气氧化反应原理为4Fe(OH)2+2H2O+O2===4Fe(OH)3
资料三:获得四氧化三铁的反应原理为Fe(OH)2+2Fe(OH)3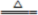 Fe3O4+4H2O
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50 ℃至80 ℃的热水目的是____________________________________ 。
(2)写出加入适量氢氧化钠溶液时发生反应的化学方程式________________________ 。
(3)上述过程中,要控制“通一定量空气”的目的是____________________________ 。
(4)要使四氧化三铁的产率最高,则上述流程中产生的氢氧化亚铁和氢氧化铁的最佳质量比为______________ 。
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→_____→_____→d。_______
a.过滤
b.加热浓缩
c.冷却结晶
d.晶体加热至完全失去结晶水
[组成确定]
为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究。
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:氧化铁和一氧化碳反应是随温度升高而逐步进行的,先生成四氧化三铁,再生成氧化亚铁(黑色),最后生成铁。
[提出猜想]
四氧化三铁中可能含有的杂质是氧化铁和氧化亚铁中的一种或两种。
[实验设计]
同学们称取了23.28 g该四氧化三铁样品进行了下列实验:
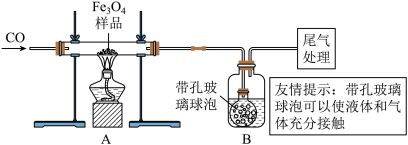
[实验分析]
因探究思路不同,兴趣小组分成甲、乙两小组。
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该四氧化三铁样品中的杂质,B中的最佳试剂是_________ (填序号)。
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,一氧化碳气体除作为反应物外,还能起到的作用是:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;
③_____________________________________________ 。
(3)乙组同学认为B装置反应前后的质量差会偏小而影响计算、分析,你认为他们的理由是_______________________________________________ 。
乙组:
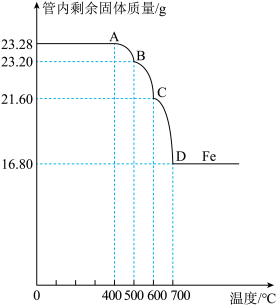
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图):
(1)写出BC段发生反应的化学方程式______________________________ 。
(2)通过计算确定:该四氧化三铁样品中含有的杂质是__________ ,其中含四氧化三铁的质量是____ g。(不需要写过程)
[查阅资料]
资料一:铁粉和四氧化三铁粉末能被磁铁吸引而氧化亚铁(黑色)不能;
资料二:四氧化三铁中铁元素有+2、+3两种化合价,其化学式可用FeO·Fe2O3的形式表示。
[提出猜想]黑色物质可能是四氧化三铁、氧化亚铁和铁粉中的一种或几种。
[进行实验]兴趣小组收集了一氧化碳与氧化铁反应生成的黑色物质进行了下列实验:
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变为黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
[实验结论]
(1)甲实验现象说明黑色物质中没有
(2)生成的黑色物质应为四氧化三铁;
(3)写出黑色粉末和热的盐酸反应的化学方程式
[拓展研究]
同学们对四氧化三铁产生了兴趣,从参考资料中找到氧化沉淀法生产复印用高档四氧化三铁粉的工艺流程简图。
[生产流程]

[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料二:氢氧化亚铁受氧气氧化反应原理为4Fe(OH)2+2H2O+O2===4Fe(OH)3
资料三:获得四氧化三铁的反应原理为Fe(OH)2+2Fe(OH)3
 Fe3O4+4H2O
Fe3O4+4H2O[问题讨论]
(1)溶解时,用50 ℃至80 ℃的热水目的是
(2)写出加入适量氢氧化钠溶液时发生反应的化学方程式
(3)上述过程中,要控制“通一定量空气”的目的是
(4)要使四氧化三铁的产率最高,则上述流程中产生的氢氧化亚铁和氢氧化铁的最佳质量比为
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→_____→_____→d。
a.过滤
b.加热浓缩
c.冷却结晶
d.晶体加热至完全失去结晶水
[组成确定]
为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究。
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:氧化铁和一氧化碳反应是随温度升高而逐步进行的,先生成四氧化三铁,再生成氧化亚铁(黑色),最后生成铁。
[提出猜想]
四氧化三铁中可能含有的杂质是氧化铁和氧化亚铁中的一种或两种。
[实验设计]
同学们称取了23.28 g该四氧化三铁样品进行了下列实验:

[实验分析]
因探究思路不同,兴趣小组分成甲、乙两小组。
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该四氧化三铁样品中的杂质,B中的最佳试剂是
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,一氧化碳气体除作为反应物外,还能起到的作用是:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;
③
(3)乙组同学认为B装置反应前后的质量差会偏小而影响计算、分析,你认为他们的理由是
乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图):
(1)写出BC段发生反应的化学方程式
(2)通过计算确定:该四氧化三铁样品中含有的杂质是

您最近一年使用:0次
2020-01-29更新
|
274次组卷
|
2卷引用:人教版高中化学必修1第三章《金属及其化合物》测试卷5
10 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某化学兴趣小组将无水三草酸合铁酸钾按如图所示装置进行实验。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。

限选试剂:浓硫酸、1.0mol/L HNO3、1.0mol/L盐酸、1.0 mol/L NaOH.3% H2O2、0.1 mol/LKI、0.1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
I.若实验中,观察到B、F中溶液均变浑浊,则E中的现象是____ ,推测三草酸合铁酸钾分解的气体产物是____ 。该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。
Ⅱ.探究固体产物中铁元素的存在形式。
(1)提出合理假设:假设l____ ;假设2____ ;假设3____ 。
(2)设计实验方案并验证
①取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
②取少量上述不溶固体放入试管中,加入足量____ 溶液,充分振荡。若溶液颜色及加入的不溶固体无明显变化,则假设____ 成立。若溶液颜色明显改变,且有暗红色固体生成,则证明有____ 存在。
③取②所得暗红色固体于试管中,滴加过量____ ,振荡后静置。取上层清液于试管中,滴加适量____ ,再滴加____ ,若溶液基本无色,则假设____ 成立;若溶液呈____ ,则假设_____ 成立。

限选试剂:浓硫酸、1.0mol/L HNO3、1.0mol/L盐酸、1.0 mol/L NaOH.3% H2O2、0.1 mol/LKI、0.1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
I.若实验中,观察到B、F中溶液均变浑浊,则E中的现象是
Ⅱ.探究固体产物中铁元素的存在形式。
(1)提出合理假设:假设l
(2)设计实验方案并验证
①取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
②取少量上述不溶固体放入试管中,加入足量
③取②所得暗红色固体于试管中,滴加过量
您最近一年使用:0次



