名校
解题方法
1 . 用锈蚀了的废铁屑(铁锈主要成分是 )为原料制备
)为原料制备 晶体的流程可简要表示如下:
晶体的流程可简要表示如下:
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生的主要反应的离子方程式有:① ;②
;②_______ ;③_______ 。
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液出现白色沉淀,沉淀最终转化为红褐色,写出生成红褐色沉淀的化学方程式_______ 。
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是_______ ,为控制该温度可以采用_______ 进行加热。
(4)“氧化”过程可在如图所示装置中进行。_______
(5)从 溶液制得
溶液制得 晶体的系列操作是蒸发浓缩至有晶膜出现、
晶体的系列操作是蒸发浓缩至有晶膜出现、_______ 、_______ 、洗涤、干燥。
 )为原料制备
)为原料制备 晶体的流程可简要表示如下:
晶体的流程可简要表示如下:
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生的主要反应的离子方程式有:①
 ;②
;②(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液出现白色沉淀,沉淀最终转化为红褐色,写出生成红褐色沉淀的化学方程式
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是
(4)“氧化”过程可在如图所示装置中进行。

(5)从
 溶液制得
溶液制得 晶体的系列操作是蒸发浓缩至有晶膜出现、
晶体的系列操作是蒸发浓缩至有晶膜出现、
您最近一年使用:0次
2022-12-07更新
|
316次组卷
|
4卷引用:湖南省邵阳市新邵县第三中学2023-2024学年高一上学期12月月考化学试题
名校
2 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2(难溶于稀硫酸)、Al2O3等,用硫酸渣制备铁红(Fe2O3)的过程如图,回答下列问题: 还有
还有___________ (填离子符号),写出Fe2O3与稀硫酸反应的离子方程式:___________ 。
(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:___________ 。
(4)“氧化”时,可观察到的实验现象为___________ 。若加入的NaOH溶液过量,则“滤液B”中的溶质除了NaOH外,还含有___________ ;若加入的NaOH溶液不足,则制得的铁红中含有的杂质为___________ (填化学式)。

 还有
还有(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:
(4)“氧化”时,可观察到的实验现象为
您最近一年使用:0次
2022-05-06更新
|
808次组卷
|
15卷引用:湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题
湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题湖南省怀化市沅陵县第一中学2021-2022学年高一下学期期中考试化学试题湖南省长沙市实验中学2021-2022学年高一下学期入学考试化学试题湖南省衡阳市祁东县2021-2022学年高一上学期期末考试化学试题湖南省株洲市九方中学2022-2023学年高三上学期第四次月考化学试题河北省秦皇岛市青龙满族自治县实验中学2022-2023学年高一上学期期末考试化学试题山西省吕梁市2021-2022学年高一上学期期末考试化学试题河北省秦皇岛市2021-2022学年高一上学期期末统一考试化学试题河北省廊坊市2021-2022学年高一上学期期末统一考试化学试题安徽省宣城中学2021-2022学年高一下学期期中考试化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)安徽省滁州市定远县育才学校2021-2022学年高一下学期5月月考化学试题湖北省襄阳市第四中学2021-2022学年高一下学期2月考试化学试题云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题
名校
解题方法
3 . 烟道灰中含有 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:

已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
② 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。

回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为___________ 。
(2)试剂X可能为___________。
(3)步骤M的目的是___________ ;
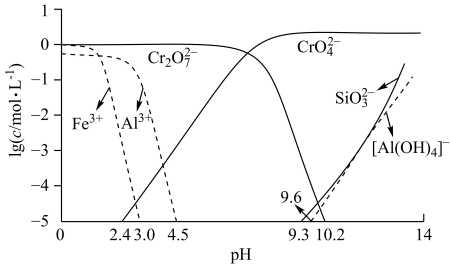
(4)步骤M后应调节 的范围为
的范围为___________ ;不同 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为___________ 。
(5) 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为___________ 。
(6)某实验室设计了如图b所示装置,通过通入 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为___________ 。

 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
| 金属离子 |  |  |  |
| 开始沉淀的pH | 7.0 | 1.9 | 8.1 |
| 完全沉淀的pH | 9.0 | 3.2 | 10.1 |
 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为
(2)试剂X可能为___________。
A. 溶液 溶液 | B.氨水 | C. 溶液 溶液 | D.稀 |
(3)步骤M的目的是
(4)步骤M后应调节
 的范围为
的范围为 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为(5)
 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为(6)某实验室设计了如图b所示装置,通过通入
 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为
您最近一年使用:0次
解题方法
4 . 铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为 ,含
,含 、CuO、
、CuO、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
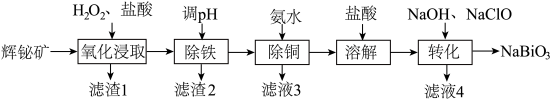
已知:
i. 易水解。
易水解。 难溶于冷水。
难溶于冷水。
ii.“氧化浸取”时,铋元素转化为 ,硫元素转化为硫单质。
,硫元素转化为硫单质。
iii.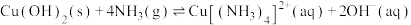
 。
。
回答下列问题:
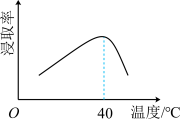
(1)为提高“浸取”速率,采取的措施有:升高温度、___________ (写出一条)。辉铋矿浸取率随温度的变化曲线如图,高于40℃时浸取率快速下降,其可能的原因是___________ 。
(2)“氧化浸取”时, 和
和 发生反应的物质的量之比为
发生反应的物质的量之比为___________ 。
(3)“除铜”时发生反应: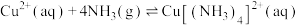
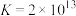 ,则
,则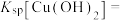
___________ 。
(4)“转化”时,生成 的离子方程式为
的离子方程式为___________ 。
(5)已知酸性环境下, 可以将
可以将 氧化成
氧化成 (
( 被还原成
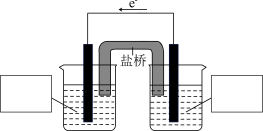
被还原成 )。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式
)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式___________ ,并写出正极的电极反应式:___________ 。
(6)取 产品w g,加入足量稀硫酸和
产品w g,加入足量稀硫酸和 稀溶液使其完全反应,再用a mol·L
稀溶液使其完全反应,再用a mol·L
 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗b mL标准溶液。该产品的纯度为
,当溶液紫红色恰好褪去时,消耗b mL标准溶液。该产品的纯度为___________ (用含w、a、b的代数式表示)。
 ,含
,含 、CuO、
、CuO、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
已知:
i.
 易水解。
易水解。 难溶于冷水。
难溶于冷水。ii.“氧化浸取”时,铋元素转化为
 ,硫元素转化为硫单质。
,硫元素转化为硫单质。iii.
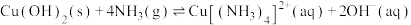
 。
。回答下列问题:
(1)为提高“浸取”速率,采取的措施有:升高温度、

(2)“氧化浸取”时,
 和
和 发生反应的物质的量之比为
发生反应的物质的量之比为(3)“除铜”时发生反应:
 ,则
,则
(4)“转化”时,生成
 的离子方程式为
的离子方程式为(5)已知酸性环境下,
 可以将
可以将 氧化成
氧化成 (
( 被还原成
被还原成 )。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式
)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式
(6)取
 产品w g,加入足量稀硫酸和
产品w g,加入足量稀硫酸和 稀溶液使其完全反应,再用a mol·L
稀溶液使其完全反应,再用a mol·L
 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗b mL标准溶液。该产品的纯度为
,当溶液紫红色恰好褪去时,消耗b mL标准溶液。该产品的纯度为
您最近一年使用:0次
5 . 工业上以铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题:___ ;冷却结晶所得母液中,除Na2Cr2O7外,可在上述流程中循环利用的物质还有____ 。
(4)利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2CrO4+4H2O 2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在
2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在___ (填“阴”或“阳”)极室制得,电解时通过膜的离子主要为___ 。

(1)焙烧的目的是将FeCr2O4转化为Na2CrO4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
中和时pH的理论范围为
(4)利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2CrO4+4H2O
 2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在
2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在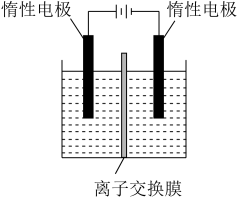
您最近一年使用:0次
2021-06-29更新
|
14389次组卷
|
22卷引用:湖南省邵阳市邵东市创新高级中学2023-2024学年高三上学期第四次月考化学试题
湖南省邵阳市邵东市创新高级中学2023-2024学年高三上学期第四次月考化学试题第二部分 热点专项突破——解题能力稳提升 专项3 结合理论的综合类工艺流程(已下线)题型39 其他过渡金属及其化合物的转化流程(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省华罗庚中学2023-2024学年高三上学期12月阶段检测化学试卷2021年新高考山东化学高考真题(已下线)微专题32 化学工艺流程题——核心反应与条件控制-备战2022年高考化学考点微专题(已下线)专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)2021年山东高考化学试题变式题11-20(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题27 无机化工流程-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题27 化学工艺流程题-----物质的分离与提纯-备战2023年高考化学一轮复习考点微专题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题



