名校
解题方法
1 . 用锈蚀了的废铁屑(铁锈主要成分是 )为原料制备
)为原料制备 晶体的流程可简要表示如下:
晶体的流程可简要表示如下:
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生的主要反应的离子方程式有:① ;②
;②_______ ;③_______ 。
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液出现白色沉淀,沉淀最终转化为红褐色,写出生成红褐色沉淀的化学方程式_______ 。
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是_______ ,为控制该温度可以采用_______ 进行加热。
(4)“氧化”过程可在如图所示装置中进行。_______
(5)从 溶液制得
溶液制得 晶体的系列操作是蒸发浓缩至有晶膜出现、
晶体的系列操作是蒸发浓缩至有晶膜出现、_______ 、_______ 、洗涤、干燥。
 )为原料制备
)为原料制备 晶体的流程可简要表示如下:
晶体的流程可简要表示如下:
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生的主要反应的离子方程式有:①
 ;②
;②(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液出现白色沉淀,沉淀最终转化为红褐色,写出生成红褐色沉淀的化学方程式
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是
(4)“氧化”过程可在如图所示装置中进行。

(5)从
 溶液制得
溶液制得 晶体的系列操作是蒸发浓缩至有晶膜出现、
晶体的系列操作是蒸发浓缩至有晶膜出现、
您最近一年使用:0次
2022-12-07更新
|
310次组卷
|
4卷引用:湖南省邵阳市新邵县第三中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
2 . 用氧化焙烧-软锰矿浆吸收工艺处理砷华废渣,吸收液经净化除杂、浓缩结晶等工序可制备工业产品硫酸锰。

已知:a.砷华废渣中硫主要以FeS、FeS2、FeAsS、单质硫、硫酸盐等形态存在;铁主要以Fe2O3、FeAsS、FeS形态存在;砷主要以FeAsS、Fe3(AsO4)2等形态存在。
b.软锰矿吸收的过程中,除锰浸出外,还伴随着杂质Fe、Al、Ca、Pb和Si等的同时浸出。
c.SDD为二乙胺硫代甲酸钠。
d.溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)砷华废渣预先粉碎的目的是___ ;写出焙烧时FeAsS被氧气氧化成+3价金属氧化物和SO2的方程式:___ 。
(2)砷华废渣焙烧温度与Mn的浸出率的关系图如图:
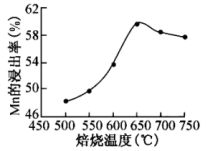
①焙烧的适宜温度为___ 。
②Mn的浸出率随着焙烧的温度升高而升高,温度高于650℃后,Mn的浸出率降低的可能原因是___ 。
(3)软锰矿浆(MnO2)吸收焙烧放出的SO2的化学方程式为___ 。
(4)加入MnO2粉末的目的是氧化Fe2+,其发生反应的离子方程式为___ 。
(5)根据实验目的调节pH的范围是___ 。
(6)称量产品MnSO4·H2O17.21g,溶于水,滴加足量的BaCl2溶液,生成的沉淀,经过过滤、洗涤、干燥后得固体,称量固体的质量为23.30g,则产品中MnSO4·H2O的质量分数为___ %(保留1位小数)。

已知:a.砷华废渣中硫主要以FeS、FeS2、FeAsS、单质硫、硫酸盐等形态存在;铁主要以Fe2O3、FeAsS、FeS形态存在;砷主要以FeAsS、Fe3(AsO4)2等形态存在。
b.软锰矿吸收的过程中,除锰浸出外,还伴随着杂质Fe、Al、Ca、Pb和Si等的同时浸出。
c.SDD为二乙胺硫代甲酸钠。
d.溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Pb2+ | Mn2+ |
| 开始沉淀时pH | 7.0 | 1.9 | 3.7 | 7.1 | 8.1 |
| 完全沉淀时pH | 9.0 | 3.2 | 4.7 | 9.1 | 10.1 |
(1)砷华废渣预先粉碎的目的是
(2)砷华废渣焙烧温度与Mn的浸出率的关系图如图:

①焙烧的适宜温度为
②Mn的浸出率随着焙烧的温度升高而升高,温度高于650℃后,Mn的浸出率降低的可能原因是
(3)软锰矿浆(MnO2)吸收焙烧放出的SO2的化学方程式为
(4)加入MnO2粉末的目的是氧化Fe2+,其发生反应的离子方程式为
(5)根据实验目的调节pH的范围是
(6)称量产品MnSO4·H2O17.21g,溶于水,滴加足量的BaCl2溶液,生成的沉淀,经过过滤、洗涤、干燥后得固体,称量固体的质量为23.30g,则产品中MnSO4·H2O的质量分数为
您最近一年使用:0次
2021-09-10更新
|
251次组卷
|
3卷引用:湖南省天壹名校联盟 2022届高三入学摸底考试化学试题
名校
解题方法
3 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含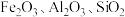 (难溶于稀硫酸),用硫酸渣制备铁红
(难溶于稀硫酸),用硫酸渣制备铁红 的过程如图:
的过程如图:

(1)“酸溶”过程中,加入过量稀硫酸充分反应后的溶液中含有的阳离子除了 ,还有
,还有____________ (填离子符号),写出 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:____________ .
(2)实验室中过滤需要用到的玻璃仪器有____________ .
(3)滤渣A的主要成分是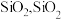 是一种常见的酸性氧化物,与
是一种常见的酸性氧化物,与 类似,可与强碱反应,写出
类似,可与强碱反应,写出 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:____________ .
(4)“氧化”时,可观察到的现象为____________ .若加入的 溶液过量,则滤液B中的溶质除了
溶液过量,则滤液B中的溶质除了 外,还有
外,还有____________ (填化学式,下同);若加入的 溶液不够,则制得的铁红中可能含有的杂质为
溶液不够,则制得的铁红中可能含有的杂质为____________ .
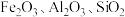 (难溶于稀硫酸),用硫酸渣制备铁红
(难溶于稀硫酸),用硫酸渣制备铁红 的过程如图:
的过程如图:
(1)“酸溶”过程中,加入过量稀硫酸充分反应后的溶液中含有的阳离子除了
 ,还有
,还有 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(2)实验室中过滤需要用到的玻璃仪器有
(3)滤渣A的主要成分是
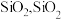 是一种常见的酸性氧化物,与
是一种常见的酸性氧化物,与 类似,可与强碱反应,写出
类似,可与强碱反应,写出 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:(4)“氧化”时,可观察到的现象为
 溶液过量,则滤液B中的溶质除了
溶液过量,则滤液B中的溶质除了 外,还有
外,还有 溶液不够,则制得的铁红中可能含有的杂质为
溶液不够,则制得的铁红中可能含有的杂质为
您最近一年使用:0次
2024-02-03更新
|
74次组卷
|
2卷引用:湖南省岳阳市 岳阳县第一中学2023-2024学年高一下学期开学化学试题
名校
4 . 某工业废水中含有大量的Cu2+、Fe3+、Fe2+和 ,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
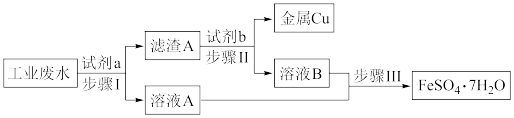
(1)下列叙述正确的是___________。
(2)步骤Ⅰ发生反应的离子方程式为Fe+Cu2+=Fe2++Cu和___________ 。
(3)取2mL溶液A于试管中,滴加少量NaOH溶液,观察到的实验现象是___________ 。
(4)获得的绿矾晶体(FeSO4·7H2O)可能有部分被氧化,请设计检验方案验证(操作、现象、结论)___________ 。
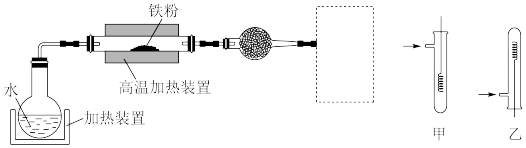
(5)已知:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是___________ (填“甲”或“乙”)。
 ,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
(1)下列叙述正确的是___________。
| A.滤渣A为Fe和Cu的混合物 |
| B.试剂b为盐酸 |
| C.步骤Ⅱ可以分离出Cu,并能得到FeSO4溶液 |
| D.步骤Ⅲ为蒸发溶液 |
(3)取2mL溶液A于试管中,滴加少量NaOH溶液,观察到的实验现象是
(4)获得的绿矾晶体(FeSO4·7H2O)可能有部分被氧化,请设计检验方案验证(操作、现象、结论)
(5)已知:3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
您最近一年使用:0次
2022-02-20更新
|
147次组卷
|
2卷引用:湖南省娄底市第四中学2021-2022学年高一下学期第一次月考化学试题
名校
5 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2(难溶于稀硫酸)、Al2O3等,用硫酸渣制备铁红(Fe2O3)的过程如图,回答下列问题: 还有
还有___________ (填离子符号),写出Fe2O3与稀硫酸反应的离子方程式:___________ 。
(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:___________ 。
(4)“氧化”时,可观察到的实验现象为___________ 。若加入的NaOH溶液过量,则“滤液B”中的溶质除了NaOH外,还含有___________ ;若加入的NaOH溶液不足,则制得的铁红中含有的杂质为___________ (填化学式)。

 还有
还有(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:
(4)“氧化”时,可观察到的实验现象为
您最近一年使用:0次
2022-05-06更新
|
791次组卷
|
15卷引用:湖南省怀化市沅陵县第一中学2021-2022学年高一下学期期中考试化学试题
湖南省怀化市沅陵县第一中学2021-2022学年高一下学期期中考试化学试题湖南省长沙市实验中学2021-2022学年高一下学期入学考试化学试题湖南省衡阳市祁东县2021-2022学年高一上学期期末考试化学试题湖南省株洲市九方中学2022-2023学年高三上学期第四次月考化学试题湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题山西省吕梁市2021-2022学年高一上学期期末考试化学试题河北省秦皇岛市2021-2022学年高一上学期期末统一考试化学试题河北省廊坊市2021-2022学年高一上学期期末统一考试化学试题安徽省宣城中学2021-2022学年高一下学期期中考试化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)安徽省滁州市定远县育才学校2021-2022学年高一下学期5月月考化学试题湖北省襄阳市第四中学2021-2022学年高一下学期2月考试化学试题云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题河北省秦皇岛市青龙满族自治县实验中学2022-2023学年高一上学期期末考试化学试题广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题
名校
解题方法
6 . 我国某现代化铜冶炼厂排放的废水中含有较多的 、
、 、
、 、
、 和少量的
和少量的 ,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体(
,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体( )并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
)并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。

已知:加入的试剂①为 溶液。回答下列问题:
溶液。回答下列问题:
(1)操作a的名称为_______ ,在实验室进行该操作时需要用到的玻璃仪器有_______ ;溶液A中所含的溶质主要为_______ (填化学式)。
(2)加入的试剂③为_______ (填试剂名称)。
(3)检验溶液D中的金属阳离子的具体操作及现象为_______ ,写出检验过程中属于氧化还原反应的离子方程式并用双线桥法标出电子转移的数目和方向:_______ 。
(4)若取 溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为
溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为_______ ,此现象中涉及的氧化还原反应的化学方程式为_______ 。
 、
、 、
、 、
、 和少量的
和少量的 ,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体(
,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体( )并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
)并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
已知:加入的试剂①为
 溶液。回答下列问题:
溶液。回答下列问题:(1)操作a的名称为
(2)加入的试剂③为
(3)检验溶液D中的金属阳离子的具体操作及现象为
(4)若取
 溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为
溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为
您最近一年使用:0次
2021-12-19更新
|
258次组卷
|
2卷引用:湖南省部分校2021-2022学年高一上学期12月联考化学试题
解题方法
7 . 七水合硫酸亚铁( )是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:
)是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:

回答下列问题
(1)工业烧渣与稀硫酸反应的离子反应有: ,②
,②___________ 。
(2)加入的试剂 是:
是:___________ 。
A. B.
B. C.
C. D.
D.
(3)若需检验还原后的 溶液中是否存在有
溶液中是否存在有 ,可选择的方法是取2-3mL试液,在其中滴加
,可选择的方法是取2-3mL试液,在其中滴加___________ 溶液(填化学式),当___________ 时(填实验现象),说明溶液中存在 。
。
(4)利用工业烧渣还可以制得一种重要的净水剂 ,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与
,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与 、烧碱在40℃反应,即可制备
、烧碱在40℃反应,即可制备 ,其中
,其中 被还原成
被还原成 ,此方法称为“湿法”;请写出湿法制备
,此方法称为“湿法”;请写出湿法制备 的化学方程式:
的化学方程式:___________ 。
(5)制备 还有一方法称为“干法”,其反应原理为:
还有一方法称为“干法”,其反应原理为: ;若用
;若用 替代
替代 进行上述反应,当标准状况下产生
进行上述反应,当标准状况下产生 时,则需消耗
时,则需消耗
___________ 
 )是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:
)是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:
回答下列问题
(1)工业烧渣与稀硫酸反应的离子反应有:
 ,②
,②(2)加入的试剂
 是:
是:A.
 B.
B. C.
C. D.
D.
(3)若需检验还原后的
 溶液中是否存在有
溶液中是否存在有 ,可选择的方法是取2-3mL试液,在其中滴加
,可选择的方法是取2-3mL试液,在其中滴加 。
。(4)利用工业烧渣还可以制得一种重要的净水剂
 ,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与
,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与 、烧碱在40℃反应,即可制备
、烧碱在40℃反应,即可制备 ,其中
,其中 被还原成
被还原成 ,此方法称为“湿法”;请写出湿法制备
,此方法称为“湿法”;请写出湿法制备 的化学方程式:
的化学方程式:(5)制备
 还有一方法称为“干法”,其反应原理为:
还有一方法称为“干法”,其反应原理为: ;若用
;若用 替代
替代 进行上述反应,当标准状况下产生
进行上述反应,当标准状况下产生 时,则需消耗
时,则需消耗

您最近一年使用:0次
名校
8 . 炼铁厂的废渣铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO Fe2O3及少量的CaO、MgO、SiO2 ,等等。可利用废渣铁矾渣制备复合镍锌铁氧体 (NiZnFe4O8.具体制备流程如下图所示:
Fe2O3及少量的CaO、MgO、SiO2 ,等等。可利用废渣铁矾渣制备复合镍锌铁氧体 (NiZnFe4O8.具体制备流程如下图所示:
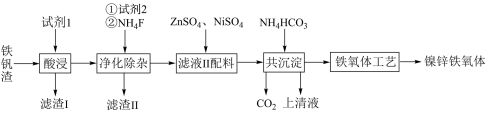
(1)试剂1是过量的______ 。
(2)试剂2为过量的铁粉,加入后可以观察的现象有______________________ 。
(3)NH4F溶液不能放入玻璃器皿中保存,理由是_____________________________ (用离子方程式表示)。已知:25 °C时,Ksp(CaF2)=2.7×10-11、,Ksp(MgF2)=6.4×10-19。加入NH4F溶液沉淀后,c(Mg2+) = 1. 6×10-10mol • L-1,此时Ca2+是否也完全沉淀?写出具体的分析过程:______ (若溶液中某离子浓度小于1.0×10-5mol • L-1时,说明该离子已沉淀完全)。
(4)在Fe2+、Ni2+、Zn2+共沉淀过程中,若以Me代表Fe、Ni、Zn元素,则生成MeCO3•2Me(OH)2•H2O沉淀的化学方程式为________________________________ .
(5)按照上述流程,一座10万吨规模的炼铁厂每年产生铁矾渣约5万吨,Fe3+含量为44.8%,理论上每年至少可制备复合镍锌铁氧体(NiZnFe4O8,M=476 g • mol -1)__________ 万吨。
(6)滤液Ⅱ中加入的ZnSO4溶液,低温烘干后可得到皓矾(ZnSO4• 7H2O) 取28.70 g皓矾加热至不同温度,剩余固体的质量变化如图所示:

①100 °C时所得固体的化学式__________ 。
②680 °C时所得固体的化学式为____
 Fe2O3及少量的CaO、MgO、SiO2 ,等等。可利用废渣铁矾渣制备复合镍锌铁氧体 (NiZnFe4O8.具体制备流程如下图所示:
Fe2O3及少量的CaO、MgO、SiO2 ,等等。可利用废渣铁矾渣制备复合镍锌铁氧体 (NiZnFe4O8.具体制备流程如下图所示:
(1)试剂1是过量的
(2)试剂2为过量的铁粉,加入后可以观察的现象有
(3)NH4F溶液不能放入玻璃器皿中保存,理由是
(4)在Fe2+、Ni2+、Zn2+共沉淀过程中,若以Me代表Fe、Ni、Zn元素,则生成MeCO3•2Me(OH)2•H2O沉淀的化学方程式为
(5)按照上述流程,一座10万吨规模的炼铁厂每年产生铁矾渣约5万吨,Fe3+含量为44.8%,理论上每年至少可制备复合镍锌铁氧体(NiZnFe4O8,M=476 g • mol -1)
(6)滤液Ⅱ中加入的ZnSO4溶液,低温烘干后可得到皓矾(ZnSO4• 7H2O) 取28.70 g皓矾加热至不同温度,剩余固体的质量变化如图所示:

①100 °C时所得固体的化学式
②680 °C时所得固体的化学式为
您最近一年使用:0次
名校
解题方法
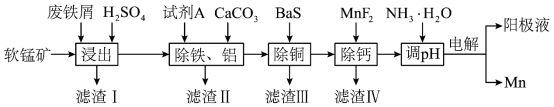
9 . 以废铁屑、低品位软锰矿[主要成分有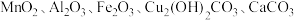 、
、 等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
已知:I.部分金属阳离子以氢氧化物沉淀时的 如表:
如表:
Ⅱ.几种化合物的溶解性或溶度积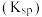 如表:
如表:
(1)基态 的价层电子排布式为
的价层电子排布式为__________ 。
(2)为去除废铁屑表面的油污可采用的方法为__________ ;“浸出”后浸出液中的 价金属阳离子有
价金属阳离子有 、
、__________ 。
(3)锰的浸出率结果如图所示。

由图可知,影响锰浸出率的因素有__________ 。
(4)“除铁、铝”过程中,浸出液需要先用试剂 处理,然后加入
处理,然后加入 ,反应后溶液的
,反应后溶液的 。试剂
。试剂 的作用是
的作用是__________ 。
(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于 时视为完全沉淀)时,溶液中
时视为完全沉淀)时,溶液中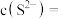
__________  。
。
(6)用惰性电极电解中性 溶液可以制得金属
溶液可以制得金属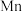 。装置如图所示。
。装置如图所示。
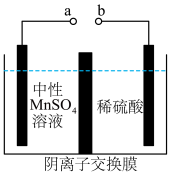
若生成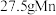 ,右室溶液中最终
,右室溶液中最终 的变化为
的变化为__________ (填“增加”或“减少”) 。
。
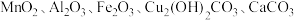 、
、 等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
已知:I.部分金属阳离子以氢氧化物沉淀时的
 如表:
如表:| 金属阳离子 |  |  |  |  |  |
开始沉淀的 | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
沉淀完全的 | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
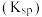 如表:
如表:| 化合物 |  |  |  |  |  |
溶解性或溶度积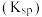 | 溶于水 | 溶于水 | 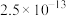 |  |  |
(1)基态
 的价层电子排布式为
的价层电子排布式为(2)为去除废铁屑表面的油污可采用的方法为
 价金属阳离子有
价金属阳离子有 、
、(3)锰的浸出率结果如图所示。

由图可知,影响锰浸出率的因素有
(4)“除铁、铝”过程中,浸出液需要先用试剂
 处理,然后加入
处理,然后加入 ,反应后溶液的
,反应后溶液的 。试剂
。试剂 的作用是
的作用是(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于
 时视为完全沉淀)时,溶液中
时视为完全沉淀)时,溶液中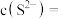
 。
。(6)用惰性电极电解中性
 溶液可以制得金属
溶液可以制得金属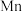 。装置如图所示。
。装置如图所示。
若生成
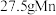 ,右室溶液中最终
,右室溶液中最终 的变化为
的变化为 。
。
您最近一年使用:0次
名校
解题方法
10 . 烟道灰中含有 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:

已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
② 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。

回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为___________ 。
(2)试剂X可能为___________。
(3)步骤M的目的是___________ ;
(4)步骤M后应调节 的范围为
的范围为___________ ;不同 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为___________ 。
(5) 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为___________ 。
(6)某实验室设计了如图b所示装置,通过通入 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为___________ 。

 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
| 金属离子 |  |  |  |
| 开始沉淀的pH | 7.0 | 1.9 | 8.1 |
| 完全沉淀的pH | 9.0 | 3.2 | 10.1 |
 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为
(2)试剂X可能为___________。
A. 溶液 溶液 | B.氨水 | C. 溶液 溶液 | D.稀 |
(3)步骤M的目的是
(4)步骤M后应调节
 的范围为
的范围为 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为(5)
 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为(6)某实验室设计了如图b所示装置,通过通入
 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为
您最近一年使用:0次



