名校
解题方法
1 . Ⅰ.如图为铁及其化合物的“价—类”二维图。

(1)填写二维图中缺失的类别①________ 和化学式②___________ 。
(2)从物质类别上看, 属于盐,可能与
属于盐,可能与_______ 发生反应(填序号);
从化合价角度看,体现 氧化性,可能与
氧化性,可能与______ 反应(填序号)。
① ②KI溶液 ③NaOH溶液 ④
②KI溶液 ③NaOH溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液
Ⅱ.某工厂用 溶液腐蚀镀有铜的绝缘板生产印刷电路,一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
溶液腐蚀镀有铜的绝缘板生产印刷电路,一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
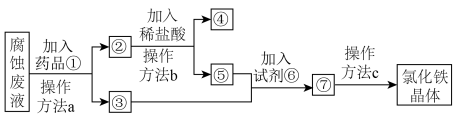
(3)腐蚀废液中加入药品①后,发生反应的离子方程式为___________ 。
(4)④代表的物质是___________ (用化学式表示)。
(5)操作方法a、b、c中是过滤的是________ (填序号)。
(6)若取2 mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,_________ (补全现象),此过程设计氧化还原反应的方程式为________ 。
(7)工业中常用高铁酸钾( )作为高效、多功能的自来水处理剂。湿法制备高铁酸钾的反应体系中有六种微粒:
)作为高效、多功能的自来水处理剂。湿法制备高铁酸钾的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平湿法制高铁酸钾的离子反应方程式:
。写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。

(1)填写二维图中缺失的类别①
(2)从物质类别上看,
 属于盐,可能与
属于盐,可能与从化合价角度看,体现
 氧化性,可能与
氧化性,可能与①
 ②KI溶液 ③NaOH溶液 ④
②KI溶液 ③NaOH溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液Ⅱ.某工厂用
 溶液腐蚀镀有铜的绝缘板生产印刷电路,一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
溶液腐蚀镀有铜的绝缘板生产印刷电路,一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
(3)腐蚀废液中加入药品①后,发生反应的离子方程式为
(4)④代表的物质是
(5)操作方法a、b、c中是过滤的是
(6)若取2 mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(7)工业中常用高铁酸钾(
 )作为高效、多功能的自来水处理剂。湿法制备高铁酸钾的反应体系中有六种微粒:
)作为高效、多功能的自来水处理剂。湿法制备高铁酸钾的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平湿法制高铁酸钾的离子反应方程式:
。写出并配平湿法制高铁酸钾的离子反应方程式:
您最近一年使用:0次
2024-02-12更新
|
120次组卷
|
2卷引用:天津市第四十二中学2023-2024学年高一上学期第二次月考化学试题
名校
解题方法
2 . 某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。请回答下列问题:
和胆矾晶体。请回答下列问题:
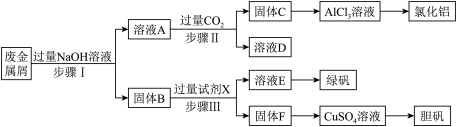
(1)写出步骤I反应的离子方程式__________________________________________________ ;
(2)步骤II中,溶液A中含铝化合物与过量 反应生成固体C的离⼦⽅程式为
反应生成固体C的离⼦⽅程式为____________ ;
(3)在步骤II时,⽤如图装置制取 并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是________ 。

(4)步骤III中试剂X是__________ 。
(5)取步骤III所得溶液E,滴加足量NaOH溶液,观察到的现象为__________ ,产生明显现象的化学方程式为__________ 。
 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。请回答下列问题:
和胆矾晶体。请回答下列问题:
(1)写出步骤I反应的离子方程式
(2)步骤II中,溶液A中含铝化合物与过量
 反应生成固体C的离⼦⽅程式为
反应生成固体C的离⼦⽅程式为(3)在步骤II时,⽤如图装置制取
 并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
(4)步骤III中试剂X是
(5)取步骤III所得溶液E,滴加足量NaOH溶液,观察到的现象为
您最近一年使用:0次
2022-11-24更新
|
300次组卷
|
2卷引用:天津市第一中学2022-2023学年高一上学期第二次月考化学试题
名校
3 . 用低品铜矿(主要含CuS、FeO)制备 的一种工艺流程如下:
的一种工艺流程如下:
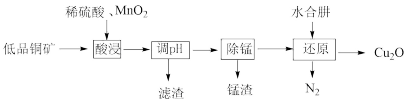
下列说法正确的是
 的一种工艺流程如下:
的一种工艺流程如下:

下列说法正确的是
A.“酸浸”过程中CuS发生反应的离子方程式为: |
B.已知酸浸液中含 ,为检验是否含有 ,为检验是否含有 ,可先加入KSCN溶液,再加氯水观察现象 ,可先加入KSCN溶液,再加氯水观察现象 |
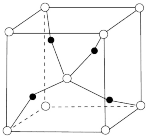
C.1个 晶胞(如图)中含4个氧原子 晶胞(如图)中含4个氧原子 |
D.水合肼浓度过大, 产率下降,可能的原因是 产率下降,可能的原因是 进一步被还原成单质铜 进一步被还原成单质铜 |
您最近一年使用:0次
2022-09-03更新
|
282次组卷
|
3卷引用:天津市新华中学2022-2023学年高三上学期学科练习(一)化学试题
4 . 以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
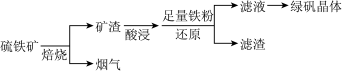
(1)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式___ 。
(2)检验滤液中金属阳离子所用试剂及现象为____ 、____ 。
(3)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由___ 。(结合化学用语说明原因)
(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
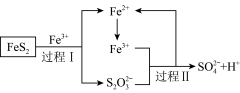
已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整
___FeS2+___Fe3++____=7Fe2++___S2O32-+___,__
②过程II反应的离子方程式____ 。
③研究发现,用氧化亚铁硫杆菌(T.f)脱硫,温度过高脱硫效率降低(如图),可能的原因是___ 。

(5)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸性KMnO4标准溶液滴定,终点现象为___ ;酸性KMnO4 溶液氧化Fe2+ 的离子方程式:____ ;配制酸性高锰酸钾溶液时下列操作将导致Fe2+的浓度偏大的是__ 。
a.定容时仰视 b.容量瓶洗涤后未干燥直接进行配制
c.定容摇匀后液面下降 d.未洗涤烧杯和玻璃棒

(1)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式
(2)检验滤液中金属阳离子所用试剂及现象为
(3)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由
(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:

已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整
___FeS2+___Fe3++____=7Fe2++___S2O32-+___,
②过程II反应的离子方程式
③研究发现,用氧化亚铁硫杆菌(T.f)脱硫,温度过高脱硫效率降低(如图),可能的原因是

(5)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸性KMnO4标准溶液滴定,终点现象为
a.定容时仰视 b.容量瓶洗涤后未干燥直接进行配制
c.定容摇匀后液面下降 d.未洗涤烧杯和玻璃棒
您最近一年使用:0次
2019-11-10更新
|
266次组卷
|
2卷引用:天津市七校(静海一中、宝坻一中、杨村一中等)2020届高三上学期期中联考化学试题
解题方法
5 . 硫酸亚铁(FeSO4)是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是_______ (填一种)。
(2)以FeSO4为原料可制备碱式硫酸铁[ ]、铁红、硫酸亚铁铵[
]、铁红、硫酸亚铁铵[ ,俗名摩尔盐],转化关系如图1所示。
,俗名摩尔盐],转化关系如图1所示。

①制备 时,若
时,若 过高会导致碱式硫酸铁的产率偏低,其原因是
过高会导致碱式硫酸铁的产率偏低,其原因是_______ 。
②制备 时,向
时,向 溶液中加入过量的
溶液中加入过量的 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为_______ ;铁红的化学式为_______ 。
③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、_______ 、洗涤、干燥得到产品。
(3)隔绝空气条件下, 分解时的物质转化关系如图2:
分解时的物质转化关系如图2:

①关于M的成分提出三种猜想:
猜想1:M是 ;
;
猜想2:M是_______ ;
猜想3:M是 和
和 。
。
②已知三种气体的部分性质如表所示:
利用图3装置探究硫酸亚铁部分分解产物。能否将低温浴槽A的温度控制在 ?
?_______ (填“能”或“否”),理由是_______ 。C中试剂可能是_______ 。

(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是
(2)以FeSO4为原料可制备碱式硫酸铁[
 ]、铁红、硫酸亚铁铵[
]、铁红、硫酸亚铁铵[ ,俗名摩尔盐],转化关系如图1所示。
,俗名摩尔盐],转化关系如图1所示。
①制备
 时,若
时,若 过高会导致碱式硫酸铁的产率偏低,其原因是
过高会导致碱式硫酸铁的产率偏低,其原因是②制备
 时,向
时,向 溶液中加入过量的
溶液中加入过量的 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、
(3)隔绝空气条件下,
 分解时的物质转化关系如图2:
分解时的物质转化关系如图2:
①关于M的成分提出三种猜想:
猜想1:M是
 ;
;猜想2:M是
猜想3:M是
 和
和 。
。②已知三种气体的部分性质如表所示:
| 物质 |  |  |  |
| 熔点/℃ | 16.8 | -72.4 | -210 |
| 沸点/℃ | 44.8 | -10 | -195.8 |
 ?
?
您最近一年使用:0次
2022-10-10更新
|
196次组卷
|
2卷引用:天津市实验中学滨海学校2022-2023学年高三上学期期中质量调查化学试题
6 . 铁是人类较早使用的金属之一,运用所学知识,回答下列问题。
Ⅰ.电子工业常用 30%的 FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)Fe 在周期表中的位置是___________ 。检验溶液中 Fe3+存在的试剂是___________ ,证明 Fe3+存在的现象是___________ 。
(2)写出 FeCl3溶液与金属铜发生反应的离子方程式___________ 。
(3)某工程师为了从使用过的腐蚀废液(主要含 Fe3+、Fe2+、Cu2+、Cl-)中回收铜,并重新获得纯净的 FeCl3溶液,准备采用图示步骤。

请写出上述过程中①的化学式___________ ,④的化学式___________ 。
Ⅱ.高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓 KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。现某实验小组制备高铁酸钾(K2FeO4)装置如图所示,夹持、加热等装置略。回答下列问题:

(4)仪器a的名称是___________ ,装置 B中除杂质所用试剂是___________ 、装置D的作用是___________ 。
(5)A中发生反应的化学方程式为___________ 。
(6)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为___________ ,反应中 KOH必须过量的原因是___________
(7)C中制备高铁酸钾的反应体系中有六种微粒;Fe3+、Cl2、OH-、FeO 、Cl-、H2O。写出总反应的离子方程式:
、Cl-、H2O。写出总反应的离子方程式:___________ 。C中混合物经过重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。若反应过程中转移了0.6mol电子,则还原产物的物质的量为___________ mol。
Ⅰ.电子工业常用 30%的 FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)Fe 在周期表中的位置是
(2)写出 FeCl3溶液与金属铜发生反应的离子方程式
(3)某工程师为了从使用过的腐蚀废液(主要含 Fe3+、Fe2+、Cu2+、Cl-)中回收铜,并重新获得纯净的 FeCl3溶液,准备采用图示步骤。

请写出上述过程中①的化学式
Ⅱ.高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓 KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。现某实验小组制备高铁酸钾(K2FeO4)装置如图所示,夹持、加热等装置略。回答下列问题:

(4)仪器a的名称是
(5)A中发生反应的化学方程式为
(6)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(7)C中制备高铁酸钾的反应体系中有六种微粒;Fe3+、Cl2、OH-、FeO
 、Cl-、H2O。写出总反应的离子方程式:
、Cl-、H2O。写出总反应的离子方程式:
您最近一年使用:0次



