名校
解题方法
1 . 用锈蚀了的废铁屑(铁锈主要成分是 )为原料制备
)为原料制备 晶体的流程可简要表示如下:
晶体的流程可简要表示如下:
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生的主要反应的离子方程式有:① ;②
;②_______ ;③_______ 。
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液出现白色沉淀,沉淀最终转化为红褐色,写出生成红褐色沉淀的化学方程式_______ 。
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是_______ ,为控制该温度可以采用_______ 进行加热。
(4)“氧化”过程可在如图所示装置中进行。_______
(5)从 溶液制得
溶液制得 晶体的系列操作是蒸发浓缩至有晶膜出现、
晶体的系列操作是蒸发浓缩至有晶膜出现、_______ 、_______ 、洗涤、干燥。
 )为原料制备
)为原料制备 晶体的流程可简要表示如下:
晶体的流程可简要表示如下:
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生的主要反应的离子方程式有:①
 ;②
;②(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液出现白色沉淀,沉淀最终转化为红褐色,写出生成红褐色沉淀的化学方程式
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是
(4)“氧化”过程可在如图所示装置中进行。

(5)从
 溶液制得
溶液制得 晶体的系列操作是蒸发浓缩至有晶膜出现、
晶体的系列操作是蒸发浓缩至有晶膜出现、
您最近一年使用:0次
2022-12-07更新
|
316次组卷
|
4卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题
13-14高三上·浙江杭州·期中
解题方法
2 . 铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
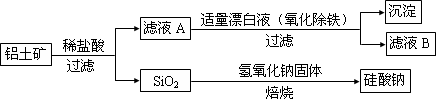
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:______________ (注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为_________ (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
_________ (填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成配平:
_____ Fe2++______ ClO-+____________ =_____ Fe(OH)3↓+_____ C1-+_____________
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为______________ (填代号)。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
④该过程中涉及某氧化还原反应如下,请完成配平:
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为

您最近一年使用:0次
2016-12-09更新
|
853次组卷
|
4卷引用:四川省蓬安县第二中学2019-2020学年高一下学期开学考试化学试题
四川省蓬安县第二中学2019-2020学年高一下学期开学考试化学试题(已下线)2014届浙江省杭州市七校高三上学期期中联考化学试卷(已下线)2015届浙江省温州市十校联合体高三上学期期初联考化学试卷浙江省杭州市七校2017届高三下学期期中联考化学试题
3 . “价类”二维图是学习元素及其化合物的重要工具,如图所示是铁及其化合物的“价类”二维图。
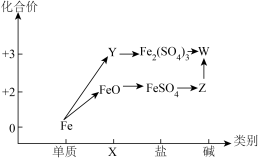
(1)X、Y分别代表_______ 、_______ ;Z在空气中转化为W的化学方程式为_______ 。
(2)某小组研究 性质,预测
性质,预测 能与
能与_______ 发生氧化还原反应(填序号)。
①NaOH溶液②氯水③稀盐酸④酸性 溶液⑤镁⑥碳酸钠
溶液⑤镁⑥碳酸钠
(3)铁盐溶液可用于金属刻蚀。如用 溶液刻蚀铜制电路板,
溶液刻蚀铜制电路板, 被
被_______ (填“还原”或“氧化”)为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(4)为检验食品中的铁元素,可将菠菜剪碎、研磨、溶解、_______ ,然后将少许滤液加入试管中,加入少量稀硝酸(稀硝酸具有氧化性),再滴加几滴KSCN溶液,振荡,若观察到_______ 现象,说明试验样品中含有铁元素。
(5)高铁酸钠是一种能杀菌、脱色、除臭的新型高效水处理剂。工业上可用 氧化
氧化 的方法制备
的方法制备 ,其原理为
,其原理为 ,用双线桥法表示该反应的电子转移方向和数目
,用双线桥法表示该反应的电子转移方向和数目_______ 。

(1)X、Y分别代表
(2)某小组研究
 性质,预测
性质,预测 能与
能与①NaOH溶液②氯水③稀盐酸④酸性
 溶液⑤镁⑥碳酸钠
溶液⑤镁⑥碳酸钠(3)铁盐溶液可用于金属刻蚀。如用
 溶液刻蚀铜制电路板,
溶液刻蚀铜制电路板, 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(4)为检验食品中的铁元素,可将菠菜剪碎、研磨、溶解、
(5)高铁酸钠是一种能杀菌、脱色、除臭的新型高效水处理剂。工业上可用
 氧化
氧化 的方法制备
的方法制备 ,其原理为
,其原理为 ,用双线桥法表示该反应的电子转移方向和数目
,用双线桥法表示该反应的电子转移方向和数目
您最近一年使用:0次
名校
解题方法
4 . 某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。请回答下列问题:
和胆矾晶体。请回答下列问题:
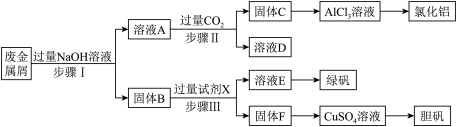
(1)写出步骤I反应的离子方程式__________________________________________________ ;
(2)步骤II中,溶液A中含铝化合物与过量 反应生成固体C的离⼦⽅程式为
反应生成固体C的离⼦⽅程式为____________ ;
(3)在步骤II时,⽤如图装置制取 并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是________ 。

(4)步骤III中试剂X是__________ 。
(5)取步骤III所得溶液E,滴加足量NaOH溶液,观察到的现象为__________ ,产生明显现象的化学方程式为__________ 。
 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。请回答下列问题:
和胆矾晶体。请回答下列问题:
(1)写出步骤I反应的离子方程式
(2)步骤II中,溶液A中含铝化合物与过量
 反应生成固体C的离⼦⽅程式为
反应生成固体C的离⼦⽅程式为(3)在步骤II时,⽤如图装置制取
 并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
(4)步骤III中试剂X是
(5)取步骤III所得溶液E,滴加足量NaOH溶液,观察到的现象为
您最近一年使用:0次
2022-11-24更新
|
300次组卷
|
2卷引用:四川省绵阳市南山中学2022-2023学年高一上学期12月线上测试化学试题
5 . 无水FeCl3常作为反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳、Fe2O3和SiO2杂质)为原料制备无水FeCl3和硅胶。根据信息回答下列问题:
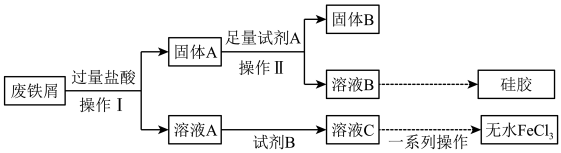
(1)操作I的名称是_______ 。
(2)若向溶液A中加入KSCN溶液无明显现象,则加入过量盐酸时,所发生的反应离子方程式有:Fe+2H+=Fe2+ +H2↑,其还原剂为_______ 。Fe2O3 +6H+=2Fe3++3H2O、_______ 。
(3)加入足量试剂A反应的离子方程式是_______ 。
(4)为避免引入新杂质,试剂B可以选用_______ (填编号)。
a. KMnO4溶液 b.氯水 c.溴水 d. H2O2溶液
(5)简述检验溶液A中阴离子的操作和现象_______ 。
(6)工业上用溶液C腐蚀铜制印刷线路板的化学方程式是_______ 。
(7)医学上也常用FeCl3作凝血剂,请简要叙述其原理_______ 。

(1)操作I的名称是
(2)若向溶液A中加入KSCN溶液无明显现象,则加入过量盐酸时,所发生的反应离子方程式有:Fe+2H+=Fe2+ +H2↑,其还原剂为
(3)加入足量试剂A反应的离子方程式是
(4)为避免引入新杂质,试剂B可以选用
a. KMnO4溶液 b.氯水 c.溴水 d. H2O2溶液
(5)简述检验溶液A中阴离子的操作和现象
(6)工业上用溶液C腐蚀铜制印刷线路板的化学方程式是
(7)医学上也常用FeCl3作凝血剂,请简要叙述其原理
您最近一年使用:0次
解题方法
6 . 用硫铁矿烧渣(主要成分为Fe2O3和少量SiO2)为原料制取绿矾(FeSO4·7H2O),同时对绿矾在高温下的分解产物进行实验探究。
Ⅰ.绿矾制备流程如下:

(1)滤渣的主要化学成分是___________ (填化学式)。
(2)操作①、②、③是同一分离操作,该操作名称为___________ 。
(3)向溶液X中加入过量的铁粉,发生的主要反应的离子方程式为___________ 。
(4)若用含90%氧化铁的硫铁矿烧渣100 t,制得278 t绿矾,该工艺生产绿矾的产率为___________ (保留三位有效数字,产率 )。
)。
Ⅱ.绿矾在高温下的分解产物实验探究
绿矾在加热至高温时会分解,为确定分解产物(已知产物中有SO3气体生成),设计如下实验装置进行了探究:

(5)仪器G的名称为___________ 。
(6)加热前,先通入一段时间氮气的目的是___________ 。
(7)观察到的现象:玻璃直管中有红棕色的固体生成,B中白色固体变蓝,C中溶液褪色,请根据实验现象写出绿矾高温分解的化学方程式___________ 。
Ⅰ.绿矾制备流程如下:

(1)滤渣的主要化学成分是
(2)操作①、②、③是同一分离操作,该操作名称为
(3)向溶液X中加入过量的铁粉,发生的主要反应的离子方程式为
(4)若用含90%氧化铁的硫铁矿烧渣100 t,制得278 t绿矾,该工艺生产绿矾的产率为
 )。
)。Ⅱ.绿矾在高温下的分解产物实验探究
绿矾在加热至高温时会分解,为确定分解产物(已知产物中有SO3气体生成),设计如下实验装置进行了探究:

(5)仪器G的名称为
(6)加热前,先通入一段时间氮气的目的是
(7)观察到的现象:玻璃直管中有红棕色的固体生成,B中白色固体变蓝,C中溶液褪色,请根据实验现象写出绿矾高温分解的化学方程式
您最近一年使用:0次
解题方法
7 . 电池级CoSO4可用于制备CoCO3和CoC2O4等钴盐。一种以粗Co(OH)3渣 含有Fe2O3、SiO2、CuO、CaO、MgO、ZnO等杂质
含有Fe2O3、SiO2、CuO、CaO、MgO、ZnO等杂质 为原料制备电池级CoSO4.7H2O的工艺流程如图所示:
为原料制备电池级CoSO4.7H2O的工艺流程如图所示:

已知:黄钠铁矾 [NaFe3(SO4)2(OH)6]为淡黄色难溶物,是一种过滤性、洗涤性较好的复式硫酸盐。
回答下列问题:
(1)欲提高钴元素的浸出率,可以采取的措施有____________  任写一种
任写一种 。
。
(2)滤渣1的成分是_____________ (填化学式)。
(3)写出“还原浸出”过程中Co(OH)3发生反应的化学方程式:______________ 。
(4)Na2SO3用量、浸出终点pH对钴浸出率的影响分别如图1、图2所示:

则较为适宜的控制条件是______________ 。
(5)“氧化”过程中主要反应的离子方程式为___________ ,为证明加入的NaClO3已足量,可以取适量溶液于洁净的试管,加入_________ 溶液,根据产生的现象进行判断。
(6)常温下,Ksp(CoCO3)=1. 6×10 -13,Ksp(CoC2O4)=6. 3×10-8,向0.01mol/L Na2C2O4溶液中加入足量CoCO3固体能否转化为CoC2O4沉淀:________________  通过计算说明
通过计算说明 。
。
 含有Fe2O3、SiO2、CuO、CaO、MgO、ZnO等杂质
含有Fe2O3、SiO2、CuO、CaO、MgO、ZnO等杂质 为原料制备电池级CoSO4.7H2O的工艺流程如图所示:
为原料制备电池级CoSO4.7H2O的工艺流程如图所示:
已知:黄钠铁矾 [NaFe3(SO4)2(OH)6]为淡黄色难溶物,是一种过滤性、洗涤性较好的复式硫酸盐。
回答下列问题:
(1)欲提高钴元素的浸出率,可以采取的措施有
 任写一种
任写一种 。
。(2)滤渣1的成分是
(3)写出“还原浸出”过程中Co(OH)3发生反应的化学方程式:
(4)Na2SO3用量、浸出终点pH对钴浸出率的影响分别如图1、图2所示:

则较为适宜的控制条件是
(5)“氧化”过程中主要反应的离子方程式为
(6)常温下,Ksp(CoCO3)=1. 6×10 -13,Ksp(CoC2O4)=6. 3×10-8,向0.01mol/L Na2C2O4溶液中加入足量CoCO3固体能否转化为CoC2O4沉淀:
 通过计算说明
通过计算说明 。
。
您最近一年使用:0次
名校
解题方法
8 . 绿矾 是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为
是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为 ,此外还含有少量
,此外还含有少量 ,表面有少量油脂)制取绿矾,并分离出铜,并测定绿砜中的结晶水含量,他们的实验过程如下:
,表面有少量油脂)制取绿矾,并分离出铜,并测定绿砜中的结晶水含量,他们的实验过程如下:
Ⅰ.制备绿矾并分离出铜

(1)加入热碳酸钠溶液的目的是______ 。
(2)针对上述实验过程,某同学提出了以下几种观点,其中错误的是______ (填序号)。
a.溶液A中至少含有3种溶质
b.由于接触空气,混合物C中可能含有
c.操作X用到的仪器可能有玻璃棒、烧杯、分液漏斗等
(3)操作Y包括加热浓缩、冷却结晶、抽滤(减压过滤)等,不采用蒸发结晶的主要原因是______ ,抽滤的优点是______ 。
Ⅱ.测定制得绿矾 中结晶水含量
中结晶水含量
将石英玻璃管(带两端开关 和
和 )(设为装置
)(设为装置 )称重,记为
)称重,记为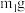 ,将样品装入石英玻璃管中,再次将装置
,将样品装入石英玻璃管中,再次将装置 称重,记为
称重,记为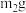 ,按如图连接好装置进行实验。
,按如图连接好装置进行实验。

(4)仪器B的名称为______ 。
(5)将下列实验操作步骤正确排序______ (填标号);重复上述操作步骤,直至A恒重,记为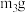 。
。
①启动电加热器,加热②关闭电加热器③冷却到室温④关闭 和
和 ,称量
,称量 ⑤打开
⑤打开 和
和 ,缓缓通入
,缓缓通入
(6)根据实验所得数据计算,
______ (列式表示)。
(7)若加热时,石英管A中产生红色固体,会使 的值
的值______ (填“偏大”、“偏小”或“无影响”,下同);若通过测量加热前后B管的质量变化确定 ,会使其值
,会使其值______ 。
 是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为
是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为 ,此外还含有少量
,此外还含有少量 ,表面有少量油脂)制取绿矾,并分离出铜,并测定绿砜中的结晶水含量,他们的实验过程如下:
,表面有少量油脂)制取绿矾,并分离出铜,并测定绿砜中的结晶水含量,他们的实验过程如下:Ⅰ.制备绿矾并分离出铜

(1)加入热碳酸钠溶液的目的是
(2)针对上述实验过程,某同学提出了以下几种观点,其中错误的是
a.溶液A中至少含有3种溶质
b.由于接触空气,混合物C中可能含有

c.操作X用到的仪器可能有玻璃棒、烧杯、分液漏斗等
(3)操作Y包括加热浓缩、冷却结晶、抽滤(减压过滤)等,不采用蒸发结晶的主要原因是
Ⅱ.测定制得绿矾
 中结晶水含量
中结晶水含量将石英玻璃管(带两端开关
 和
和 )(设为装置
)(设为装置 )称重,记为
)称重,记为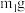 ,将样品装入石英玻璃管中,再次将装置
,将样品装入石英玻璃管中,再次将装置 称重,记为
称重,记为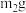 ,按如图连接好装置进行实验。
,按如图连接好装置进行实验。
(4)仪器B的名称为
(5)将下列实验操作步骤正确排序
 。
。①启动电加热器,加热②关闭电加热器③冷却到室温④关闭
 和
和 ,称量
,称量 ⑤打开
⑤打开 和
和 ,缓缓通入
,缓缓通入
(6)根据实验所得数据计算,

(7)若加热时,石英管A中产生红色固体,会使
 的值
的值 ,会使其值
,会使其值
您最近一年使用:0次
名校
解题方法
9 . 工业上以铬铁矿(FeCr2O4,含Al、Si的氧化物等杂质)为主要原料制备红矾钠 (Na2Cr2O7•2H2O)的工艺流程如图所示(已知: )。
)。_______ 。
(2)“焙烧”的目的是将FeCr2O4将转化为Na2CrO4,并产生红棕色固体和无色气体,写出该过程的化学方程式为_______ 。
(3)焙烧中使用的纯碱可用_______ 代替(填物质的名称)。
(4)铁元素在_______ 过程中除去(填操作单元名称)。
(5)“酸化”的目的是_______ 。
(6)“冷却结晶”所得母液中,除Na2Cr2O7外还含有_______ ,该物质在上述流程中可循环利用。
(7)利用膜电解技术(装置如下图),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为: 。
。_______ (填“H2”或“O2”)在同一极室制得。
②电解时每产生3mol气体,通过阳离子交换膜的离子数为_______ 。
 )。
)。
(2)“焙烧”的目的是将FeCr2O4将转化为Na2CrO4,并产生红棕色固体和无色气体,写出该过程的化学方程式为
(3)焙烧中使用的纯碱可用
(4)铁元素在
(5)“酸化”的目的是
(6)“冷却结晶”所得母液中,除Na2Cr2O7外还含有
(7)利用膜电解技术(装置如下图),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:
 。
。
②电解时每产生3mol气体,通过阳离子交换膜的离子数为
您最近一年使用:0次
2024-03-13更新
|
85次组卷
|
2卷引用:四川省绵阳市东辰学校2023-2024学年高二上学期第四次月考化学试题
名校
解题方法
10 . 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如图:

实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。
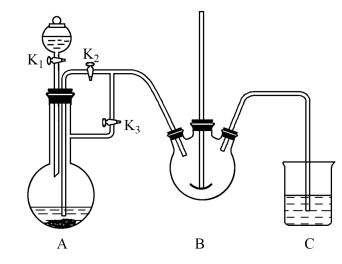
回答下列问题:
(1)配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是___________ 。
(2)装置A用于制备FeSO4,实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭___________ ,打开___________ (填“K1”、“K2”或“K3”);装置B中生成FeCO3的离子方程式为___________ 。
(3)转化过程中温度不超过35℃,主要原因是___________ ;“过滤”环节,不需要使用下列仪器中的___________ (填仪器名称)。

(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为___________ ;检验产品中是否含Fe3+需要的试剂有稀H2SO4和___________ (填化学式)。
(5)取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为___________ %(计算结果取整数)。

实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。

回答下列问题:
(1)配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是
(2)装置A用于制备FeSO4,实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭
(3)转化过程中温度不超过35℃,主要原因是

(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为
(5)取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为
您最近一年使用:0次
2022-03-22更新
|
615次组卷
|
2卷引用:四川省泸县第五中学2023-2024学年高三上学期10月月考理综化学试题



