解题方法
1 . 硫酸锌是制备荧光粉的原料之一。某实验室用炼锌厂的烟道灰(主要成分为:炭粉、ZnO、PbO、FeO、SiO2)制备皓矾(ZnSO4· 7H2O)的流程如下:

已知:ZnSO4易溶于水,难溶于乙醇。请回答下列问题:
(1)下列操作或描述正确的是_________
A.“抽滤洗涤”时,将洗液与溶液I合并,有利于提高皓矾的产率
B.溶液I中含量较高的溶质有ZnSO4、PbSO4、FeSO4、H2SO4
C.重结晶时,需加少量稀盐酸抑制Zn2+水解
D. “洗涤干燥”时,可用95%的酒精作为洗涤剂
(2)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的搡作顺序补充完整:
在布氏漏斗中加入滤纸→_____ →_____→_______→________→确认抽干。__________

①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸
(3)某同学设计了一个实验方案,证明晶体II中的杂质Fe3+含量低于晶体Ⅰ,请把该方案补充完整。_____ (填操作),分别加入2滴稀硝酸和6滴15%KSCN,________ (填现象),证明晶体II中的杂质含量低于晶体I
(4)某同学称取28.700g研细的皓矾晶体(0.100mol),置于坩埚中充分加热、冷却、称量,发现晶体失重13.100g。该同学分析认为,在加热失水过程中还发生副反应,该副反应可能的化学方程式为_____________
(5)将烟道灰在氧气中高温灼烧后,再按上述流程操作,皓矾产率有明显提高,其原因是________

已知:ZnSO4易溶于水,难溶于乙醇。请回答下列问题:
(1)下列操作或描述正确的是
A.“抽滤洗涤”时,将洗液与溶液I合并,有利于提高皓矾的产率
B.溶液I中含量较高的溶质有ZnSO4、PbSO4、FeSO4、H2SO4
C.重结晶时,需加少量稀盐酸抑制Zn2+水解
D. “洗涤干燥”时,可用95%的酒精作为洗涤剂
(2)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的搡作顺序补充完整:
在布氏漏斗中加入滤纸→_____ →_____→_______→________→确认抽干。

①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸
(3)某同学设计了一个实验方案,证明晶体II中的杂质Fe3+含量低于晶体Ⅰ,请把该方案补充完整。
(4)某同学称取28.700g研细的皓矾晶体(0.100mol),置于坩埚中充分加热、冷却、称量,发现晶体失重13.100g。该同学分析认为,在加热失水过程中还发生副反应,该副反应可能的化学方程式为
(5)将烟道灰在氧气中高温灼烧后,再按上述流程操作,皓矾产率有明显提高,其原因是
您最近一年使用:0次
2018-10-02更新
|
401次组卷
|
3卷引用:黑龙江省肇东市第四中学校2020届高三下学期4月月考化学试题
名校
解题方法
2 . 硫酸亚铁晶体( ,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的工业废渣(主要成分为 ,含有少量FeO、
,含有少量FeO、 )为原料生产硫酸亚铁晶体的工艺流程如下。
)为原料生产硫酸亚铁晶体的工艺流程如下。
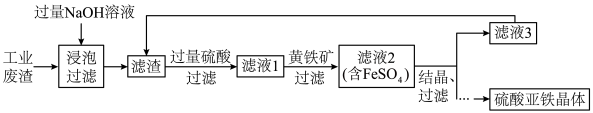
(1)加入过量NaOH溶液进行浸泡时发生反应的离子方程式为________ 。
(2)黄铁矿的主要成分是 ,其作用是
,其作用是________ 。是否可以使用Cu粉替代
________ (填“是”或“否”),解释原因________ 。
(3)为检验加入过量的黄铁矿是否充分起到作用,可以向滤液2中加入的试剂为________ (填化学式),通过________ 现象判断已经充分发挥作用。为灵敏检验滤液2中主要的金属阳离子,选择的试剂为________ (填化学式)。
(4)将滤液3(母液)循环加入滤渣中的目的是________ ,发生反应的离子方程式为________ 。
(5)配制250mL0.2mol/L的 溶液,需称量硫酸亚铁晶体质量为
溶液,需称量硫酸亚铁晶体质量为________ g,下列操作会导致所配溶液浓度偏高的是________ (填字母)。
A.所称取的晶体失去了部分结晶水 B.转移溶液前容量瓶中存在少量蒸馏水
C.定容前未洗涤烧杯和玻璃棒 D.定容时俯视刻度线
(6)产品纯度测定
已知:
取ag硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入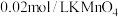 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液bmL。
溶液bmL。 的质量分数是
的质量分数是________ 。
Ⅱ.用制备颜料铵铁蓝
(7) 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀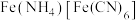 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式:_______
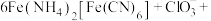 ________
________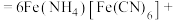 ________+________+________
________+________+________
 ,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的工业废渣(主要成分为
 ,含有少量FeO、
,含有少量FeO、 )为原料生产硫酸亚铁晶体的工艺流程如下。
)为原料生产硫酸亚铁晶体的工艺流程如下。
(1)加入过量NaOH溶液进行浸泡时发生反应的离子方程式为
(2)黄铁矿的主要成分是
 ,其作用是
,其作用是
(3)为检验加入过量的黄铁矿是否充分起到作用,可以向滤液2中加入的试剂为
(4)将滤液3(母液)循环加入滤渣中的目的是
(5)配制250mL0.2mol/L的
 溶液,需称量硫酸亚铁晶体质量为
溶液,需称量硫酸亚铁晶体质量为A.所称取的晶体失去了部分结晶水 B.转移溶液前容量瓶中存在少量蒸馏水
C.定容前未洗涤烧杯和玻璃棒 D.定容时俯视刻度线
(6)产品纯度测定
已知:

取ag硫酸亚铁晶体产品,用稀
 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入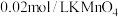 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液bmL。
溶液bmL。 的质量分数是
的质量分数是Ⅱ.用制备颜料铵铁蓝
(7)
 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀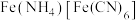 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式: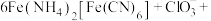 ________
________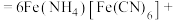 ________+________+________
________+________+________
您最近一年使用:0次
名校
解题方法
3 . I.金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物相关知识回答下列问题:
(1)某溶液中有Mg2+、Fe2+、A13+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___________。
(2)高铁酸钠(Na2FeO4)是一种新型水处理剂。某兴趣小组欲利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取高铁酸钠并回收金属Cu,其工艺流程如下:
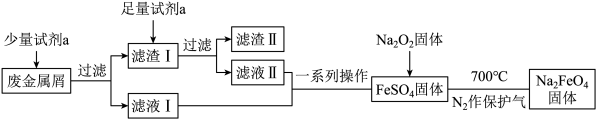
①试剂a为___________ (填化学式,下同),滤渣Ⅱ的主要成分为___________ 。
②在过滤操作中要使用玻璃棒,其作用是___________ 。
③检验滤液I中是否存在Fe3+的试剂是___________ 。
Ⅱ.利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。
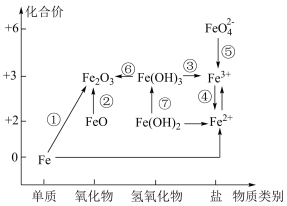
(3)下列说法正确的是___________。
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(5)K2FeO4常用作杀菌消毒剂,生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为___________ 。
(1)某溶液中有Mg2+、Fe2+、A13+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___________。
| A.Mg2+ | B.Fe2+ | C.A13+ | D.Cu2+ |
(2)高铁酸钠(Na2FeO4)是一种新型水处理剂。某兴趣小组欲利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取高铁酸钠并回收金属Cu,其工艺流程如下:

①试剂a为
②在过滤操作中要使用玻璃棒,其作用是
③检验滤液I中是否存在Fe3+的试剂是
Ⅱ.利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。

(3)下列说法正确的是___________。
| A.Fe2O3是碱性氧化物 |
| B.铁与高温水蒸气的反应可实现上述转化① |
| C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化② |
| D.硫酸亚铁片和维生素C(具有还原性)同时服用能增强治疗缺铁性贫血的效果 |
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(5)K2FeO4常用作杀菌消毒剂,生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . 化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为 及少量
及少量 、
、 等)来制取绿矾
等)来制取绿矾 。具体制备流程如下:
。具体制备流程如下:
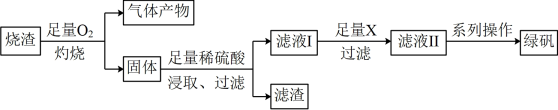
回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为: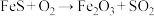 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为___________ ,氧化产物是___________ (填化学式)。
(2)所得气体产物 属于
属于_________ (填“电解质”或“非电解质”)。技术员用氨水对“气体产物”进行吸收后再处理,可以回收 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的离子方程式
时发生反应的离子方程式______ 。
(3)加入足量X时发生反应的离子方程式为:___________ 。
(4)系列操作包括:___________ 、___________ 、过滤、洗涤、干燥。
(5)绿矾保存不当容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中加水溶解,向溶液中加入___________ 溶液(填化学式),发现___________ (填现象),则绿矾已经变质。
 及少量
及少量 、
、 等)来制取绿矾
等)来制取绿矾 。具体制备流程如下:
。具体制备流程如下:
回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为:
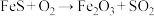 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(2)所得气体产物
 属于
属于 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的离子方程式
时发生反应的离子方程式(3)加入足量X时发生反应的离子方程式为:
(4)系列操作包括:
(5)绿矾保存不当容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中加水溶解,向溶液中加入
您最近一年使用:0次
名校
解题方法
5 . 硫酸亚铁是一种补铁剂,某兴趣小组利用经过初步处理的含有 的废液制备硫酸亚铁晶体的流程如:
的废液制备硫酸亚铁晶体的流程如:
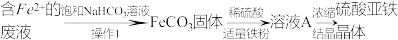
请回答下列问题:
(1)加入饱和 溶液后,得到白色沉淀,则操作1为
溶液后,得到白色沉淀,则操作1为___________ ,若 溶液浓度偏低可能会形成胶体,验证的方法为
溶液浓度偏低可能会形成胶体,验证的方法为___________ (不用写操作和现象)。
(2)加入铁粉的作用是___________ 。
(3)测定废液中 的浓度可使用已知浓度的酸性高锰酸钾溶液。
的浓度可使用已知浓度的酸性高锰酸钾溶液。
①配平化学方程式,并用单线桥法表示电子转移过程:____
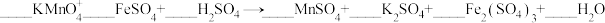
②已知 与
与 按物质的量
按物质的量 的比例恰好完全反应,该反应的离子方程式为
的比例恰好完全反应,该反应的离子方程式为___________ 。
(4)该兴趣小组在研究硫酸亚铁热稳定性时,作出了两种假设:
①假设它按 受热分解的方式分解,反应的化学方程式为
受热分解的方式分解,反应的化学方程式为___________ 。
②假设它按 受热分解的方式分解,已知产物中有两种酸性氧化物生成,则反应的化学方程式为
受热分解的方式分解,已知产物中有两种酸性氧化物生成,则反应的化学方程式为___________ 。
 的废液制备硫酸亚铁晶体的流程如:
的废液制备硫酸亚铁晶体的流程如: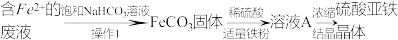
请回答下列问题:
(1)加入饱和
 溶液后,得到白色沉淀,则操作1为
溶液后,得到白色沉淀,则操作1为 溶液浓度偏低可能会形成胶体,验证的方法为
溶液浓度偏低可能会形成胶体,验证的方法为(2)加入铁粉的作用是
(3)测定废液中
 的浓度可使用已知浓度的酸性高锰酸钾溶液。
的浓度可使用已知浓度的酸性高锰酸钾溶液。①配平化学方程式,并用单线桥法表示电子转移过程:
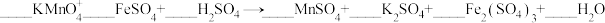
②已知
 与
与 按物质的量
按物质的量 的比例恰好完全反应,该反应的离子方程式为
的比例恰好完全反应,该反应的离子方程式为(4)该兴趣小组在研究硫酸亚铁热稳定性时,作出了两种假设:
①假设它按
 受热分解的方式分解,反应的化学方程式为
受热分解的方式分解,反应的化学方程式为②假设它按
 受热分解的方式分解,已知产物中有两种酸性氧化物生成,则反应的化学方程式为
受热分解的方式分解,已知产物中有两种酸性氧化物生成,则反应的化学方程式为
您最近一年使用:0次
2022-01-01更新
|
206次组卷
|
2卷引用:黑龙江省齐齐哈尔市2021-2022学年高一上学期期末考试化学试题
名校
解题方法
6 . 硫酸亚铁是一种补铁剂,某兴趣小组利用经过初步处理的含有Fe2+的废液制备硫酸亚铁晶体的流程如下:

请回答下列问题:
(1)加入饱和NaHCO3溶液后,得到白色沉淀,则操作1为_______ ,若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为_______ (不用写操作和现象)。
(2)加入铁粉的作用是_______ 。
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。
①配平化学方程式,并用单线桥法表示电子转移过程:_______ 。
_______KMnO4+_______FeSO4+_______H2SO4—_______MnSO4+_______K2SO4+_______Fe2(SO4)3+_______H2O
②已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为_______ 。
(4)该兴趣小组在研究硫酸亚铁热稳定性时,作出了两种假设:
①假设它按CaCO3受热分解的方式分解,反应的化学方程式为_______ 。
②假设它按KClO3受热分解的方式分解,已知产物中有两种酸性氧化物生成,则反应的化学方程式为_______ 。

请回答下列问题:
(1)加入饱和NaHCO3溶液后,得到白色沉淀,则操作1为
(2)加入铁粉的作用是
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。
①配平化学方程式,并用单线桥法表示电子转移过程:
_______KMnO4+_______FeSO4+_______H2SO4—_______MnSO4+_______K2SO4+_______Fe2(SO4)3+_______H2O
②已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为
(4)该兴趣小组在研究硫酸亚铁热稳定性时,作出了两种假设:
①假设它按CaCO3受热分解的方式分解,反应的化学方程式为
②假设它按KClO3受热分解的方式分解,已知产物中有两种酸性氧化物生成,则反应的化学方程式为
您最近一年使用:0次
名校
7 . 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:
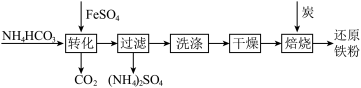
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
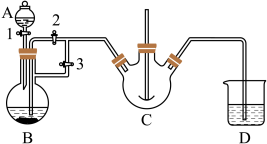
(1)装置A的名称是________ ,装置B中盛放的药品是________ ,NH4HCO3盛放在装置________ 中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是______________ , 发生主要反应的离子方程式为_________ 。FeSO4溶液要现用现配制的原因是_______ ,检验久置的FeSO4是否变质的方法是_________________ 。
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为________ ,取干燥后的FeCO3样品12.49 g,与炭混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________ g。

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。

(1)装置A的名称是
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为
您最近一年使用:0次
2019-12-22更新
|
507次组卷
|
9卷引用:黑龙江省哈尔滨市第六中学2018届高三9月阶段检测化学试题
黑龙江省哈尔滨市第六中学2018届高三9月阶段检测化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题苏教版2017届高三单元精练检测九化学试题福建省莆田第七中学2020届高三上学期期中考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测四川省射洪中学2019-2020学年高一上期期末英才班能力素质监测化学试题河南省洛阳市第一高级中学2020-2021学年高一上学期12月月考化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(工业流程题)北京市海淀区中关村中学2021-2022学年高三上学期10月月考化学试题



