解题方法
1 . 某工厂酸性废液中含有 、
、 、
、 、
、 、
、 ,以该废液为原料制备
,以该废液为原料制备 的工艺流程如下(部分操作和反应条件略):
的工艺流程如下(部分操作和反应条件略):
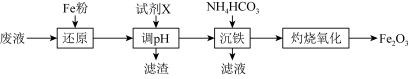
已知:加入试剂X调节pH使 生成沉淀。
生成沉淀。
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_____________ 、_________________ 。
(2)若加入Fe粉过量,取少量调节pH过滤后得到的滤液,加入NaOH溶液的现象为_____________ ,请写出沉淀颜色发生变化的化学方程式:_________________________ 。
(3)“沉铁”过程中有 沉淀和气体生成,写出该反应的离子方程式:
沉淀和气体生成,写出该反应的离子方程式:_________________ ; 在空气中经“灼烧氧化”生成
在空气中经“灼烧氧化”生成 ,试写出“灼烧氧化”的化学方程式:
,试写出“灼烧氧化”的化学方程式:____________________ 。
 、
、 、
、 、
、 、
、 ,以该废液为原料制备
,以该废液为原料制备 的工艺流程如下(部分操作和反应条件略):
的工艺流程如下(部分操作和反应条件略):
已知:加入试剂X调节pH使
 生成沉淀。
生成沉淀。回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:
(2)若加入Fe粉过量,取少量调节pH过滤后得到的滤液,加入NaOH溶液的现象为
(3)“沉铁”过程中有
 沉淀和气体生成,写出该反应的离子方程式:
沉淀和气体生成,写出该反应的离子方程式: 在空气中经“灼烧氧化”生成
在空气中经“灼烧氧化”生成 ,试写出“灼烧氧化”的化学方程式:
,试写出“灼烧氧化”的化学方程式:
您最近一年使用:0次
名校
2 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2(难溶于稀硫酸)、Al2O3等,用硫酸渣制备铁红(Fe2O3)的过程如图,回答下列问题: 还有
还有___________ (填离子符号),写出Fe2O3与稀硫酸反应的离子方程式:___________ 。
(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:___________ 。
(4)“氧化”时,可观察到的实验现象为___________ 。若加入的NaOH溶液过量,则“滤液B”中的溶质除了NaOH外,还含有___________ ;若加入的NaOH溶液不足,则制得的铁红中含有的杂质为___________ (填化学式)。

 还有
还有(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:
(4)“氧化”时,可观察到的实验现象为
您最近一年使用:0次
2022-05-06更新
|
808次组卷
|
15卷引用:安徽省宣城中学2021-2022学年高一下学期期中考试化学试题
安徽省宣城中学2021-2022学年高一下学期期中考试化学试题安徽省滁州市定远县育才学校2021-2022学年高一下学期5月月考化学试题山西省吕梁市2021-2022学年高一上学期期末考试化学试题河北省秦皇岛市2021-2022学年高一上学期期末统一考试化学试题河北省廊坊市2021-2022学年高一上学期期末统一考试化学试题湖南省怀化市沅陵县第一中学2021-2022学年高一下学期期中考试化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)湖南省长沙市实验中学2021-2022学年高一下学期入学考试化学试题湖南省衡阳市祁东县2021-2022学年高一上学期期末考试化学试题湖北省襄阳市第四中学2021-2022学年高一下学期2月考试化学试题云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题湖南省株洲市九方中学2022-2023学年高三上学期第四次月考化学试题湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题河北省秦皇岛市青龙满族自治县实验中学2022-2023学年高一上学期期末考试化学试题广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题
名校
3 . 镁单质及其化合物在电池制造储氢及大气治理等方面用途十分广泛。以硼镁泥(主要成分为 、
、 及少量
及少量 、
、 和
和 )为原料制备
)为原料制备 晶体的流程如下:
晶体的流程如下:

已知:常温下此体系中各氢氧化物开始沉淀与沉淀完全时的 如下表所示:
如下表所示:
请回答下列问题:
(1)“浸取”时, 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为___________ 。
(2)“氧化”步骤中工业上常用 代替
代替 ,除
,除 成本高外,还可能的原因是
成本高外,还可能的原因是___________ 。
(3)“除铁、铝”时,需调节溶液 范围为
范围为________ ,加热煮沸的目的是_______ 。
(4)“除 ”步骤中发生反应的离子方程式为
”步骤中发生反应的离子方程式为___________ ;要从 粗品中得到纯度更高的
粗品中得到纯度更高的 晶体,可通过
晶体,可通过___________ 的方法提纯。
(5)一种镁锂双离子二次电池装置如图所示

①放电时,迁移至正极区的离子是___________ 。
②充电时,阳极的电极反应式为___________ 。
 、
、 及少量
及少量 、
、 和
和 )为原料制备
)为原料制备 晶体的流程如下:
晶体的流程如下:
已知:常温下此体系中各氢氧化物开始沉淀与沉淀完全时的
 如下表所示:
如下表所示: 值 值 |  |  | 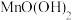 |  |  |  |
| 开始沉淀时 |  | 7.0 |  | 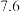 | 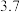 |  |
| 沉淀完全时 |  |  |  |  |  | 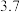 |
(1)“浸取”时,
 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为(2)“氧化”步骤中工业上常用
 代替
代替 ,除
,除 成本高外,还可能的原因是
成本高外,还可能的原因是(3)“除铁、铝”时,需调节溶液
 范围为
范围为(4)“除
 ”步骤中发生反应的离子方程式为
”步骤中发生反应的离子方程式为 粗品中得到纯度更高的
粗品中得到纯度更高的 晶体,可通过
晶体,可通过(5)一种镁锂双离子二次电池装置如图所示

①放电时,迁移至正极区的离子是
②充电时,阳极的电极反应式为
您最近一年使用:0次
名校
4 . 设定下图所示装置中的反应是完全进行的:
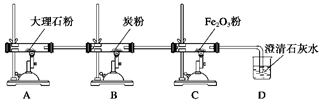
(1)分别写出A、B、C装置中的化学反应方程式:_______________________________________ ;
(2)若D装置中的澄清石灰水是少量的,将可能观察到的现象:___________________ ;用化学方程式解释上述现象:_____________________________________________ 。

(1)分别写出A、B、C装置中的化学反应方程式:
(2)若D装置中的澄清石灰水是少量的,将可能观察到的现象:
您最近一年使用:0次
名校
5 . 钛被称为“二十一世纪的金属”,绿矾是重要的化工原料,用钛铁矿[主要成分是钛酸亚铁(FeTiO3),含少量Fc2O3、MgO,SiO2等杂质]作原料生产金属钛和绿矾(FeSO4⋅7H2O)等产品的一种工艺流程如下:
请回答下列问题:
(1)硫酸与FeTiO3反应生成TioSO4的化学方程式是_______ 。向滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性。已知:氧化性: ,则加入适量铁粉的原因是
,则加入适量铁粉的原因是_______ 。
(2)系列操作具体为_______ ,经系列操作后,再对所得到的绿矾晶体用75%的乙醇溶液洗涤,用乙醇溶液洗涤绿矾的优点为_______ 。
(3)滤液2中加入适量的试剂A,A可选用_______ (填标号)。
a.稀硫酸 b.碳酸镁 c.二氧化碳 d.鼓入空气
(4)用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。
写出阴极区反应的电极总反应式:_______ 。

请回答下列问题:
(1)硫酸与FeTiO3反应生成TioSO4的化学方程式是
 ,则加入适量铁粉的原因是
,则加入适量铁粉的原因是(2)系列操作具体为
(3)滤液2中加入适量的试剂A,A可选用
a.稀硫酸 b.碳酸镁 c.二氧化碳 d.鼓入空气
(4)用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。
写出阴极区反应的电极总反应式:

您最近一年使用:0次
名校
6 . 以含 铁废渣(主要成分为
铁废渣(主要成分为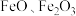 ,还含有
,还含有 等杂质)为原料制备
等杂质)为原料制备 的一种实验流程如图所示,下列说法正确的是
的一种实验流程如图所示,下列说法正确的是
 铁废渣(主要成分为
铁废渣(主要成分为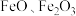 ,还含有
,还含有 等杂质)为原料制备
等杂质)为原料制备 的一种实验流程如图所示,下列说法正确的是
的一种实验流程如图所示,下列说法正确的是

A.含铁废渣中的 为红棕色,称为磁性氧化铁 为红棕色,称为磁性氧化铁 |
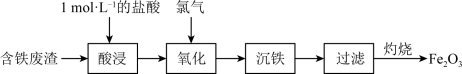
B.通过图甲所示操作配制“酸浸”所需的 的盐酸 的盐酸 |
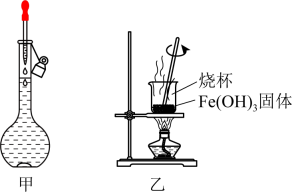
C.用装置乙灼烧 固体制 固体制 |
D.若制取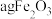 ,则含铁废渣中铁元素的质量分数为 ,则含铁废渣中铁元素的质量分数为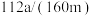 |
您最近一年使用:0次
2022-12-12更新
|
306次组卷
|
2卷引用:安徽省当涂第一中学2022-2023学年高一上学期第二次月考化学试题
名校
解题方法
7 . VO2是制备智能控温薄膜的重要材料。一种以钒渣(主要成分是FeV2O4、MnV2O4、Fe2SiO4等)为原料制备VO2的工艺流程如图:

已知:①FeV2O4中铁为+2价, 具有强氧化性;
具有强氧化性;
②室温条件,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:.
(1)“焙烧1”中FeV2O4转化为Mg2V2O7和Fe2O3的化学方程式为_______ 。
(2)“酸浸”所得浸出液中除含有 、Mn2+外,还含有的金属阳离子有
、Mn2+外,还含有的金属阳离子有_______ 。
(3)“沉钒”所得滤液中Mg2+浓度为0.24g/L,加入氨水,可分离Mn2+、Mg2+。 为尽可能多地将Mn2+转化为Mn(OH)2,并避免Mg2+沉淀,应控制pH=_______ ; 分离Mn(OH)2沉淀后的溶液继续加氨沉淀除镁后,溶液中的溶质可再生循环到_______ 步骤使用。
(4)“沉钒”得到NH4VO3沉淀,在实验室中用如图装置过滤:
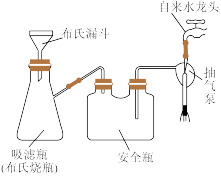
操作时要旋开自来水龙头,其目的是_______ ;洗涤NH4VO3的操作是_______ 。
(5)“高温还原”时C6H12O6转化为CO2和H2O,则理论上180g还原剂能高温还原得到产品_______ g。

已知:①FeV2O4中铁为+2价,
 具有强氧化性;
具有强氧化性;②室温条件,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:.
| 金属离子 | Fe3+ | Mn2+ | Mg2+ |
| 开始沉淀时(c=0.1mol·L-1 )的pH | 1.9 | 8.1 | 8.9 |
| 沉淀完全时(c=1.0 ×10 -5mol·L-1)的pH | 3.2 | 10.1 | 10.9 |
(2)“酸浸”所得浸出液中除含有
 、Mn2+外,还含有的金属阳离子有
、Mn2+外,还含有的金属阳离子有(3)“沉钒”所得滤液中Mg2+浓度为0.24g/L,加入氨水,可分离Mn2+、Mg2+。 为尽可能多地将Mn2+转化为Mn(OH)2,并避免Mg2+沉淀,应控制pH=
(4)“沉钒”得到NH4VO3沉淀,在实验室中用如图装置过滤:

操作时要旋开自来水龙头,其目的是
(5)“高温还原”时C6H12O6转化为CO2和H2O,则理论上180g还原剂能高温还原得到产品
您最近一年使用:0次
8 . 铁是人类较早使用的金属之一,运用所学知识,回答下列问题。
Ⅰ.电子工业常用 的
的 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出 溶液与金属铜发生反应的离子方程式
溶液与金属铜发生反应的离子方程式___________ 。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得 溶液,准备采用下列步骤:
溶液,准备采用下列步骤:
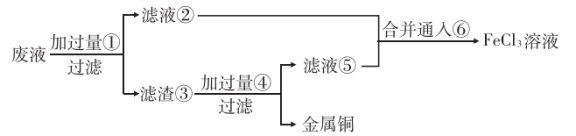
请写出上述过程中滤渣③中所含成分的化学式___________ ,物质⑥的化学式___________ 。
Ⅱ.已知 易吸收空气里的水分而潮解,
易吸收空气里的水分而潮解, 左右时易升华,实验室制备
左右时易升华,实验室制备 的装置如图所示。
的装置如图所示。
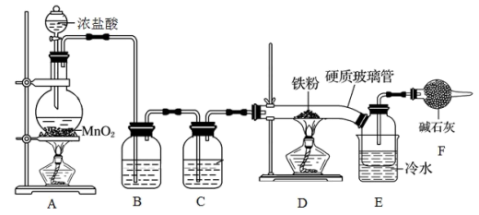
回答下列问题:
(3)装置 中发生反应的化学方程式为
中发生反应的化学方程式为___________ 。
(4)装置 中溶液为
中溶液为___________ , 的作用是
的作用是___________ 。
(5)用粗硬质玻璃管直接连接装置 和
和 ,比用细导管连接的优点是
,比用细导管连接的优点是___________ 。
(6)装置 中碱石灰的成分是
中碱石灰的成分是 和
和 的混合物,其作用是防止空气中水蒸气进入装置
的混合物,其作用是防止空气中水蒸气进入装置 造成
造成 潮解,同时还有的作用
潮解,同时还有的作用___________ 。
Ⅰ.电子工业常用
 的
的 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。(1)写出
 溶液与金属铜发生反应的离子方程式
溶液与金属铜发生反应的离子方程式(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得
 溶液,准备采用下列步骤:
溶液,准备采用下列步骤:
请写出上述过程中滤渣③中所含成分的化学式
Ⅱ.已知
 易吸收空气里的水分而潮解,
易吸收空气里的水分而潮解, 左右时易升华,实验室制备
左右时易升华,实验室制备 的装置如图所示。
的装置如图所示。
回答下列问题:
(3)装置
 中发生反应的化学方程式为
中发生反应的化学方程式为(4)装置
 中溶液为
中溶液为 的作用是
的作用是(5)用粗硬质玻璃管直接连接装置
 和
和 ,比用细导管连接的优点是
,比用细导管连接的优点是(6)装置
 中碱石灰的成分是
中碱石灰的成分是 和
和 的混合物,其作用是防止空气中水蒸气进入装置
的混合物,其作用是防止空气中水蒸气进入装置 造成
造成 潮解,同时还有的作用
潮解,同时还有的作用
您最近一年使用:0次
名校
9 . 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:
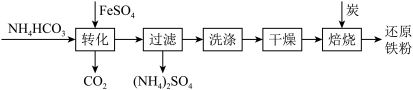
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节获得FeCO3。
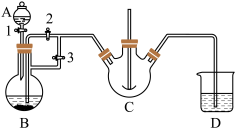
(1)NH4HCO3盛放在装置___________ 中(填仪器名称)。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是___________ 。发生主要反应的离子方程式为___________ 。检验久置的FeSO4是否变质的方法是___________ 。
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为___________ ,取干燥后的FeCO3样品12.49g,与炭混合后焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量:___________ g。

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节获得FeCO3。

(1)NH4HCO3盛放在装置
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为
您最近一年使用:0次
2021-10-19更新
|
109次组卷
|
2卷引用:安徽省舒城中学2021-2022学年高二上学期第二次月考化学试题
10 . 以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4∙xH2O)的工艺流程如下:
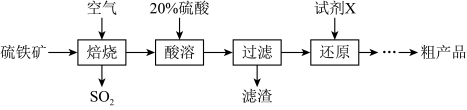
(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____ 。
(2)写出酸溶过程主要反应的离子方程式____ 。
(3)试剂X是(写化学式)____ 。
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4∙xH2O)的操作是____
(5)利用如图装置测定FeSO4∙xH2O中结晶水含量:
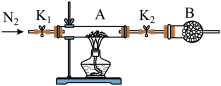
实验前通入N2,的主要目的是____ ,装置B中盛放的试剂是____ 。

(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式
(2)写出酸溶过程主要反应的离子方程式
(3)试剂X是(写化学式)
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4∙xH2O)的操作是
(5)利用如图装置测定FeSO4∙xH2O中结晶水含量:

实验前通入N2,的主要目的是
您最近一年使用:0次



