名校
解题方法
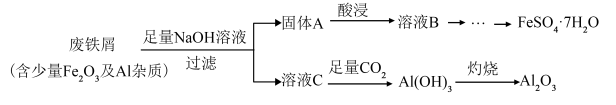
1 . Ⅰ.某化学兴趣小组利用某工业废铁屑制备食品添加剂FeSO4·7H2O,流程图如下___________ (填写化学式);
(2)“酸浸”时需加入试剂的化学式为___________ ,请写出该过程中属于非氧化还原反应的离子方程式___________ ;
(3)溶液C→Al(OH)3的离子方程式是___________ ;
(4)“灼烧”操作应选择下列哪一种仪器___________(填序号)
Ⅱ.高锰酸钾溶液常用于物质的定性检验与定量分析。
(5)现用其测定某补血剂片中亚铁的含量:称取含 (式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式:
(式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式: ___________ ;
(6)甲同学四次实验消耗的KMnO4溶液体积数据如下
根据甲同学的实验数据,该补血剂中 的质量分数为
的质量分数为___________ (用a表示)。
(7)补铁剂使用时建议与维生素C同服,乙同学猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?回答并说明理由:___________ 。
(2)“酸浸”时需加入试剂的化学式为
(3)溶液C→Al(OH)3的离子方程式是
(4)“灼烧”操作应选择下列哪一种仪器___________(填序号)
A.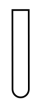 | B.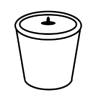 | C.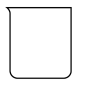 | D. |
Ⅱ.高锰酸钾溶液常用于物质的定性检验与定量分析。
(5)现用其测定某补血剂片中亚铁的含量:称取含
 (式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式:
(式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式: (6)甲同学四次实验消耗的KMnO4溶液体积数据如下
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V(KMnO4液)/mL | 24.98 | 25.02 | 25.00 | 20.00 |
 的质量分数为
的质量分数为(7)补铁剂使用时建议与维生素C同服,乙同学猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
您最近一年使用:0次
2023-12-30更新
|
227次组卷
|
3卷引用:广西钦州市第四中学2023-2024学年高一上学期11月考试化学试卷
解题方法
2 . 以废铁屑含Fe2O3、FeS、SiO2等杂质)为原料制备硫酸亚铁晶体的流程如图所示:
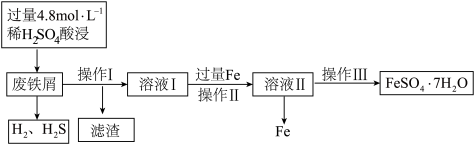
(1)实验室需要75mL该硫酸,用质量分数为98%、密度为1.84g•cm-3的浓硫酸进行配制,需要用到的玻璃仪器有烧杯、玻璃棒、量筒和_____ (填仪器名称)。
(2)“滤渣”的主要成分是_____ (填化学式),“溶液I”中的阳离子是_____ (填离子符号)。
(3)写出流程中生成H2S的反应的化学方程式:_____ 。
(4)“操作Ⅲ”的过程是蒸发浓缩、_____ 、过滤、洗涤、干燥,检验“溶液Ⅱ”中不存在Fe3+的试剂是_____ 。
(5)测定产品中FeSO4•7H2O(摩尔质量为278g•mol-1)的含量:取mg产品溶解于蒸馏水中,配置成100mL溶液,取25.00mL该溶液于锥形瓶中,用cmol•L-1KMnO4溶液(先用稀硫酸酸化)滴定,重复滴定3次,消耗KMnO4溶液的平均体积为VmL。
①KMnO4溶液应盛装在_____ (填“酸式”或“碱式”)滴定管中。
②达到滴定终点时的现象为_____ 。
③产品中FeSO4•7H2O的含量为_____ (用含m、c、V的式子表示)%。

(1)实验室需要75mL该硫酸,用质量分数为98%、密度为1.84g•cm-3的浓硫酸进行配制,需要用到的玻璃仪器有烧杯、玻璃棒、量筒和
(2)“滤渣”的主要成分是
(3)写出流程中生成H2S的反应的化学方程式:
(4)“操作Ⅲ”的过程是蒸发浓缩、
(5)测定产品中FeSO4•7H2O(摩尔质量为278g•mol-1)的含量:取mg产品溶解于蒸馏水中,配置成100mL溶液,取25.00mL该溶液于锥形瓶中,用cmol•L-1KMnO4溶液(先用稀硫酸酸化)滴定,重复滴定3次,消耗KMnO4溶液的平均体积为VmL。
①KMnO4溶液应盛装在
②达到滴定终点时的现象为
③产品中FeSO4•7H2O的含量为
您最近一年使用:0次
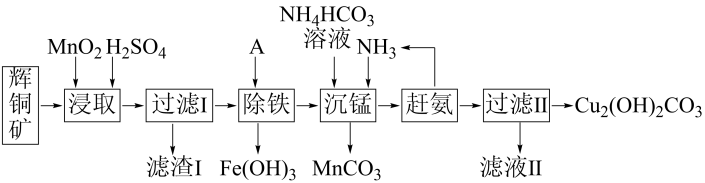
3 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
已知:常温下几种离子沉淀时的pH如下表(当离子浓度≤1.0×10-5mol·L-1时完全沉淀)
(1)下列措施不能加快浸取速率的是___________。(填字母)
(2)滤渣I的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:___________ 。
(3)研究表明矿物中Fe2O3在“浸取”反应中起着重要的媒介作用,促进Cu2S与MnO2的溶解,其反应过程如下:
①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②Cu2S+2Fe2(SO4)3=2CuSO4+4FeSO4+S↓
③___________ (写出反应的化学方程式)。
Fe2O3可明显加快“浸取”的速率,可能的原因是___________ 。
(4)①常温“除铁”的方法是通过加入试剂A调节溶液的pH,使Fe3+转化为Fe(OH)3,则试剂A最好是___________ 。
A.氨水 B.Cu C.CuO D.CuCl2
②“除铁”时调节溶液pH的适宜范围为___________ ,Fe(OH)3的Ksp为___________ 。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为___________ 。
(6)从滤液Ⅱ获得(NH4)2SO4晶体,当观察到___________ 现象时,即可停止加热。

已知:常温下几种离子沉淀时的pH如下表(当离子浓度≤1.0×10-5mol·L-1时完全沉淀)
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.0 | 4.7 | 8.3 |
| 完全沉淀pH | 9.0 | 3.0 | 6.7 | 9.8 |
(1)下列措施不能加快浸取速率的是___________。(填字母)
| A.将辉铜矿粉碎 | B.延长浸取时间 | C.充分搅拌 | D.适当增大硫酸浓度 |
(3)研究表明矿物中Fe2O3在“浸取”反应中起着重要的媒介作用,促进Cu2S与MnO2的溶解,其反应过程如下:
①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②Cu2S+2Fe2(SO4)3=2CuSO4+4FeSO4+S↓
③
Fe2O3可明显加快“浸取”的速率,可能的原因是
(4)①常温“除铁”的方法是通过加入试剂A调节溶液的pH,使Fe3+转化为Fe(OH)3,则试剂A最好是
A.氨水 B.Cu C.CuO D.CuCl2
②“除铁”时调节溶液pH的适宜范围为
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为
(6)从滤液Ⅱ获得(NH4)2SO4晶体,当观察到
您最近一年使用:0次
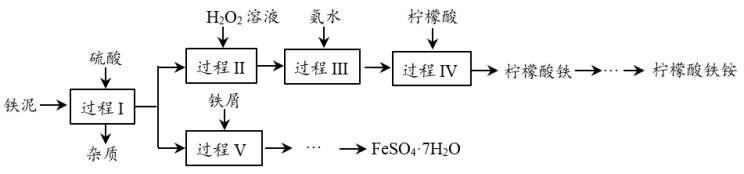
4 . 铁泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(FeSO4·7H2O)或柠檬酸铁铵。
①Fe2O3与硫酸反应的离子方程式为________ 。
②分离出杂质的操作是________ 。
(2)制备柠檬酸铁铵
①补全过程II中发生反应的离子方程式:________ 。
(1) +(1)H++(1)H2O2=(1)Fe3++(1) 。
②过程III中,加入氨水后,可观察到的现象为________ 。
(3)制备FeSO4·7H2O
①过程V中,用离子方程式说明加入铁屑的主要目的是________ 。
②过程I中加入400mL1.5mol·L-1硫酸至固体不再溶解,则经过程V反应后所得溶液中Fe2+的物质的量最多为________ mol。
①Fe2O3与硫酸反应的离子方程式为
②分离出杂质的操作是
(2)制备柠檬酸铁铵
①补全过程II中发生反应的离子方程式:
(1) +(1)H++(1)H2O2=(1)Fe3++(1) 。
②过程III中,加入氨水后,可观察到的现象为
(3)制备FeSO4·7H2O
①过程V中,用离子方程式说明加入铁屑的主要目的是
②过程I中加入400mL1.5mol·L-1硫酸至固体不再溶解,则经过程V反应后所得溶液中Fe2+的物质的量最多为
您最近一年使用:0次
2022-01-14更新
|
410次组卷
|
2卷引用:广西柳州高级中学2023-2024学年高一上学期寒假月考化学试卷3



