名校
1 . 硝酸铁和亚硫酸钠在生产中应用广泛, 具有较强的氧化性,易溶于水,微溶于浓硝酸;
具有较强的氧化性,易溶于水,微溶于浓硝酸; 在空气中容易氧化变质。学习小组欲探究硝酸铁与亚硫酸钠的反应,进行相关实验。回答下列问题:
在空气中容易氧化变质。学习小组欲探究硝酸铁与亚硫酸钠的反应,进行相关实验。回答下列问题:
(1)Fe、N、O、Na、S五种元素中,电负性最大的是___________ (填元素符号)。
(2)制备100mL 0.1mol/L的 溶液:
溶液:
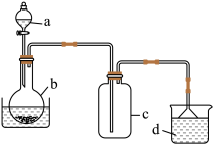
①用如图所示装置制备 溶液:用电子天平称取
溶液:用电子天平称取___________ g(保留2位有效数字)铁粉,加入b中,向a中加入5mL 12.4mol/L的硝酸(浓硝酸)溶液,将a中溶液全部滴入b中,然后关闭活塞,水浴温度保持70℃左右。b中观察到的现象是___________ ,控制水温不宜过高或过低的目的是___________ 。
②待b中无固体剩余后,冷却至室温,将溶液稀释到100mL即可得到0.1mol/L的 溶液。下列仪器中,稀释过程不需要用到的有
溶液。下列仪器中,稀释过程不需要用到的有___________ (填选项字母)。测得0.1mol/L的 溶液pH=1.26。
溶液pH=1.26。

③室温下,取10mL②中所配溶液,稀释至100mL,测得pH=1.87,解释溶液稀释10倍,pH增大不到1的原因:___________ 。
(3)探究上述硝酸铁溶液与亚硫酸钠的反应:
①验证 是否氧化变质:取少量
是否氧化变质:取少量 粉末,配制成溶液,加入足量稀盐酸,再加入
粉末,配制成溶液,加入足量稀盐酸,再加入 溶液,无沉淀生成,结论:
溶液,无沉淀生成,结论:___________ 。
②常温下,取5mL制备的0.1mol/L 溶液,一边缓慢加入。上述
溶液,一边缓慢加入。上述 粉末,一边振荡(忽略溶液体积变化,实验过程确保硝酸铁溶液足量),再加入
粉末,一边振荡(忽略溶液体积变化,实验过程确保硝酸铁溶液足量),再加入 溶液,产生不溶于硝酸的白色沉淀。
溶液,产生不溶于硝酸的白色沉淀。
甲认为是 氧化
氧化 ,乙认为是过量的
,乙认为是过量的 氧化
氧化 。
。
为验证 溶液被
溶液被 溶液氧化的原因,仅通过通入HCl气体或加入NaOH固体改变
溶液氧化的原因,仅通过通入HCl气体或加入NaOH固体改变 溶液的pH(
溶液的pH( 和
和 对反应无影响,忽略溶液体积变化),重复上述实验,同时用pH计监测溶液pH变化过程,结果如下表所示:
对反应无影响,忽略溶液体积变化),重复上述实验,同时用pH计监测溶液pH变化过程,结果如下表所示:
据此分析 溶液不同pH值时被
溶液不同pH值时被 溶液氧化的原因:
溶液氧化的原因:___________ 。
(4)含铁盐应用广泛,写出一种含铁盐的化学式并写出该盐的一种用途:___________ 。
 具有较强的氧化性,易溶于水,微溶于浓硝酸;
具有较强的氧化性,易溶于水,微溶于浓硝酸; 在空气中容易氧化变质。学习小组欲探究硝酸铁与亚硫酸钠的反应,进行相关实验。回答下列问题:
在空气中容易氧化变质。学习小组欲探究硝酸铁与亚硫酸钠的反应,进行相关实验。回答下列问题:(1)Fe、N、O、Na、S五种元素中,电负性最大的是
(2)制备100mL 0.1mol/L的
 溶液:
溶液:
①用如图所示装置制备
 溶液:用电子天平称取
溶液:用电子天平称取②待b中无固体剩余后,冷却至室温,将溶液稀释到100mL即可得到0.1mol/L的
 溶液。下列仪器中,稀释过程不需要用到的有
溶液。下列仪器中,稀释过程不需要用到的有 溶液pH=1.26。
溶液pH=1.26。
③室温下,取10mL②中所配溶液,稀释至100mL,测得pH=1.87,解释溶液稀释10倍,pH增大不到1的原因:
(3)探究上述硝酸铁溶液与亚硫酸钠的反应:
①验证
 是否氧化变质:取少量
是否氧化变质:取少量 粉末,配制成溶液,加入足量稀盐酸,再加入
粉末,配制成溶液,加入足量稀盐酸,再加入 溶液,无沉淀生成,结论:
溶液,无沉淀生成,结论:②常温下,取5mL制备的0.1mol/L
 溶液,一边缓慢加入。上述
溶液,一边缓慢加入。上述 粉末,一边振荡(忽略溶液体积变化,实验过程确保硝酸铁溶液足量),再加入
粉末,一边振荡(忽略溶液体积变化,实验过程确保硝酸铁溶液足量),再加入 溶液,产生不溶于硝酸的白色沉淀。
溶液,产生不溶于硝酸的白色沉淀。甲认为是
 氧化
氧化 ,乙认为是过量的
,乙认为是过量的 氧化
氧化 。
。为验证
 溶液被
溶液被 溶液氧化的原因,仅通过通入HCl气体或加入NaOH固体改变
溶液氧化的原因,仅通过通入HCl气体或加入NaOH固体改变 溶液的pH(
溶液的pH( 和
和 对反应无影响,忽略溶液体积变化),重复上述实验,同时用pH计监测溶液pH变化过程,结果如下表所示:
对反应无影响,忽略溶液体积变化),重复上述实验,同时用pH计监测溶液pH变化过程,结果如下表所示: 溶液的pH 溶液的pH | 现象、分析及pH变化 |
| 1.87 | 产生白色沉淀,说明 被氧化;pH逐渐减小,减小至pH=1.52左右维持不变 被氧化;pH逐渐减小,减小至pH=1.52左右维持不变 |
| 1.52 | 产生白色沉淀,说明 被氧化;pH维持1.52不变 被氧化;pH维持1.52不变 |
| 1.26 | 产生白色沉淀,说明 被氧化;pH逐渐增大,增大至pH=1.52左右维持不变 被氧化;pH逐渐增大,增大至pH=1.52左右维持不变 |
 溶液不同pH值时被
溶液不同pH值时被 溶液氧化的原因:
溶液氧化的原因:(4)含铁盐应用广泛,写出一种含铁盐的化学式并写出该盐的一种用途:
您最近一年使用:0次
2022-10-01更新
|
183次组卷
|
2卷引用:山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题
解题方法
2 . 某化学兴趣小组利用废铁屑(含少量 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
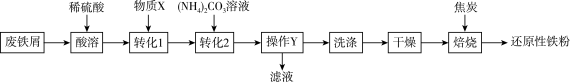
请回答下列问题:
(1)“酸溶”时,搅拌的目的是___________ 。
(2)“操作Y”为___________ (填操作名称),经过“操作Y”得到了滤渣 ,则物质X可除去过量的稀硫酸和防止
,则物质X可除去过量的稀硫酸和防止 被氧化最好为
被氧化最好为___________ 。“转化2”发生反应的离子方程式为___________ 。
(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为___________ 。
(4)麦片中常添加微量还原性铁粉,用于补充人体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为___________ ;人体补铁时,同时服用维生素C能促进亚铁离子被吸收,说明维生素C具有___________ (填“氧化性”或“还原性”)。
 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
请回答下列问题:
(1)“酸溶”时,搅拌的目的是
(2)“操作Y”为
 ,则物质X可除去过量的稀硫酸和防止
,则物质X可除去过量的稀硫酸和防止 被氧化最好为
被氧化最好为(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为
(4)麦片中常添加微量还原性铁粉,用于补充人体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为
您最近一年使用:0次
3 . I.电子工业常用FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某电子厂用过的腐蚀液中含有Fe3+、Cu2+,可以通过下列流程回收铜,并重新获得FeCl3溶液。

(1)检验溶液中是否含有Fe3+常用的试剂是____ ,FeCl3与Cu反应的化学方程式是_____ 。
(2)操作①是____ ,固体C的成分是____ 。
(3)Fe3+与A反应的离子方程式是____ ,B与E反应的离子方程式是____ 。
II.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6mol/L硫酸溶液,其他试剂任选。

(4)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_____ ,A中反应的离子方程式为_____ 。
(5)实验开始时应先将活塞E_____ (填“打开”或“关闭”),其目的是_____ 。
(6)拔去装置B中的橡皮塞,使空气进入,看到的现象为_____ ;写出有关反应的化学方程式_____ 。

(1)检验溶液中是否含有Fe3+常用的试剂是
(2)操作①是
(3)Fe3+与A反应的离子方程式是
II.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6mol/L硫酸溶液,其他试剂任选。

(4)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是
(5)实验开始时应先将活塞E
(6)拔去装置B中的橡皮塞,使空气进入,看到的现象为
您最近一年使用:0次
名校
4 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2(难溶于稀硫酸)、Al2O3等,用硫酸渣制备铁红(Fe2O3)的过程如图,回答下列问题: 还有
还有___________ (填离子符号),写出Fe2O3与稀硫酸反应的离子方程式:___________ 。
(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:___________ 。
(4)“氧化”时,可观察到的实验现象为___________ 。若加入的NaOH溶液过量,则“滤液B”中的溶质除了NaOH外,还含有___________ ;若加入的NaOH溶液不足,则制得的铁红中含有的杂质为___________ (填化学式)。

 还有
还有(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:
(4)“氧化”时,可观察到的实验现象为
您最近一年使用:0次
2022-05-06更新
|
808次组卷
|
15卷引用:山西省吕梁市2021-2022学年高一上学期期末考试化学试题
山西省吕梁市2021-2022学年高一上学期期末考试化学试题河北省秦皇岛市2021-2022学年高一上学期期末统一考试化学试题河北省廊坊市2021-2022学年高一上学期期末统一考试化学试题湖南省怀化市沅陵县第一中学2021-2022学年高一下学期期中考试化学试题安徽省宣城中学2021-2022学年高一下学期期中考试化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)湖南省长沙市实验中学2021-2022学年高一下学期入学考试化学试题湖南省衡阳市祁东县2021-2022学年高一上学期期末考试化学试题安徽省滁州市定远县育才学校2021-2022学年高一下学期5月月考化学试题湖北省襄阳市第四中学2021-2022学年高一下学期2月考试化学试题云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题湖南省株洲市九方中学2022-2023学年高三上学期第四次月考化学试题湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题河北省秦皇岛市青龙满族自治县实验中学2022-2023学年高一上学期期末考试化学试题广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题
5 . 高铁酸钾( )为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备
)为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
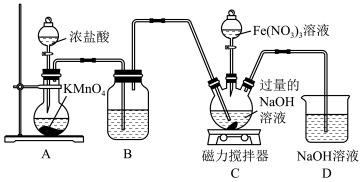
(1)装置A为 的发生装置,写出发生反应的离子方程式:
的发生装置,写出发生反应的离子方程式:_______ 。
(2)装置B中盛装的液体是_______ ,其作用为_______ 。
(3)先向装置C的三口烧瓶中通入一段时间的 制备NaClO,再滴加
制备NaClO,再滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_______ 。
(4)向装置C中通入的 不能过量,原因是
不能过量,原因是_______ 。
(5)若无装置D,可能产生的危害是_______ 。
(6)装置C中反应结束后,过滤,然后向滤液中加入饱和KOH溶液,低温析出 晶体。由此可知低温时溶解度:
晶体。由此可知低温时溶解度:
_______ (填“大于”、“小于”或“等于”) 。
。
(7)高铁酸钾( )是水处理过程中的一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成
)是水处理过程中的一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成 胶体,高铁酸钾用作水处理剂的理由是
胶体,高铁酸钾用作水处理剂的理由是_______ 。
 )为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备
)为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(1)装置A为
 的发生装置,写出发生反应的离子方程式:
的发生装置,写出发生反应的离子方程式:(2)装置B中盛装的液体是
(3)先向装置C的三口烧瓶中通入一段时间的
 制备NaClO,再滴加
制备NaClO,再滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(4)向装置C中通入的
 不能过量,原因是
不能过量,原因是(5)若无装置D,可能产生的危害是
(6)装置C中反应结束后,过滤,然后向滤液中加入饱和KOH溶液,低温析出
 晶体。由此可知低温时溶解度:
晶体。由此可知低温时溶解度:
 。
。(7)高铁酸钾(
 )是水处理过程中的一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成
)是水处理过程中的一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成 胶体,高铁酸钾用作水处理剂的理由是
胶体,高铁酸钾用作水处理剂的理由是
您最近一年使用:0次
2022-01-19更新
|
201次组卷
|
6卷引用:山西省吕梁市2021-2022学年高一上学期期末考试化学试题
6 . 四氧化三锰用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯。以工业硫酸锰为原料(含有少量CaO、MgO、Ca(OH)2等物质)制备Mn3O4的工艺流程如下:
②四氧化三锰中锰的化合价与四氧化三铁中铁的化合价类似。
回答下列问题:
(1)为提高“溶解”效率,可采取的措施有_______
(2)滤渣的主要成分是_______
(3)氧化时,生成Mn3O4的离子方程式为_______
(4)向母液可加入_______产生氨气以回收利用
(5)通过对上述“氧化”工艺进行数据收集及资料分析可知溶液电位与pH等关系如下图所示_______
(6)四氧化三锰的其他制法:
①热还原法
在甲烷气体存在下,将Mn2O3还原成Mn3O4的化学方程式为_______
②电解法:
利用电解原理,制备四氧化三锰装置如图所示。(电极材料均为惰性电极,<代表电子流向)_______ (填“a”或“b”),阳极的电极反应式为_______

②四氧化三锰中锰的化合价与四氧化三铁中铁的化合价类似。
回答下列问题:
(1)为提高“溶解”效率,可采取的措施有
(2)滤渣的主要成分是
(3)氧化时,生成Mn3O4的离子方程式为
(4)向母液可加入_______产生氨气以回收利用
| A.CaO | B.稀氢氧化钠溶液 | C.氢氧化钙固体 | D.(NH4)2CO3 |
(5)通过对上述“氧化”工艺进行数据收集及资料分析可知溶液电位与pH等关系如下图所示



(6)四氧化三锰的其他制法:
①热还原法
在甲烷气体存在下,将Mn2O3还原成Mn3O4的化学方程式为
②电解法:
利用电解原理,制备四氧化三锰装置如图所示。(电极材料均为惰性电极,<代表电子流向)

您最近一年使用:0次



