名校
解题方法
1 . 实验室以锈蚀程度很大的废铁屑为原料制备FeCl3∙6H2O晶体的流程可简要表示如图:

已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生主要反应有:①Fe+2H+=Fe2++H2↑;②Fe2O3+6H+=2Fe3++3H2O;③_______ 。
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液出现白色沉淀,沉淀最终转化为红褐色,写出生成红褐色沉淀的化学方程式_______ 。
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是_______ ,为控制该温度可以采用的加热方式为_______ 。
(4)“氧化”过程可在如图所示装置中进行。

①装置A中KMnO4与浓盐酸反应生成了Cl2,其离子方程式为_______ 。
②B中使用多孔球泡的作用是_______ 。
③证明装置B溶液中Fe2+已完全被氧化成Fe3+的实验方案是_______ 。

已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生主要反应有:①Fe+2H+=Fe2++H2↑;②Fe2O3+6H+=2Fe3++3H2O;③
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液出现白色沉淀,沉淀最终转化为红褐色,写出生成红褐色沉淀的化学方程式
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是
(4)“氧化”过程可在如图所示装置中进行。

①装置A中KMnO4与浓盐酸反应生成了Cl2,其离子方程式为
②B中使用多孔球泡的作用是
③证明装置B溶液中Fe2+已完全被氧化成Fe3+的实验方案是
您最近一年使用:0次
名校
2 . 富硼渣中含有镁硼酸盐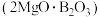 、镁硅酸盐
、镁硅酸盐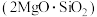 及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:
及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
(1)酸浸时发生反应: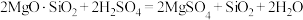 ,
,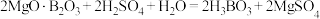 。
。
①上述反应体现出酸性强弱:H2SO4_______ (填“>”或“<”)H3BO3。
②已知硼酸与过量NaOH溶液发生的中和反应为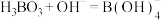 。下列关于硼酸的说法正确的是
。下列关于硼酸的说法正确的是_______ (填字母)。
A.硼酸是一元酸
B.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
C.硼酸的电离方程式可表示为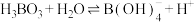
(2)检验褐色浸出液中的杂质离子:取少量浸出液,_______ (填操作和现象),证明溶液中含有Fe2+。
(3)除去浸出液中的杂质离子:用MgO调节溶液的pH至_______ 以上,使杂质离子转化为_______ (填化学式)沉淀,过滤。
(4)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合如图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,升温结晶得到_______ 晶体,分离后,再将母液降温结晶,分离得到_______ 晶体。

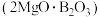 、镁硅酸盐
、镁硅酸盐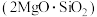 及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:
及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:
已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
 |  |  |  | |
| 开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
| 完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
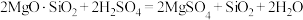 ,
,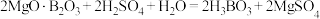 。
。①上述反应体现出酸性强弱:H2SO4
②已知硼酸与过量NaOH溶液发生的中和反应为
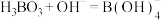 。下列关于硼酸的说法正确的是
。下列关于硼酸的说法正确的是A.硼酸是一元酸
B.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
C.硼酸的电离方程式可表示为
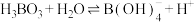
(2)检验褐色浸出液中的杂质离子:取少量浸出液,
(3)除去浸出液中的杂质离子:用MgO调节溶液的pH至
(4)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合如图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,升温结晶得到

您最近一年使用:0次
解题方法
3 . 铁及其化合物在生活、生产上有重要的应用。
(1)常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。若上述两种钢铁制品的表面出现破损,___________ (填“白铁皮”或“马口铁”)腐蚀速率更快。
(2)铁元素的常见价态有+2、+3价,Fe2+比Fe3+的稳定性弱的原因是___________ 。
(3)依地酸铁钠是一种强化补铁剂。某实验小组采用如下实验探究该补铁剂中铁元素的化合价。(已知:依地酸根是常见的配体,邻二氮菲可与Fe2+形成橙红色配合物)
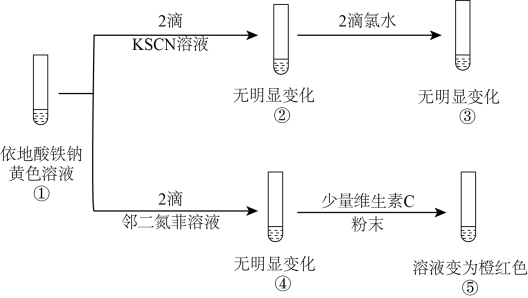
下列说法正确的是___________ (填字母)。
a.依据现象②和③推测,依地酸铁钠中不含Fe(Ⅲ)
b.依据现象②和⑤推测,依地酸铁钠中含Fe(Ⅱ)
c.依据现象①、②和③推测,SCN-与Fe3+形成配合物的稳定性强于依地酸铁钠
d.依据现象①、④和⑤推测,与依地酸根相比,邻二氮菲与Fe2+形成的配合物更稳定
(4)高铁酸钠(Na2FeO4)是一种新型水处理剂,用高铁酸钠处理水时被还原为Fe3+。某兴趣小组欲以硫铁矿(主要成分为FeS2,有少量SiO2等杂质)为原料制备高铁酸钠的工艺流程如下:
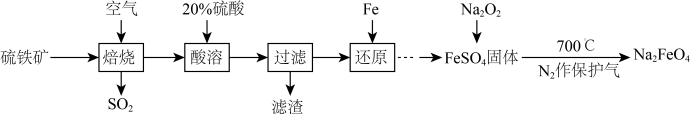
回答下列问题:
①焙烧前硫铁矿需粉碎,其目的是___________ 。
②焙烧后得到的固体主要成分为Fe2O3,写出焙烧过程主要反应的化学方程式:___________ 。
③还原反应的离子方程式为___________ 。
(5)高铁酸钠(Na2FeO4)易溶于水,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。将NaClO(含NaOH)饱和溶液与FeCl3饱和溶液(显酸性)混合也可湿法制取高铁酸钠。具体做法是:边搅拌,边将___________ 缓慢滴加到___________ 中得Na2FeO4,写出该反应的离子方程式___________ 。
(1)常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。若上述两种钢铁制品的表面出现破损,
(2)铁元素的常见价态有+2、+3价,Fe2+比Fe3+的稳定性弱的原因是
(3)依地酸铁钠是一种强化补铁剂。某实验小组采用如下实验探究该补铁剂中铁元素的化合价。(已知:依地酸根是常见的配体,邻二氮菲可与Fe2+形成橙红色配合物)

下列说法正确的是
a.依据现象②和③推测,依地酸铁钠中不含Fe(Ⅲ)
b.依据现象②和⑤推测,依地酸铁钠中含Fe(Ⅱ)
c.依据现象①、②和③推测,SCN-与Fe3+形成配合物的稳定性强于依地酸铁钠
d.依据现象①、④和⑤推测,与依地酸根相比,邻二氮菲与Fe2+形成的配合物更稳定
(4)高铁酸钠(Na2FeO4)是一种新型水处理剂,用高铁酸钠处理水时被还原为Fe3+。某兴趣小组欲以硫铁矿(主要成分为FeS2,有少量SiO2等杂质)为原料制备高铁酸钠的工艺流程如下:

回答下列问题:
①焙烧前硫铁矿需粉碎,其目的是
②焙烧后得到的固体主要成分为Fe2O3,写出焙烧过程主要反应的化学方程式:
③还原反应的离子方程式为
(5)高铁酸钠(Na2FeO4)易溶于水,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。将NaClO(含NaOH)饱和溶液与FeCl3饱和溶液(显酸性)混合也可湿法制取高铁酸钠。具体做法是:边搅拌,边将
您最近一年使用:0次
解题方法
4 . 为将某部分被氧化的废铜屑[主要含Cu、CuO、 ]转化为铜单质,同时制备绿矾(
]转化为铜单质,同时制备绿矾( ),某实验小组设计如图所示流程.
),某实验小组设计如图所示流程.

回答下列问题:
(1)“浸泡”时,Cu发生反应的离子方程式为______ , 的作用为
的作用为______ .
(2)“滤液1”中所含溶质的主要成分为______ .
(3)“分铜”时的操作名称是______ .
(4)“滤液2”容易被空气中的氧气氧化,长时间保存“滤液2”时需向其中加入一定量______ .
(5)向“滤液2”中滴加NaOH溶液,观察到的实验现象为______ ;发生反应的化学方程式为______ 和______ .
 ]转化为铜单质,同时制备绿矾(
]转化为铜单质,同时制备绿矾( ),某实验小组设计如图所示流程.
),某实验小组设计如图所示流程.
回答下列问题:
(1)“浸泡”时,Cu发生反应的离子方程式为
 的作用为
的作用为(2)“滤液1”中所含溶质的主要成分为
(3)“分铜”时的操作名称是
(4)“滤液2”容易被空气中的氧气氧化,长时间保存“滤液2”时需向其中加入一定量
(5)向“滤液2”中滴加NaOH溶液,观察到的实验现象为
您最近一年使用:0次
2023-12-22更新
|
121次组卷
|
2卷引用:江苏省徐州市青桐鸣大联考2023-2024学年高一上学期12月月考化学试卷
名校
5 . 用低品铜矿(主要含CuS、FeO)制备 的一种工艺流程如下:
的一种工艺流程如下:
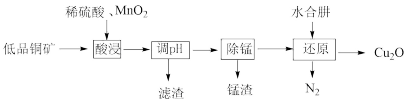
下列说法正确的是
 的一种工艺流程如下:
的一种工艺流程如下:

下列说法正确的是
A.“酸浸”过程中CuS发生反应的离子方程式为: |
B.已知酸浸液中含 ,为检验是否含有 ,为检验是否含有 ,可先加入KSCN溶液,再加氯水观察现象 ,可先加入KSCN溶液,再加氯水观察现象 |
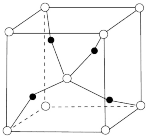
C.1个 晶胞(如图)中含4个氧原子 晶胞(如图)中含4个氧原子 |
D.水合肼浓度过大, 产率下降,可能的原因是 产率下降,可能的原因是 进一步被还原成单质铜 进一步被还原成单质铜 |
您最近一年使用:0次
2022-09-03更新
|
282次组卷
|
3卷引用:江苏省海安市2022-2023学年高三上学期期初学业质量监测化学试题
6 . 钛Ti被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2流程如图:(H2TiO3是不溶于水的酸)

(1)①步骤①加Fe的离子反应____ 。
②步骤②冷却的目的是___ 。
③检验“滤液”中部分金属阳离子的实验方案:取少量滤液于试管中,依次滴入KSCN溶液和氯水,若实验现象依次为____ ,则证明含有Fe2+,不含Fe3+。
(2)写出“水浸”过程的离子反应____ ;考虑成本和废物综合利用因素,水浸后废液中应加入___ 处理。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为

写出制取钛的反应方程式____ ;该反应在Ar气氛中进行的理由是____ 。

(1)①步骤①加Fe的离子反应
②步骤②冷却的目的是
③检验“滤液”中部分金属阳离子的实验方案:取少量滤液于试管中,依次滴入KSCN溶液和氯水,若实验现象依次为
(2)写出“水浸”过程的离子反应
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为

写出制取钛的反应方程式
您最近一年使用:0次
名校
解题方法
7 . 工业上由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备高纯碳酸锰。其主要工艺流程如下:

下列有关说法不正确 的是

下列有关说法
| A.可以通过搅拌的方式提高“酸浸”时粗锰粉的浸取率 |
B.向酸浸后的滤液中加入 ,反应的离子方程式为: ,反应的离子方程式为: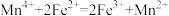 |
C.除铁时加入的物质X可以为 ,使 ,使 转化为 转化为 沉淀而除去 沉淀而除去 |
D.取除铁后的滤液,加入几滴KSCN溶液,无明显现象证明 已除尽 已除尽 |
您最近一年使用:0次
2022-01-23更新
|
217次组卷
|
3卷引用:江苏省盐城市2021-2022学年高二上学期期末考试化学试题
解题方法
8 . 某硫酸厂用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3)制备绿矾粗产品(FeSO4•7H2O),设计了如图流程:

信息提示:①SiO2是酸性氧化物,难溶于水,酸浸时不反应,②Fe(OH)2开始产生沉淀的pH值约为6.3,Al(OH)3开始产生沉淀的pH值约为3.2,完全沉淀pH值约为5.0;回答下列问题:
(1)“试剂a”的化学式为___ 。
(2)“酸浸”后溶液呈黄色,“还原”步骤中是向溶液逐步加入试剂b,直至稍有气体生成,溶液变为浅绿色,写出主要反应的离子方程式___ 。
(3)在“调pH至5-6”步骤中,除了H+与OH-的中和反应,另一反应的离子方程式为___ 。
(4)在“过滤”步骤中,需要对Al(OH)3充分洗涤,洗涤液合并到滤液1中,目的是___ 。
(5)检验“滤液1”中部分金属阳离子的实验方案:取少量滤液1于试管中,依次滴入KSCN溶液和氯水,若实验现象依次为___ ,则证明含有Fe2+,不含Fe3+,写出该过程中属于氧化还原反应的离子方程式___ 。
(6)用制得的绿矾产品可以制取摩尔盐,摩尔盐是一种重要的化工原料,广泛应用于医药冶金等领域,其化学组成可表示为x(NH4)2SO4•yFeSO4•zH2O。为确定摩尔盐的组成,进行如下实验:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取10.00mL溶液A,加入足量BaCl2溶液,充分反应后过滤、洗涤、干燥,得白色固体4.660g。
步骤三:另取10.00mL溶液A,加入0.0500mol•L-1KMnO4酸性溶液,发生反应:5Fe2++MnO +8H+=5Fe3++Mn2++4H2O,当两者恰好完全反应时,消耗KMnO4溶液的体积为40.00mL。通过计算确定摩尔盐中x:y的值
+8H+=5Fe3++Mn2++4H2O,当两者恰好完全反应时,消耗KMnO4溶液的体积为40.00mL。通过计算确定摩尔盐中x:y的值___ (写出计算过程)。

信息提示:①SiO2是酸性氧化物,难溶于水,酸浸时不反应,②Fe(OH)2开始产生沉淀的pH值约为6.3,Al(OH)3开始产生沉淀的pH值约为3.2,完全沉淀pH值约为5.0;回答下列问题:
(1)“试剂a”的化学式为
(2)“酸浸”后溶液呈黄色,“还原”步骤中是向溶液逐步加入试剂b,直至稍有气体生成,溶液变为浅绿色,写出主要反应的离子方程式
(3)在“调pH至5-6”步骤中,除了H+与OH-的中和反应,另一反应的离子方程式为
(4)在“过滤”步骤中,需要对Al(OH)3充分洗涤,洗涤液合并到滤液1中,目的是
(5)检验“滤液1”中部分金属阳离子的实验方案:取少量滤液1于试管中,依次滴入KSCN溶液和氯水,若实验现象依次为
(6)用制得的绿矾产品可以制取摩尔盐,摩尔盐是一种重要的化工原料,广泛应用于医药冶金等领域,其化学组成可表示为x(NH4)2SO4•yFeSO4•zH2O。为确定摩尔盐的组成,进行如下实验:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取10.00mL溶液A,加入足量BaCl2溶液,充分反应后过滤、洗涤、干燥,得白色固体4.660g。
步骤三:另取10.00mL溶液A,加入0.0500mol•L-1KMnO4酸性溶液,发生反应:5Fe2++MnO
 +8H+=5Fe3++Mn2++4H2O,当两者恰好完全反应时,消耗KMnO4溶液的体积为40.00mL。通过计算确定摩尔盐中x:y的值
+8H+=5Fe3++Mn2++4H2O,当两者恰好完全反应时,消耗KMnO4溶液的体积为40.00mL。通过计算确定摩尔盐中x:y的值
您最近一年使用:0次
名校
9 . 铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
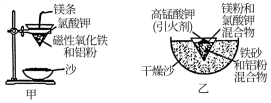
(1)某校化学兴趣小组同学,取磁性氧化铁按如图甲中的实验装置进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是__ ;
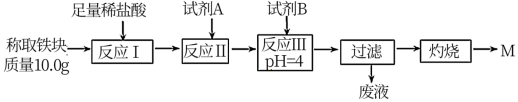
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见红色。为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示。
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
①试剂A为 溶液,写出反应II的离子方程式
溶液,写出反应II的离子方程式_______ ;
②反应III调节溶液 的目的是
的目的是_______ ;
③设计简单实验证明M的成分是 而非
而非 。
。
(限选试剂:稀盐酸、稀硫酸、氯水、高锰酸钾溶液、KSCN溶液、双氧水)
④若最终红棕色粉未M的质量为12.0g,则该“铁块”的纯度是_______ ;

(1)某校化学兴趣小组同学,取磁性氧化铁按如图甲中的实验装置进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见红色。为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
 |  |  |  | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完成时的pH | 9.0 | 4.0 | 5 | 11 |
 溶液,写出反应II的离子方程式
溶液,写出反应II的离子方程式②反应III调节溶液
 的目的是
的目的是③设计简单实验证明M的成分是
 而非
而非 。
。(限选试剂:稀盐酸、稀硫酸、氯水、高锰酸钾溶液、KSCN溶液、双氧水)
| 操作 | 预期现象 |
| 取少量M固体于试管中,向其中加入 | 固体完全溶解,溶液呈黄色 |
| 继续向上述溶液中滴入 |
您最近一年使用:0次
2021-04-28更新
|
521次组卷
|
5卷引用:江苏省常熟市2020-2021学年高一下学期期中化学试题
江苏省常熟市2020-2021学年高一下学期期中化学试题(已下线)第08讲 铝、镁及其重要化合物(精练)-2022年高考化学一轮复习讲练测江西省宁冈中学2021-2022学年高三上学期9月份开学考化学试题 上海交通大学附属中学2022-2023学年高二上学期开学摸底考试化学试题(已下线)第4讲 镁、铝及其化合物
10 . 高纯度的二氧化硅可用来制造光纤。某稻壳灰的主要成分为 、C及少量的
、C及少量的 、
、 、
、 、
、 等,通过如下流程可由稻壳灰制备较纯净的二氧化硅。
等,通过如下流程可由稻壳灰制备较纯净的二氧化硅。
(1)“滤渣A”的主要成分有_______ (填化学式),其中一种物质可用作外墙涂料,该物质的俗称为_______ 。
(2)步骤②滤液中主要存在的阳离子为 、
、 、
、_______ (填离子符号)。生成“滤渣B”的离子方程式为_______ 。
(3)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、泥三角和_______ 。
(4)为确认HCl、 、
、 的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。 溶液,其作用是
溶液,其作用是_______ 。
②装置C所盛试剂是_______ 溶液(填化学式)。
③由此可得出的结论是酸性:_______ 。
 、C及少量的
、C及少量的 、
、 、
、 、
、 等,通过如下流程可由稻壳灰制备较纯净的二氧化硅。
等,通过如下流程可由稻壳灰制备较纯净的二氧化硅。
(1)“滤渣A”的主要成分有
(2)步骤②滤液中主要存在的阳离子为
 、
、 、
、(3)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、泥三角和
(4)为确认HCl、
 、
、 的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
 溶液,其作用是
溶液,其作用是②装置C所盛试剂是
③由此可得出的结论是酸性:
您最近一年使用:0次



