名校
1 . 某工业胶料(主要成分为 、
、 、
、 及少量
及少量 ;
; 为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(
为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁( )或柠檬酸铁铵。
)或柠檬酸铁铵。
(1)碱浸。
①过程III中, 和
和 与过最
与过最 溶液反应的离子方程式分别为
溶液反应的离子方程式分别为___________________ 、__________________ 、_______________________ 。
②过程V中,发生反应的离子方程式为________________________ 。
③过程III和过程V分离出杂质的操作是___________________________ 。
(2)制各柠檬酸铁铵。
①补全过程Ⅱ中发生反应的离子方程式:________
 。
。
②过程II中,加入 溶液后,可观察到的现象为
溶液后,可观察到的现象为____________________ 。
(3)制备 。
。
①过程VIII中,用离子方程式说明加入铁屑的主要目的是______________________________ 。
②若过程V中 恰好反应完全,则在过程VI中加入
恰好反应完全,则在过程VI中加入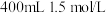 硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中
硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中 的物质的量最多为
的物质的量最多为__________  。
。
(4)应用。
向酸性含铬废水中加入 ,可将有害的
,可将有害的 (
( 元素为
元素为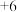 价)转化为
价)转化为 ,写出离子方程式:
,写出离子方程式:___________________________ 。然后调节 ,过滤,可将废水中的
,过滤,可将废水中的 除去。
除去。
 、
、 、
、 及少量
及少量 ;
; 为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(
为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁( )或柠檬酸铁铵。
)或柠檬酸铁铵。
(1)碱浸。
①过程III中,
 和
和 与过最
与过最 溶液反应的离子方程式分别为
溶液反应的离子方程式分别为②过程V中,发生反应的离子方程式为
③过程III和过程V分离出杂质的操作是
(2)制各柠檬酸铁铵。
①补全过程Ⅱ中发生反应的离子方程式:
 。
。②过程II中,加入
 溶液后,可观察到的现象为
溶液后,可观察到的现象为(3)制备
 。
。①过程VIII中,用离子方程式说明加入铁屑的主要目的是
②若过程V中
 恰好反应完全,则在过程VI中加入
恰好反应完全,则在过程VI中加入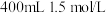 硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中
硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中 的物质的量最多为
的物质的量最多为 。
。(4)应用。
向酸性含铬废水中加入
 ,可将有害的
,可将有害的 (
( 元素为
元素为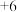 价)转化为
价)转化为 ,写出离子方程式:
,写出离子方程式: ,过滤,可将废水中的
,过滤,可将废水中的 除去。
除去。
您最近一年使用:0次
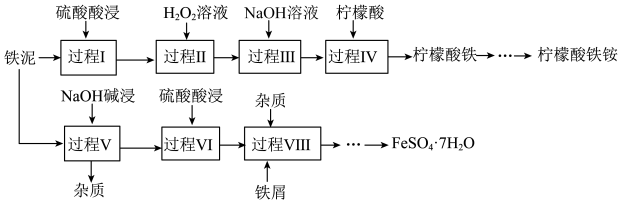
2 . 铁泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(FeSO4·7H2O)或柠檬酸铁铵。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为_______ 。
② 分离出杂质的操作是_______ 。
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:_______ 。
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为_______ 。
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是_______ 。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为
② 分离出杂质的操作是
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是
您最近一年使用:0次
3 . 铁泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(FeSO4·7H2O)或柠檬酸铁铵。
①Fe2O3与硫酸反应的离子方程式为________ 。
②分离出杂质的操作是________ 。
(2)制备柠檬酸铁铵
①补全过程II中发生反应的离子方程式:________ 。
(1) +(1)H++(1)H2O2=(1)Fe3++(1) 。
②过程III中,加入氨水后,可观察到的现象为________ 。
(3)制备FeSO4·7H2O
①过程V中,用离子方程式说明加入铁屑的主要目的是________ 。
②过程I中加入400mL1.5mol·L-1硫酸至固体不再溶解,则经过程V反应后所得溶液中Fe2+的物质的量最多为________ mol。
①Fe2O3与硫酸反应的离子方程式为
②分离出杂质的操作是
(2)制备柠檬酸铁铵
①补全过程II中发生反应的离子方程式:
(1) +(1)H++(1)H2O2=(1)Fe3++(1) 。
②过程III中,加入氨水后,可观察到的现象为
(3)制备FeSO4·7H2O
①过程V中,用离子方程式说明加入铁屑的主要目的是
②过程I中加入400mL1.5mol·L-1硫酸至固体不再溶解,则经过程V反应后所得溶液中Fe2+的物质的量最多为
您最近一年使用:0次
2022-01-14更新
|
410次组卷
|
2卷引用:北京市海淀区2021-2022学年高一上学期期末参考样题化学试题
解题方法
4 . 聚合硫酸铁(PFS)是优质、高效的铁盐类无机高分子絮凝剂,主要用于净水。下图是以废铁屑(主要成分为Fe、Fe2O3)为原料制备PFS的一种工艺流程。

(1)粉碎过筛选取细小颗粒的目的是___________ 。
(2)酸浸槽中,Fe2O3与稀硫酸反应的离子方程式为___________ 。
(3)反应釜中,加入H2O2的作用是___________ 。
(4)制备过程中,若需检验反应釜中含有的Fe3+,实验方案为:取少量反应釜中的溶液,向其中加入___________ (填试剂和现象),说明其中含有Fe3+。

(1)粉碎过筛选取细小颗粒的目的是
(2)酸浸槽中,Fe2O3与稀硫酸反应的离子方程式为
(3)反应釜中,加入H2O2的作用是
(4)制备过程中,若需检验反应釜中含有的Fe3+,实验方案为:取少量反应釜中的溶液,向其中加入
您最近一年使用:0次
名校
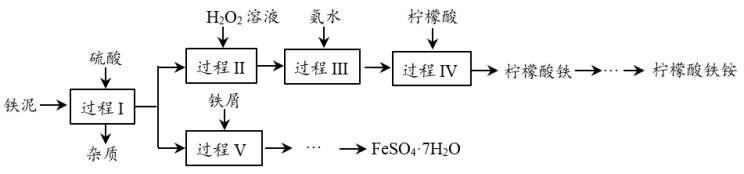
5 . 一种以钛铁矿( ,含
,含 、CaO、
、CaO、 等杂质)为主要原料制备钛白粉(
等杂质)为主要原料制备钛白粉( )的工艺流程如图所示。
)的工艺流程如图所示。
已知:
① 不溶于水和稀酸;
不溶于水和稀酸;
②“酸浸”后钛元素主要以 形式存在;
形式存在;
③ 在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
回答下列问题:
(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是_____ 。
(2)“酸浸”时, 发生反应的化学方程式为
发生反应的化学方程式为_____ 。
(3)滤渣①的主要成分是_____ 、_____ (填化学式)和 。
。
(4)流程中加入铁粉的目的是还原体系中的 ,反应的离子方程式为
,反应的离子方程式为_____ 。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下图所示。
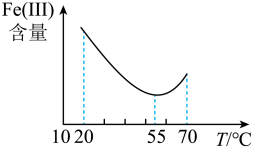
保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中Fe(Ⅲ)的最佳反应温度为_____ ℃。
(5)经处理后,流程中可循环利用的物质除Fe外,还有_____ (填化学式)。
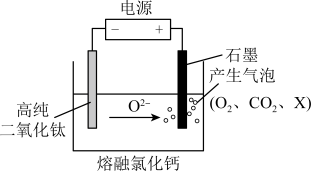
(6)如图为EFC剑桥法用固体二氧化钛( )生产海绵钛的装置示意图,其原理是在较低的阴极电位下,
)生产海绵钛的装置示意图,其原理是在较低的阴极电位下, (阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为__________ ,产生的气体中X的化学式为_____ 。
 ,含
,含 、CaO、
、CaO、 等杂质)为主要原料制备钛白粉(
等杂质)为主要原料制备钛白粉( )的工艺流程如图所示。
)的工艺流程如图所示。
已知:
①
 不溶于水和稀酸;
不溶于水和稀酸;②“酸浸”后钛元素主要以
 形式存在;
形式存在;③
 在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
在pH=1.8时生成沉淀,pH=4.1时沉淀完全。回答下列问题:
(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是
(2)“酸浸”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)滤渣①的主要成分是
 。
。(4)流程中加入铁粉的目的是还原体系中的
 ,反应的离子方程式为
,反应的离子方程式为
保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中Fe(Ⅲ)的最佳反应温度为
(5)经处理后,流程中可循环利用的物质除Fe外,还有
(6)如图为EFC剑桥法用固体二氧化钛(
 )生产海绵钛的装置示意图,其原理是在较低的阴极电位下,
)生产海绵钛的装置示意图,其原理是在较低的阴极电位下, (阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
您最近一年使用:0次
名校
6 . 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:
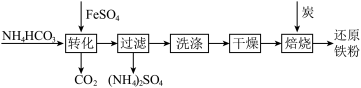
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
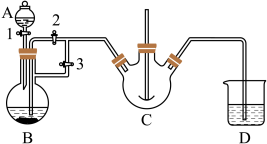
(1)装置A的名称是________ ,装置B中盛放的药品是________ ,NH4HCO3盛放在装置________ 中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是______________ , 发生主要反应的离子方程式为_________ 。FeSO4溶液要现用现配制的原因是_______ ,检验久置的FeSO4是否变质的方法是_________________ 。
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为________ ,取干燥后的FeCO3样品12.49 g,与炭混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________ g。

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。

(1)装置A的名称是
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为
您最近一年使用:0次
2019-12-22更新
|
507次组卷
|
9卷引用:北京市海淀区中关村中学2021-2022学年高三上学期10月月考化学试题
北京市海淀区中关村中学2021-2022学年高三上学期10月月考化学试题苏教版2017届高三单元精练检测九化学试题黑龙江省哈尔滨市第六中学2018届高三9月阶段检测化学试题福建省莆田第七中学2020届高三上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测四川省射洪中学2019-2020学年高一上期期末英才班能力素质监测化学试题河南省洛阳市第一高级中学2020-2021学年高一上学期12月月考化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(工业流程题)



