解题方法
1 . 将铁、铝的混合物进行如下实验:
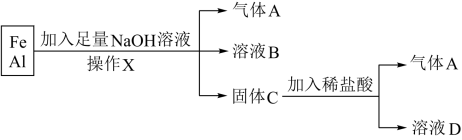
(1)操作X的名称是________ 。
(2)气体A是________ (填化学式)。
(3)A与Cl2混合光照可能发生爆炸,A在该反应中作________ (填“氧化剂”或“还原剂”)。
(4)溶液B中的阴离子除OH-外还有________ (填离子符号,下同),溶液D中存在的金属离子为________ 。
(5)加入足量NaOH溶液时发生反应的离子方程式为___________ ;加入稀盐酸发生反应的离子方程式为_________ 。
(6)向溶液D中加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:___________ 。

(1)操作X的名称是
(2)气体A是
(3)A与Cl2混合光照可能发生爆炸,A在该反应中作
(4)溶液B中的阴离子除OH-外还有
(5)加入足量NaOH溶液时发生反应的离子方程式为
(6)向溶液D中加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:
您最近一年使用:0次
解题方法
2 . 下列各图示中不能较长时间看到Fe(OH)2白色沉淀的是______ (填序号)


您最近一年使用:0次
2020-04-24更新
|
112次组卷
|
2卷引用:辽宁省本溪市2019-2020学年高一下学期寒假验收考试化学试题
名校
解题方法
3 . 有关铁的化合物的说法中,错误的是( )
| A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色 |
B.如图所示操作可制取Fe(OH)2 |
| C.Fe3O4、Fe(OH)3都可以由化合反应制得 |
| D.Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应 |
您最近一年使用:0次
2020-02-11更新
|
1460次组卷
|
9卷引用:辽宁省抚顺市第六中学2020-2021学年高一上学期期末考试化学试题
辽宁省抚顺市第六中学2020-2021学年高一上学期期末考试化学试题湖南师范大学附属中学2019-2020学年高一上学期第二次大练习化学试题(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)3.1.2 铁及其化合物之间的转化关系练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物江苏省泰兴中学、江苏省南菁高级中学2020-2021学年高一上学期第二次阶段考试化学(选修)试题广西南宁市邕宁高中2020-2021学年高一上学期期末考试化学试题山东省青岛市格兰德学校2023-2024学年高一上学期12月月考化学试题(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备
4 . 已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
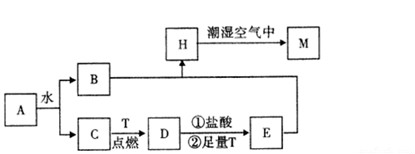
(1)物质A的化学式为________ 。
(2)H在潮湿空气中变成M的实验现象是______________________________________ ,化学方程式为___________________________________________ 。
(3)A和水反应生成B和C的离子方程式为___________________________________ ,由此反应可知A有作为_________ 的用途。
(4)步骤①的离子方程式_______________________________________ ,请写出检验步骤①得到的溶液中主要阳离子(除H+外)所需要的试剂:_____________ 、____________ (填化学式)。

(1)物质A的化学式为
(2)H在潮湿空气中变成M的实验现象是
(3)A和水反应生成B和C的离子方程式为
(4)步骤①的离子方程式
您最近一年使用:0次
2018-11-24更新
|
1639次组卷
|
2卷引用:【全国百强校】辽宁省实验中学2018-2019学年高一(实验班)上学期期中考试化学试题
5 . 用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________ 。
(2)除去蒸馏水中溶解的O2常采用________ 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_________________ 。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
(2)除去蒸馏水中溶解的O2常采用
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
您最近一年使用:0次
2018-09-15更新
|
213次组卷
|
6卷引用:2011-2012学年辽宁省沈阳东北育才学校高一上学期期中考试化学试卷
(已下线)2011-2012学年辽宁省沈阳东北育才学校高一上学期期中考试化学试卷2015-2016学年河北省永年二中高一上学期12月月考化学试卷(已下线)3.1.2 铁及其化合物之间的转化关系练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)新人教必修1第3章第一节第2课时铁的氧化物和氢氧化物(课中)(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【教学案】第三章 金属及其化合物 第13讲 铁及其重要化合物
6 . A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
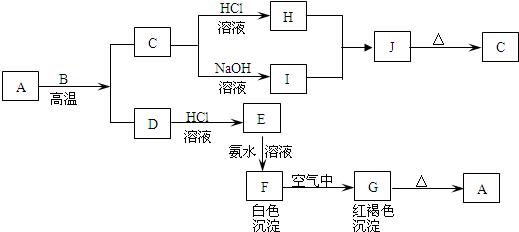
(1)写出下列物质的化学式:A:________ ,E:________ ,J:________ ,G:________ .
(2)按要求写方程式:
①A与B在高温条件下生成C和D的化学方程式:________________________________ ;
②C转化为I的离子方程式:___________________________________________ .
③F在空气中转化为G的化学方程式:__________________________________ ;

(1)写出下列物质的化学式:A:
(2)按要求写方程式:
①A与B在高温条件下生成C和D的化学方程式:
②C转化为I的离子方程式:
③F在空气中转化为G的化学方程式:
您最近一年使用:0次
2018-03-21更新
|
365次组卷
|
6卷引用:2015-2016学年辽宁实验中学分校高一上12月月考化学卷
2015-2016学年辽宁实验中学分校高一上12月月考化学卷(已下线)2010—2011学年福建省安溪一中、养正中学高一上学期期末联考化学试卷云南省中央民大附中芒市国际学校2017-2018学年高一上学期末考试化学试卷(已下线)3.1.2 铁及其化合物之间的转化关系练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)新疆伊犁奎屯市第一高级中学2020-2021学年高一上学期期末考试化学试题内蒙古壮族自治区乌兰察布市化德县第一中学2021届高三上学期期中考试化学试题
解题方法
7 . 已知A为应用广泛的金属单质、B溶液呈浅绿色、C溶液焰色反应呈紫色、C溶液可使酚酞溶液呈红色,各物质有如图所示的相互转化:
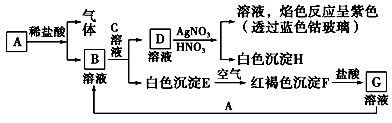
试回答:
(1)写出B的化学式_________________ ,D的化学式_________________ 。
(2)写出由E转变成F的化学方程式__________________________________ 。
(3)写出向G溶液中加入A的离子方程式:____________________________ ;

试回答:
(1)写出B的化学式
(2)写出由E转变成F的化学方程式
(3)写出向G溶液中加入A的离子方程式:
您最近一年使用:0次
2018-01-08更新
|
225次组卷
|
2卷引用:辽宁省辽阳2017-2018学年高一化学期末考试题
解题方法
8 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
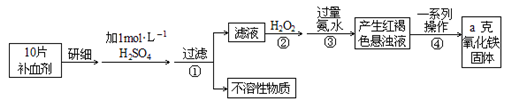
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法______________________ ,该过程的现象为:___________________
(2)步骤②加入过量H2O2的目的(用离子方程式表示):_______________ 。
(3)步骤③中反应的离子方程式:_______________________________________ 。
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________ 。
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:_________ 、洗涤、_________ 、冷却、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量__________ g。
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含______________ mgFeSO4·7H2O的片剂。

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法
(2)步骤②加入过量H2O2的目的(用离子方程式表示):
(3)步骤③中反应的离子方程式:
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的氧化还原反应为(用化学方程式表达)
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:
(6)若实验无损耗,则每片补血剂含铁元素的质量
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含
您最近一年使用:0次
2017-03-01更新
|
168次组卷
|
2卷引用:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷
名校
解题方法
9 . Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂,某课外小组测定该补血剂中铁元素的含量.实验步骤如下::
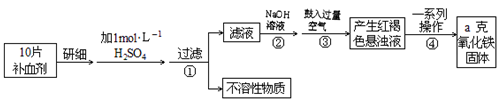
请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为______________ 。步骤③中反应的化学方程式为_____________________ 。
(2)步骤④中一系列处理的操作步骤:___________ 、洗涤、___________ 、冷却、称量.
(3)实验中需用98%浓硫酸(密度1.84g/mL)配制1mol/L的稀硫酸480mL,配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有___________ ,需用量筒量取浓硫酸________ mL。
(4)若实验无损耗,则每片补血剂含铁元素的质量___________ g(用含a的代数式表示)

请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为
(2)步骤④中一系列处理的操作步骤:
(3)实验中需用98%浓硫酸(密度1.84g/mL)配制1mol/L的稀硫酸480mL,配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有
(4)若实验无损耗,则每片补血剂含铁元素的质量
您最近一年使用:0次
2017-02-17更新
|
1426次组卷
|
5卷引用:辽宁省凌源市2018-2019学年高一下学期第一次联考化学试题
解题方法
10 . 下列物质能通过化合反应直接制得的是
FeCl2、Fe(OH)3、Fe(OH)2、NaHSO3、Cu2(OH)2CO3、Fe3O4、Al(OH)3、CuS.
FeCl2、Fe(OH)3、Fe(OH)2、NaHSO3、Cu2(OH)2CO3、Fe3O4、Al(OH)3、CuS.
| A.6种 | B.5种 | C.3种 | D.2种 |
您最近一年使用:0次



