名校
解题方法
1 . 铁黄 是一种优质颜料。制备铁黄晶种时,向精制
是一种优质颜料。制备铁黄晶种时,向精制 溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至
溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至 时,开始通入空气,溶液
时,开始通入空气,溶液 随时间的变化曲线如图。下列分析不正确的是
随时间的变化曲线如图。下列分析不正确的是
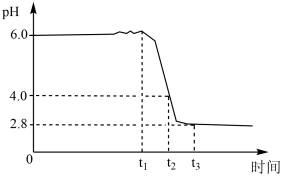
 是一种优质颜料。制备铁黄晶种时,向精制
是一种优质颜料。制备铁黄晶种时,向精制 溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至
溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至 时,开始通入空气,溶液
时,开始通入空气,溶液 随时间的变化曲线如图。下列分析不正确的是
随时间的变化曲线如图。下列分析不正确的是
A.产生白色沉淀的离子方程式为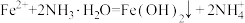 |
B. 发生的主要反应为 发生的主要反应为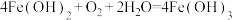 |
C. 发生的主要反应为 发生的主要反应为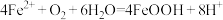 |
D.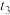 后仅发生反应4Fe2++O2+4H+=4Fe3++2H2O 后仅发生反应4Fe2++O2+4H+=4Fe3++2H2O |
您最近一年使用:0次
2023-02-26更新
|
424次组卷
|
4卷引用:辽宁省大连市第十二中学2023-2024学年高一上学期12月学情反馈化学试题
名校
2 . 铁及其化合物在生产和生活中起到重要的作用。请回答下列问题:
(1)人体对 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起_______ 剂。
(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为_______ 。
(3)实验室中储存 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的_______ 。
(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量 )制备
)制备 。操作过程如下:
。操作过程如下:
i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。
①步骤ii中加入过量氧化剂 的目的是
的目的是_______ 。离子方程式为_______ 。
②设计实验验证操作i所得溶液中不含 ,简述实验操作及现象:
,简述实验操作及现象:_______ 。
③该小组同学认为即使操作i所得溶液中不含 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为_______ 。
(5)羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
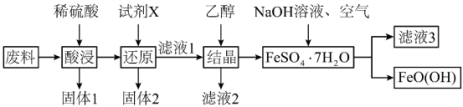
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
①“固体1”的主要成分是_______ 。
②“酸浸”时CuO与硫酸发生反应的离子方程式为_______ 。“试剂X”宜选择的是_______ 。
A.双氧水 B.铜粉 C.铁粉 D.钠块
(1)人体对
 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为
(3)实验室中储存
 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量
 )制备
)制备 。操作过程如下:
。操作过程如下:i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂
 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。①步骤ii中加入过量氧化剂
 的目的是
的目的是②设计实验验证操作i所得溶液中不含
 ,简述实验操作及现象:
,简述实验操作及现象:③该小组同学认为即使操作i所得溶液中不含
 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为(5)羟基氧化铁
 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。①“固体1”的主要成分是
②“酸浸”时CuO与硫酸发生反应的离子方程式为
A.双氧水 B.铜粉 C.铁粉 D.钠块
您最近一年使用:0次
解题方法
3 . Ⅰ.碳酸亚铁在空气中灼烧得到铁的氧化物A和一种气体。某学习小组为了探究该氧化物A的组成设计如下实验方案:
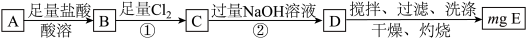
(1)若该方案中①通入 不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是
不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是_______ (用化学方程式表示)。
(2)若氧化物A的质量是7.84g,E的质量为8.00g,根据数据计算化合物A的化学式为_______ 。
Ⅱ.高铁酸钾( )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知
)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知 在
在 催化下会分解,在强碱性条件下稳定。高铁酸钾(
催化下会分解,在强碱性条件下稳定。高铁酸钾( )生产流程如下:
)生产流程如下:
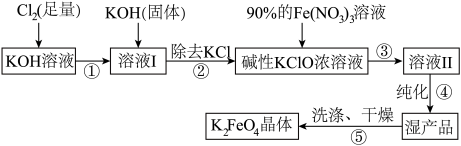
(3)在溶液Ⅰ中加入KOH固体的目的是_______。
(4)写出③反应的离子方程式_______ 。
(5)制备 时,将90%的
时,将90%的 溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是
溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_______ 。
(6) 在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为
在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为_______ (写出化学式)。
(7) 净水时能吸附悬浮物的原因是
净水时能吸附悬浮物的原因是_______ 。
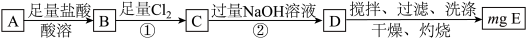
(1)若该方案中①通入
 不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是
不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是(2)若氧化物A的质量是7.84g,E的质量为8.00g,根据数据计算化合物A的化学式为
Ⅱ.高铁酸钾(
 )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知
)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知 在
在 催化下会分解,在强碱性条件下稳定。高铁酸钾(
催化下会分解,在强碱性条件下稳定。高铁酸钾( )生产流程如下:
)生产流程如下:
(3)在溶液Ⅰ中加入KOH固体的目的是_______。
A.与溶液Ⅰ中过量的 继续反应,生成更多的KClO 继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高KClO产率 |
| C.为下一步反应提供碱性的环境 |
D.使 转化为KClO 转化为KClO |
(5)制备
 时,将90%的
时,将90%的 溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是
溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是(6)
 在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为
在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为(7)
 净水时能吸附悬浮物的原因是
净水时能吸附悬浮物的原因是
您最近一年使用:0次
2023-01-04更新
|
521次组卷
|
3卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
解题方法
4 . 下列实验装置或操作能够达到实验目的是
| A | B | C | D |
 |  |  |  |
比较 、 、 和S的氧化性 和S的氧化性 | 配制100mL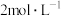 稀硫酸溶液 稀硫酸溶液 | 制备并长时间看到 白色沉淀 白色沉淀 | 证明非金属性:Cl>C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-04更新
|
653次组卷
|
3卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
5 . 铁是人类较早使用的金属之一,铁及其化合物应用广泛。请运用所学知识,回答下列问题。
Ⅰ.某化学学习小组想利用FeCl3腐蚀铜后所得的废液回收铜,并同时使FeCl3溶液再生,设计了如下实验:
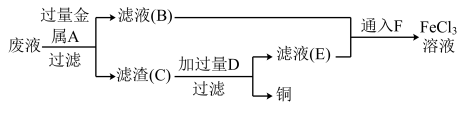
(1)通入F气体时发生反应的离子方程式为__________________
(2)若取少量滤液B于试管中,加入适量氢氧化钠溶液,振荡试管,再放置几分钟,可以观察到试管内的现象为________________ ,涉及的化学反应方程式为_________________________ 。
Ⅱ.学习小组同学继续研究铁与水蒸气的反应,进行了如图实验。
(3)若所用铁粉中含有少量杂质铝,可以用_________ 除去铝(填序号),
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
(4)实验Ⅰ中反应的化学方程式为_________________________________
(5)甲同学观察到实验Ⅰ中持续产生肥皂泡,一段时间后,取少量实验Ⅰ中反应后的固体进行实验Ⅱ。如果实验Ⅱ中的溶液b呈现红色,则说明溶液a中一定含有____ 离子(写离子符号),但甲同学发现实验Ⅱ中的溶液b并没有呈现红色,请你分析溶液b未呈现红色的原因为:__ 。
Ⅰ.某化学学习小组想利用FeCl3腐蚀铜后所得的废液回收铜,并同时使FeCl3溶液再生,设计了如下实验:

(1)通入F气体时发生反应的离子方程式为
(2)若取少量滤液B于试管中,加入适量氢氧化钠溶液,振荡试管,再放置几分钟,可以观察到试管内的现象为
Ⅱ.学习小组同学继续研究铁与水蒸气的反应,进行了如图实验。
| 实验Ⅰ | 实验Ⅱ |
 |  |
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
(4)实验Ⅰ中反应的化学方程式为
(5)甲同学观察到实验Ⅰ中持续产生肥皂泡,一段时间后,取少量实验Ⅰ中反应后的固体进行实验Ⅱ。如果实验Ⅱ中的溶液b呈现红色,则说明溶液a中一定含有
您最近一年使用:0次
6 . 铁及其化合物在生产和生活中起到重要的作用。请回答下列问题:
(1)人体对Fe2+的吸收效果更好,但人体中时刻进行着Fe2+ Fe3+的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
Fe3+的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起_____ 。
(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为_____ 。
(3)实验室中储存FeSO4溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的______ 。
(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量Fe2O3)制备Fe2O3。操作过程如下:
i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂H2O2,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
①步骤ii中加入过量氧化剂H2O2的目的是______ 。
②设计实验验证操作i所得溶液中不含Fe3+,简述实验操作及现象:______ 。
③该小组同学认为即使操作i所得溶液中不含Fe3+,也不需要加入H2O2,若直接加入NaOH溶液可观察到的实验现象为_____ 。
(1)人体对Fe2+的吸收效果更好,但人体中时刻进行着Fe2+
 Fe3+的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
Fe3+的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为
(3)实验室中储存FeSO4溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量Fe2O3)制备Fe2O3。操作过程如下:
i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂H2O2,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
①步骤ii中加入过量氧化剂H2O2的目的是
②设计实验验证操作i所得溶液中不含Fe3+,简述实验操作及现象:
③该小组同学认为即使操作i所得溶液中不含Fe3+,也不需要加入H2O2,若直接加入NaOH溶液可观察到的实验现象为
您最近一年使用:0次
名校
7 . 下列各图示中能较长时间观察到 的是
的是

 的是
的是
| A.①②③ | B.①②④ | C.①②③④ | D.②③④ |
您最近一年使用:0次
2022-12-26更新
|
2358次组卷
|
52卷引用:辽宁省盘锦市辽河油田第二高级中学2019-2020学年高一上学期期末考试化学试题
辽宁省盘锦市辽河油田第二高级中学2019-2020学年高一上学期期末考试化学试题2016-2017学年宁夏育才中学高一上月考二化学卷2(已下线)2018年11月8日 ——《每日一题》人教必修1铁的氢氧化物的性质和制备河北省承德市第一中学2018-2019学年高一上学期第三次月考化学试题(已下线)2019年11月7日《每日一题》必修1—— 铁的氢氧化物的性质和制备陕西省商洛市山阳中学2019-2020学年高一上学期期中考试化学试题北京市2019—2020学年高一年级11月月考化学试题湖北省利川市第五中学2019-2020学年高一12月月考化学试题江苏省南通市白蒲高级中学2019-2020学年高一下学期期末复习化学试题(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第三章 章末检测(2)——《高中新教材同步备课》(人教版 必修第一册)人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性鲁科版(2019)高一必修第一册第三章易错疑难集训(一)人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物(已下线)3.1.2 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)云南省弥勒市第一中学黄冈校区2020-2021学年高一12月月考化学试题云南省曲靖市第二中学2020-2021学年高一上学期期末考试化学试题云南省云天化中学2020-2021学年高一下学期开学考试化学试题吉林省长春市第二十中学2020-2021学年高一上学期第三次考试化学试题四川省成都市实验外国语学校(西区)2019-2020学年高一上学期11月月考化学试题(苏教版2019)必修第二册专题9 金属与人类文明 易错疑难集训(已下线)专题3.1.2 铁的氧化物和氢氧化物(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)3.1.1 铁及其氧化物、氢氧化物-2021-2022学年高一化学课后培优练(人教版2019必修第一册)2016-2017学年湖南省长沙市长郡中学高一上学期期末考试化学试卷(已下线)5.2.2 重要的金属化合物(第2课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)安徽省六安市第一中学2021-2022学年高一下学期开学考试化学试题吉林省长春市第二中学2021-2022学年高一上学期期末化学试题河北省保定市唐县第一中学2021-2022学年高一下学期6月考试化学试题江西省安福县第三中学2021-2022学年高一上学期第二次月考化学试题(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)宁夏银川市第三十一中学2021-2022学年高一上学期期末学业检测化学试题山东省枣庄市滕州市第五中学2022-2023学年高一上学期第二次线上考试化学试题湖北省武汉外国语学校(武汉实验外国语学校)2022-2023学年高一上学期12月月考化学试题浙江省宁波市效实中学2022-2023学年高一上学期期中考试化学试题(已下线)【2023】【高一上】【浙附丁兰】【期末考】【高中化学】【赵优萍收集】9.2.2反应条件影响的探究(课前)-2019苏教版必修2课前课中课后(已下线)【知识图鉴】单元讲练测必修第一册第三单元01讲核心河北省邯郸市永年区第二中学2022-2023学年高一下学期5月月考化学试题(已下线)【精品卷】3.1.2 铁的重要化合物课堂例题-人教版2023-2024学年必修第一册陕西省西安市第三十八中学2023-2024学年高一上学期第二次月考化学试卷河北省衡水市武强中学2023-2024学年高一上学期期末考试化学试题上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题1上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题2上海交通大学附属中学2017-2018学年高二上学期第一次月考化学试题上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题3上海市曹杨第二中学2018-2019学年高二上学期期中考试化学试题(已下线)上海市上海交通大学附属中学2017-2018学年高二10月月考化学试题内蒙古壮族自治区乌兰察布市化德县第一中学2021届高三上学期期中考试化学试题(已下线)专题突破卷03?金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)12-2023新东方高二上期中考化学12
13-14高一上·辽宁·期末
名校
解题方法
8 . 下列离子的检验方法合理的是
| A.向某溶液中滴入硫氰化钾溶液呈红色,说明不含Fe2+ |
| B.向某溶液中通入氯气,然后再加入硫氰化钾溶液变红色,说明原溶液中含有Fe2+ |
| C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+ |
| D.向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
您最近一年使用:0次
2022-12-20更新
|
526次组卷
|
41卷引用:2012-2013学年辽宁省实验中学分校高一上学期期末考试化学试卷
(已下线)2012-2013学年辽宁省实验中学分校高一上学期期末考试化学试卷(已下线)2012-2013年黑龙江哈尔滨第十二中学高一上学期期末考试化学试卷2015-2016学年广东省汕头金山中学高一上期末化学试卷2016-2017学年宁夏育才中学高一上月考二化学卷22016-2017学年江西省景德镇一中高一12月月考化学卷青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1宁夏育才中学孔德校区2017-2018学年高一12月月考化学试题青海省西宁二十一中2017-2018学年高一上学期12月月考化学试题安徽省滁州市民办高中2018-2019学年高一上学期第三次月考化学试题【市级联考】吉林省公主岭市2018-2019学年高一上学期期末考试化学试题甘肃省武威第十八中学2018-2019学年高一上学期期末考试化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)辽宁省本溪满族自治县高级中学2019-2020学年高二下学期期末考试化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 教材帮(已下线)练习13 铁铜的获取和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)江西省南昌市新建一中2020-2021学年高一上学期第二次月考化学试题(已下线)【浙江新东方】双师107专题9 第二单元 探究铁及其化合物的转化-高中化学必修第二册苏教版2019(已下线)【浙江新东方】高中化学20210304-019陕西省武功县普集高级中学2021-2022学年高一上学期第二次月考化学试题浙江省丽水外国语学校高中部2021-2022学年高一下学期第一次阶段性考试(3月)化学试题山东省济南九中2022-2023学年高一第二次线上质量评估(12月份)化学试题9.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后第2课时 铁盐和亚铁盐作业(十七) 亚铁盐和铁盐(已下线)【精品卷】3.1.2 铁的重要化合物课堂例题-人教版2023-2024学年必修第一册河北省高碑店市崇德实验中学2022-2023学年高一下学期期末考试化学试题2015-2016学年山西省晋城市高平市特立高中高二下期中文科化学试卷河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测湖北省宜昌市葛洲坝中学2021届高三9月月考化学试题陕西省汉中市洋县第二高级中学2020-2021学年高二上学期11月月考化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(文)试题湖北省咸丰春晖学校2022-2023学年高二上学期9月月考化学试题吉林江城中学2021-2022学年高三上学期9月月考化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
名校
9 . 已知:A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,H是白色沉淀,W溶液中加入KSCN溶液出现红色。各物质之间的转化关系如下图所示,请回答下列问题:
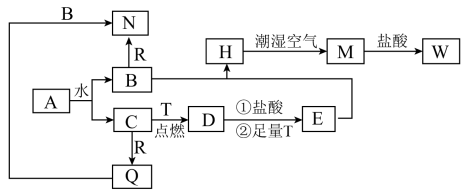
(1)写出化学式:D_______ ,W_______ 。
(2)H在潮湿空气中变成M的化学方程式_______ 。
(3)写出Q+B→N的离子方程式_______ ;在B与R反应中,当有1molN物质生成时,参与反应的氧化剂有_______ mol。
(4)D→E过程中①的离子反应方程式_______ 。
(5)将一定量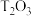 和
和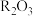 混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
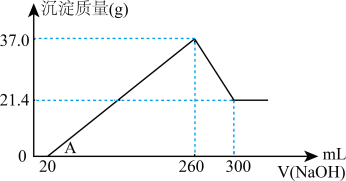
①混合物中含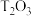 的质量为
的质量为_______ g;
②所用硫酸溶液物质的量浓度为_______  。
。

(1)写出化学式:D
(2)H在潮湿空气中变成M的化学方程式
(3)写出Q+B→N的离子方程式
(4)D→E过程中①的离子反应方程式
(5)将一定量
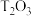 和
和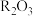 混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
①混合物中含
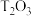 的质量为
的质量为②所用硫酸溶液物质的量浓度为
 。
。
您最近一年使用:0次
2022-12-16更新
|
331次组卷
|
2卷引用:辽宁省沈阳市第一二〇中学2022-2023学年高一上学期第三次月考化学试题
10 . 某溶液中含有下列离子 、
、 、
、 、
、 、
、 ,向其中先加入足量的KOH溶液,然后微热并搅拌,再加入足量的稀盐酸原溶液中离子基本不变的为
,向其中先加入足量的KOH溶液,然后微热并搅拌,再加入足量的稀盐酸原溶液中离子基本不变的为
 、
、 、
、 、
、 、
、 ,向其中先加入足量的KOH溶液,然后微热并搅拌,再加入足量的稀盐酸原溶液中离子基本不变的为
,向其中先加入足量的KOH溶液,然后微热并搅拌,再加入足量的稀盐酸原溶液中离子基本不变的为A. | B. | C. | D. |
您最近一年使用:0次
2022-12-16更新
|
220次组卷
|
3卷引用:辽宁省沈阳市第一二〇中学2022-2023学年高一上学期第三次月考化学试题



