解题方法
1 . 硫酸亚铁铵是一种重要的化工原料,用途广泛,其晶体为浅绿色,俗名摩尔盐,化学式为 。某小组设计如下实验进行探究:
。某小组设计如下实验进行探究:
I.制备
(1)向新制的
 溶液中加入一定质量的
溶液中加入一定质量的 固体,在
固体,在 条件下溶解后,趁热倒入50mL乙醇中,析出晶体。实验时所采用的加热方式是
条件下溶解后,趁热倒入50mL乙醇中,析出晶体。实验时所采用的加热方式是Ⅱ.i.测定 含量(蒸馏法,装置如图)
含量(蒸馏法,装置如图)

①称取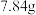 晶体加水溶解后,将溶液注入三颈烧瓶中;
晶体加水溶解后,将溶液注入三颈烧瓶中;
②准确量取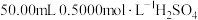 溶液于锥形瓶中;
溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶,用蒸馏水冲洗冷凝管内通道2~3次,将洗涤液注入锥形瓶中;
④用 的NaOH标准溶液滴定锥形瓶中过量的硫酸,以酚酞为指示剂,滴定终点时消耗
的NaOH标准溶液滴定锥形瓶中过量的硫酸,以酚酞为指示剂,滴定终点时消耗 NaOH标准溶液。
NaOH标准溶液。
(2)步骤②中,量取
 溶液的仪器是下图所示仪器中的
溶液的仪器是下图所示仪器中的
(3)步骤③中,三颈烧瓶中可能发生的氧化还原反应的化学方程式是
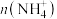 的值将
的值将(4)步骤④中达到滴定终点的现象是
ii.测定 含量(重量分析法)
含量(重量分析法)
⑤另取一份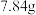 晶体于烧杯,加水溶解,边搅拌边加入过量的
晶体于烧杯,加水溶解,边搅拌边加入过量的 溶液;
溶液;
⑥抽滤,用稀硫酸洗涤沉淀3次;将所得沉淀充分干燥,称量,得沉淀质量为 。
。
(5)步骤⑤中,判断
 溶液已过量的实验操作和现象是
溶液已过量的实验操作和现象是(6)结合实验I和Ⅱ,通过计算得出该晶体的化学式为
您最近一年使用:0次
名校
解题方法
2 . 铁、铝是两种常见的金属,其合金在生产、生活中扮演着重要的角色,对混合物进行如下实验:

(1)操作X是___________ ;
(2)A与Cl2混合光照可能发生爆炸,A在该反应中作___________ (填“氧化剂”或“还原剂”);
(3)合金中加入足量NaOH溶液发生反应的离子方程式___________ ;
(4)加入稀盐酸发生反应的离子方程式为___________ ;
(5)向溶液D中加入NaOH溶液,观察到产生的现象是___________ ,写出相应的化学方程式:___________ ,___________ 。

(1)操作X是
(2)A与Cl2混合光照可能发生爆炸,A在该反应中作
(3)合金中加入足量NaOH溶液发生反应的离子方程式
(4)加入稀盐酸发生反应的离子方程式为
(5)向溶液D中加入NaOH溶液,观察到产生的现象是
您最近一年使用:0次
2024-03-12更新
|
52次组卷
|
2卷引用:贵州省瓮安中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
3 . 下列离子的检验方法合理的是
| A.向某溶液中滴入硫氰化钾溶液呈红色,说明不含Fe2+ |
| B.向某溶液中通入氯气,然后再加入硫氰化钾溶液变红色,说明原溶液中含有Fe2+ |
| C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+ |
| D.向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
您最近一年使用:0次
2022-12-20更新
|
489次组卷
|
41卷引用:贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题
贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题(已下线)2012-2013学年辽宁省实验中学分校高一上学期期末考试化学试卷(已下线)2012-2013年黑龙江哈尔滨第十二中学高一上学期期末考试化学试卷2015-2016学年广东省汕头金山中学高一上期末化学试卷2015-2016学年山西省晋城市高平市特立高中高二下期中文科化学试卷2016-2017学年宁夏育才中学高一上月考二化学卷22016-2017学年江西省景德镇一中高一12月月考化学卷河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1宁夏育才中学孔德校区2017-2018学年高一12月月考化学试题青海省西宁二十一中2017-2018学年高一上学期12月月考化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密安徽省滁州市民办高中2018-2019学年高一上学期第三次月考化学试题【市级联考】吉林省公主岭市2018-2019学年高一上学期期末考试化学试题甘肃省武威第十八中学2018-2019学年高一上学期期末考试化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测辽宁省本溪满族自治县高级中学2019-2020学年高二下学期期末考试化学试题湖北省宜昌市葛洲坝中学2021届高三9月月考化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 教材帮陕西省汉中市洋县第二高级中学2020-2021学年高二上学期11月月考化学试题(已下线)练习13 铁铜的获取和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)江西省南昌市新建一中2020-2021学年高一上学期第二次月考化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练(已下线)【浙江新东方】双师107专题9 第二单元 探究铁及其化合物的转化-高中化学必修第二册苏教版2019(已下线)【浙江新东方】高中化学20210304-019黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(文)试题陕西省武功县普集高级中学2021-2022学年高一上学期第二次月考化学试题湖北省咸丰春晖学校2022-2023学年高二上学期9月月考化学试题吉林江城中学2021-2022学年高三上学期9月月考化学试题浙江省丽水外国语学校高中部2021-2022学年高一下学期第一次阶段性考试(3月)化学试题山东省济南九中2022-2023学年高一第二次线上质量评估(12月份)化学试题9.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后第2课时 铁盐和亚铁盐作业(十七) 亚铁盐和铁盐(已下线)【精品卷】3.1.2 铁的重要化合物课堂例题-人教版2023-2024学年必修第一册河北省高碑店市崇德实验中学2022-2023学年高一下学期期末考试化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
名校
解题方法
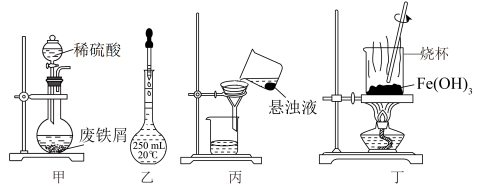
4 . 用废铁屑[主要成分为Fe和铁锈 ,还含有C等难溶于酸的杂质]为原料制备
,还含有C等难溶于酸的杂质]为原料制备 的一种实验流程如下:
的一种实验流程如下:

下列与流程相关的装置或操作正确且能达到实验目的的是
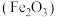 ,还含有C等难溶于酸的杂质]为原料制备
,还含有C等难溶于酸的杂质]为原料制备 的一种实验流程如下:
的一种实验流程如下:
下列与流程相关的装置或操作正确且能达到实验目的的是

| A.可在装置甲中进行“酸浸”操作 |
B.按图乙所示操作配制“酸浸”所需的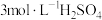 溶液 溶液 |
| C.用装置丙过滤“酸浸”后所得悬浊液 |
D.用装置丁灼烧 固体制 固体制 |
您最近一年使用:0次
2022-09-26更新
|
939次组卷
|
5卷引用:贵州省2022-2023学年高三上学期联考化学试题
贵州省2022-2023学年高三上学期联考化学试题江苏省南京市江宁区2022-2023学年高三上学期期中考试化学试题四川省泸县第一中学2022-2023学年高一上学期期末考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)江苏省常州市2022-2023学年高二下学期3月联合调研考试化学试题
名校
解题方法
5 . 下列关于 、
、 的说法错误的是
的说法错误的是
 、
、 的说法错误的是
的说法错误的是
A.配制 溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 |
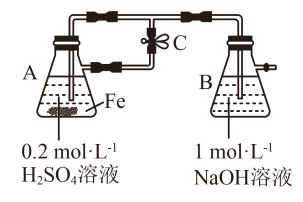
B.用如图装置可以制备 沉淀,得到的白色沉淀在A容器中 沉淀,得到的白色沉淀在A容器中 |
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象可确定溶液中含有 |
D.向 溶液中加入少量铁粉是为了防止 溶液中加入少量铁粉是为了防止 被氧化 被氧化 |
您最近一年使用:0次
2022-03-03更新
|
319次组卷
|
2卷引用:贵州省毕节市赫章县2021-2022学年高一上学期期末考试化学试题
6 . 用下面几种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,还需加入少量铁屑,原因是_____ 。
(2)除去蒸馏水中溶解的O2常采用_____ 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____ 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(4)在试管I里加入的试剂是_____ 。
(5)在试管II里加入的试剂是_____ 。
(6)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_____ 。
(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____ 。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,还需加入少量铁屑,原因是
(2)除去蒸馏水中溶解的O2常采用
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(4)在试管I里加入的试剂是
(5)在试管II里加入的试剂是
(6)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后的实验步骤是
(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
您最近一年使用:0次
2022-02-09更新
|
159次组卷
|
10卷引用:贵州省钟山区水钢实验学校2017-2018学年高一下学期期末考试化学试题
贵州省钟山区水钢实验学校2017-2018学年高一下学期期末考试化学试题人教版2017-2018学年高一化学必修1:3.2 几种重要的金属化合物 同步测试2(已下线)2018年11月8日 ——《每日一题》人教必修1铁的氢氧化物的性质和制备【全国百强校】山西省太原市第五中学2018-2019学年高一上学期12月月考化学试题云南省巧家县四中2018-2019学年高一上学期12月份考试化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题河北省石家庄市行唐县三中2020届高三11月月考化学试题安徽省芜湖市严桥中学2019-2020学年高三第一学期第三次月考化学试题(已下线)5.2.2 重要的金属化合物(第2课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)山西太原五中2023-2024学年高一上学期12月阶段性检测化学试题
7 . 已知A、B是中学常见的金属单质,其各物质间的转化关系如下图所示,请完成下列空白。
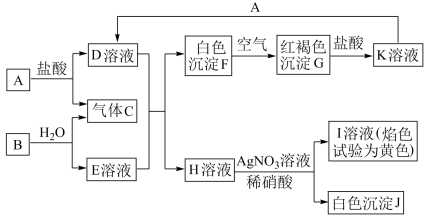
(1)写出B、C和J的化学式:B___________ ,C___________ ,J___________ 。
(2)用___________ 试剂可以检验K溶液中的阳离子。
(3)当K中混有少量D杂质时,可加入___________ 除去。
(4)写出B与水反应的离子方程式___________ 。
(5)写出F转变成G的化学方程式___________ 。
(6)写出向K溶液中加入A的离子方程式___________ 。

(1)写出B、C和J的化学式:B
(2)用
(3)当K中混有少量D杂质时,可加入
(4)写出B与水反应的离子方程式
(5)写出F转变成G的化学方程式
(6)写出向K溶液中加入A的离子方程式
您最近一年使用:0次
2022-01-27更新
|
178次组卷
|
2卷引用:贵州省铜仁市2021-2022学年高一上学期期末考试化学试题
名校
8 . 某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题。
①___________ ;②___________ ;③___________ ;④___________ ;
⑤___________ ;⑥___________ ;⑦___________ ;⑧___________ ;
(2)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是___________ ,现象依次是___________ ;请写出该鉴别过程中属于氧化还原反应的离子方程式:___________ 。
(3)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是___________ ;此过程涉及反应的化学方程式是___________ 。
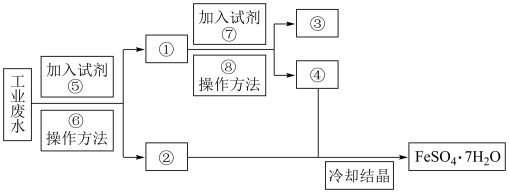
①
⑤
(2)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是
(3)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是
您最近一年使用:0次
2021-12-01更新
|
1204次组卷
|
3卷引用:贵州省清镇市博雅实验学校2023-2024学年高一上学期第四次月考化学试卷



