1 . 铁是人类较早使用的金属之一,回答下列问题。
(1)下列所含铁元素只有还原性的物质是___________ (填字母)。
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性,能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是___________ (填字母)。
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(4)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:___________ 。
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式___________ ;若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________ mol。
(1)下列所含铁元素只有还原性的物质是
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性,能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(4)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式
您最近一年使用:0次
2 . Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色Fe(OH)2,某实验小组做了如下探究实验。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、___________ 、___________ 。
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是___________ 。
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:___________ 。___________ (用离子方程式表示)。
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:___________ 。
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
①由以上实验可得到的规律是___________ 。
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为___________ (填“1.0”“1.5”或“2.0”)mol/L。
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为___________ (任写一条)。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:

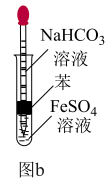
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
c(NaHCO3)/(mol/L) c(FeSO4)/(mol/L) | 1.0 | 1.5 | 2.0 | |
| 1.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 3.5 min | 9 min | 24 min | |
| 1.5 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 13 min | 15 min | 22 min | |
| 2.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率加快 | 常温下无现象,加热后产生白色沉淀 |
| 稳定时间 | 3 min | 8 min | 30 min | |
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为
您最近一年使用:0次
2024-04-16更新
|
304次组卷
|
2卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
名校
解题方法
3 . 下列方程式符合题意的是
A.实验室制备乙酸甲酯: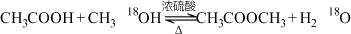 |
B. 溶于HNO3溶液中: 溶于HNO3溶液中: |
C.少量 NaHCO3与澄清石灰水反应:  |
D.Fe(OH)3和NaClO在碱性条件下反应制备 : : |
您最近一年使用:0次
名校
4 . 铁黄(FeOOH)是一种重要的化工产品.由生产钛白粉废渣(主要成分为FeSO4∙H2O,含少量TiOSO4和不溶物)制备铁黄的过程如下:
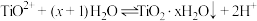
ii)Fe2+生成Fe(OH)2沉淀的pH:开始沉淀时pH=6.3,完全沉淀时pH=8.3;
Fe3+生成FeOOH沉淀的pH;开始沉淀时pH=1.5,完全沉淀时pH=2.8.
(1)纯化:加入过量铁粉的作用有:①__________ ;②__________ .
(2)制备晶种:为制备高品质铁黄产品,需先制备少量铁黄晶种.过程和现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.滴加氨水至pH为6.0时开始通空气并记录pH变化(如图).pH≈4时制得铁黄晶种.__________ .
②0~t2时段,Fe(OH)2和Fe2+转化为FeOOH制得铁黄晶种.
0~t1时段,发生化学反应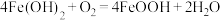 ,pH几乎不变;
,pH几乎不变;
t1~t2时段,pH明显降低.用离子方程式 解释pH明显降低的原因:__________ .
(3)产品纯度测定:铁黄(FeOOH)纯度可以通过产品的耗酸量确定,实验过程如下:
wg铁黄 溶液X
溶液X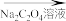 溶液Y
溶液Y 滴定
滴定
资料: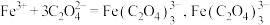 不与稀碱溶液反应;
不与稀碱溶液反应;
①用NaOH标准溶液测定溶解过程中剩余的酸,当溶液中的酸恰好被NaOH完全中和时,酚酞由无色变为浅粉色(pH在8~10范围),消耗b mol∙L-1的NaOH标准溶液V2mL,则所得铁黄样品的纯度为__________ ;(写出必要的计算过程)
②若Na2C2O4过量,会使测定结果__________ (填“偏大”“偏小”或“不受影响”);

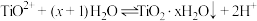
ii)Fe2+生成Fe(OH)2沉淀的pH:开始沉淀时pH=6.3,完全沉淀时pH=8.3;
Fe3+生成FeOOH沉淀的pH;开始沉淀时pH=1.5,完全沉淀时pH=2.8.
(1)纯化:加入过量铁粉的作用有:①
(2)制备晶种:为制备高品质铁黄产品,需先制备少量铁黄晶种.过程和现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.滴加氨水至pH为6.0时开始通空气并记录pH变化(如图).pH≈4时制得铁黄晶种.
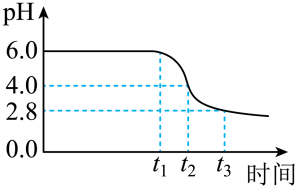
②0~t2时段,Fe(OH)2和Fe2+转化为FeOOH制得铁黄晶种.
0~t1时段,发生化学反应
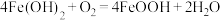 ,pH几乎不变;
,pH几乎不变;t1~t2时段,pH明显降低.用
(3)产品纯度测定:铁黄(FeOOH)纯度可以通过产品的耗酸量确定,实验过程如下:
wg铁黄
 溶液X
溶液X 溶液Y
溶液Y 滴定
滴定资料:
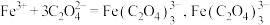 不与稀碱溶液反应;
不与稀碱溶液反应;①用NaOH标准溶液测定溶解过程中剩余的酸,当溶液中的酸恰好被NaOH完全中和时,酚酞由无色变为浅粉色(pH在8~10范围),消耗b mol∙L-1的NaOH标准溶液V2mL,则所得铁黄样品的纯度为
②若Na2C2O4过量,会使测定结果
您最近一年使用:0次
名校
解题方法
5 . 某小组同学为了获取在 制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。

【进行实验】
实验步骤:
I.向瓶中加入饱和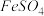 溶液,按图1所示连接装置;
溶液,按图1所示连接装置;
II.打开磁力搅拌器,立即加入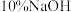 溶液;
溶液;
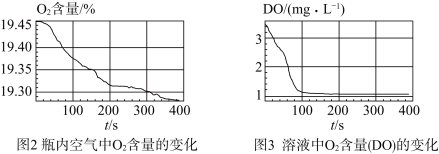
III.采集瓶内空气中 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:
【解释与结论】
(1)盛放 的仪器为
的仪器为_________________ 。
(2)搅拌的目的是_________________ 。
(3)生成白色沉淀的离子方程式是_________________ 。
(4)红褐色沉淀是_________________ 。
(5)通过上述实验,可得到“在 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是_________________ 。
(6)结合上述实验,提出制备 过程中应注意的事项
过程中应注意的事项_________________ (回答一项即可)。
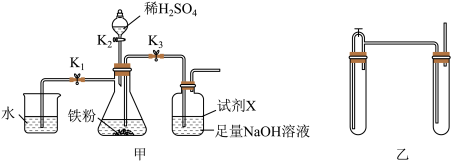
(7)某实验小组用如图甲所示装置制备 。下列说法正确的是( )
。下列说法正确的是( )
 制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
【进行实验】
实验步骤:
I.向瓶中加入饱和
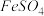 溶液,按图1所示连接装置;
溶液,按图1所示连接装置;II.打开磁力搅拌器,立即加入
 溶液;
溶液;III.采集瓶内空气中
 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:

【解释与结论】
(1)盛放
 的仪器为
的仪器为(2)搅拌的目的是
(3)生成白色沉淀的离子方程式是
(4)红褐色沉淀是
(5)通过上述实验,可得到“在
 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是(6)结合上述实验,提出制备
 过程中应注意的事项
过程中应注意的事项(7)某实验小组用如图甲所示装置制备
 。下列说法正确的是( )
。下列说法正确的是( )
| A.甲装置在使用前需检查气密性 |
B.实验时打开旋塞的顺序依次为 |
| C.试剂X可选用植物油,其主要作用是隔绝空气 |
D.甲选用装置中除水外的药品,可用乙装置代替甲装置制备 |
您最近一年使用:0次
6 . Ⅰ.某小组利用数字化实验模拟制备Fe(OH)2并探究其相关性质。
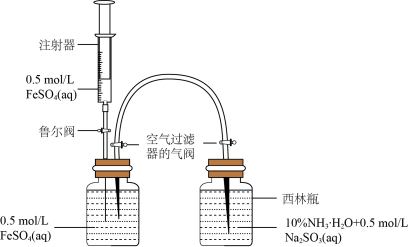
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是_____ ,Na2SO3的作用是_____ 。
(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化, 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。

对比ab、bc段溶解氧的消耗速率,可以得出什么结论_____ 。
(3)已知:在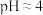 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且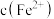 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因_____ ,检验反应后的溶液中是否存在 ,可以选择的试剂是
,可以选择的试剂是_____ 。
A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是_____ 。
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是

(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化,
 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。
对比ab、bc段溶解氧的消耗速率,可以得出什么结论
(3)已知:在
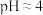 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且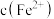 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因 ,可以选择的试剂是
,可以选择的试剂是A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
 |  |  |  |
| A.称量 | B.转移 | C、定容 | D、摇匀 |
| A.A | B.B | C.C | D.D |
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
您最近一年使用:0次
解题方法
7 . 元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。

请回答以下问题:
(1)K2FeO4中Fe的化合价为_____ 。
(2) 是一种新型水处理剂,将
是一种新型水处理剂,将 溶液、
溶液、 溶液与
溶液与 溶液混合可得到
溶液混合可得到 ,发生相应反应的离子方程式为
,发生相应反应的离子方程式为_____ ,当有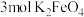 生成时,反应中转移的电子数目为
生成时,反应中转移的电子数目为_____  。
。
(3)Fe2O3是否为碱性氧化物_____ (填是或否),理由:_____ 。
(4)制备氢氧化亚铁时,观察到白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释该现象:_____ ,其中检验溶液中Fe3+的试剂是KSCN溶液,该反应的离子方程式为:_____ 。

请回答以下问题:
(1)K2FeO4中Fe的化合价为
(2)
 是一种新型水处理剂,将
是一种新型水处理剂,将 溶液、
溶液、 溶液与
溶液与 溶液混合可得到
溶液混合可得到 ,发生相应反应的离子方程式为
,发生相应反应的离子方程式为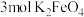 生成时,反应中转移的电子数目为
生成时,反应中转移的电子数目为 。
。(3)Fe2O3是否为碱性氧化物
(4)制备氢氧化亚铁时,观察到白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释该现象:
您最近一年使用:0次
名校
解题方法
8 . A常温常压下为无色液体,B、C是无色无味的气体,M、R是两种常见的金属,且M是地壳中含量最多的金属元素的单质,T是淡黄色固体,E是具有磁性的黑色晶体,G和H组成元素相同。各物质在一定条件下有如下转化关系。
(1)物质T的电子式为____________ 。16.8g R与足量的A反应生成E和B转移的电子数目为___________ (用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(2)D和M在溶液中反应生成B的离子反应方程式为___________________________ 。
(3)G向H转化的实验现象为________________________ 。
(4)T和F反应只生成C、H和一种盐,其化学反应方程式为__________________ 。
(5)若向E和R的混合物中加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,生成 并放出448mL(标准状况)气体。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为
并放出448mL(标准状况)气体。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为____________ g。

(1)物质T的电子式为
 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(2)D和M在溶液中反应生成B的离子反应方程式为
(3)G向H转化的实验现象为
(4)T和F反应只生成C、H和一种盐,其化学反应方程式为
(5)若向E和R的混合物中加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,生成
 并放出448mL(标准状况)气体。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为
并放出448mL(标准状况)气体。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为
您最近一年使用:0次
9 . 某同学利用如图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
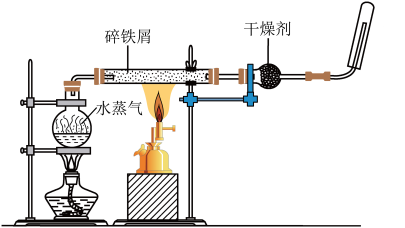
(1)试管中发生反应的化学方程式为___________ 。
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是___________ (只有一个选项符合题意),若溶液未变红,则试管中固体是___________ (只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关反应的化学方程式___________ 。
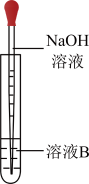
(4)一段时间后,该同学发现(2)中未变红的溶液变成红色。由此可知,实验室FeCl2溶液需现用现配的原因是___________ ,并且配制时应加入少量___________ 。

(1)试管中发生反应的化学方程式为
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关反应的化学方程式

(4)一段时间后,该同学发现(2)中未变红的溶液变成红色。由此可知,实验室FeCl2溶液需现用现配的原因是
您最近一年使用:0次
解题方法
10 . 在稀硫酸中加入适量铁粉,反应完全后再加入适量NaOH溶液,放置片刻,从反应体系中观察到颜色的变化是
| A.无色→灰绿→红褐 | B.无色→白色→浅绿→灰绿→红褐 |
| C.无色→浅绿→白色→灰绿→红褐 | D.无色→白色→红褐 |
您最近一年使用:0次



