名校
解题方法
1 . 常温下,铝土矿 含有
含有 、FeO、
、FeO、 、
、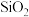 等物质
等物质 用硫酸浸。下列说法中错误的是
用硫酸浸。下列说法中错误的是

 含有
含有 、FeO、
、FeO、 、
、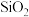 等物质
等物质 用硫酸浸。下列说法中错误的是
用硫酸浸。下列说法中错误的是

A.向浸出后的溶液加入过量NaOH溶液后存在: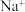 、 、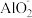 、 、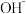 、 、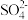 |
B.向浸出后的溶液加入过量氨水后存在: 、 、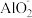 、 、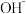 、 、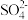 |
C.向浸出后的溶液通入过量HI后存在: 、 、 、 、 、 、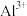 、 、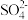 |
D.若铝土矿改用NaOH溶液浸,浸出后的溶液中存在: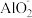 、 、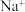 、 、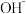 、 、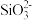 |
您最近一年使用:0次
2020-02-06更新
|
241次组卷
|
6卷引用:夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用(提升练)
2 . 工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
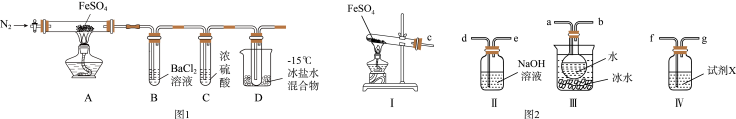
实验一:高温分解FeSO4,利用如图1所示的实验装置进行实验。
已知:①SO2熔点为-72℃,沸点为-10℃;②SO3熔点为-16.8℃,沸点为44.8℃。
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是___ 。
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为___ ,同时有两种无色气体生成,写出该反应的化学方程式___ 。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是___ ,将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是___ 。
实验二:探究高温分解FeSO4生成的气体
(4)用如图2所示装置设计实验,验证高温分解FeSO4生成的气态物质
①按气流方向连接各仪器,用字母表示接口的连接顺序:c-___ 。
②试剂X的名称是___ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的FeSO4的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量__ g。

实验一:高温分解FeSO4,利用如图1所示的实验装置进行实验。
已知:①SO2熔点为-72℃,沸点为-10℃;②SO3熔点为-16.8℃,沸点为44.8℃。
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是
实验二:探究高温分解FeSO4生成的气体
(4)用如图2所示装置设计实验,验证高温分解FeSO4生成的气态物质
①按气流方向连接各仪器,用字母表示接口的连接顺序:c-
②试剂X的名称是
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的FeSO4的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量
您最近一年使用:0次
3 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是

| 选项 | 实验 | 现象 | 结论 |
| A | 向2mL  的 的 溶液中加足量铁粉,振荡,加1滴KSCN溶液 溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: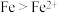 |
| B | 往 溶液中通入足量 溶液中通入足量 气体 气体 | 产生白色胶状沉淀 | 酸性: |
| C | 常温下将铝片加入浓硝酸中 | 无明显现象 | 铝与浓硝酸不反应 |
| D | 将 溶液滴加到酸性 溶液滴加到酸性 溶液中 溶液中 | 紫色溶液褪色 |  具有氧化性 具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 下列离子方程式错误的是
A.用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+=H2SiO3(胶体 |
| B.FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| C.少量NaHSO4溶液与Ba(OH)2溶液反应:H++OH-+SO42-+Ba2+=H2O+BaSO4↓ |
| D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
您最近一年使用:0次
名校
5 . 关于反应过程中的先后顺序,下列评价正确的是
| A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应 |
| B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成 |
| C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应 |
| D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应 |
您最近一年使用:0次
2019-12-24更新
|
399次组卷
|
20卷引用:专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升
专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)模块四 金属及其化合物(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)【全国省级联考】辽宁省部分重点高中2019届高三9月联考化学试题【全国百强校】四川省成都市双流区棠湖中学2019届高三上学期第一次月考理科综合化学试题山东省济南市济钢高中2019届高三上学期10月份质量检测化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题河北省隆化县存瑞中学2020届高三上学期第一次质检化学试题山东省济宁市2020届高三10月月考化学试卷山东省济宁市邹城第一中学2020届高三10月月考化学试题山东省莱阳市第一中学2020届高三10月月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题河南省信阳市罗山县高级中学老校区2020届高三第七次模拟考试化学试题辽宁省朝阳市建平县第二高级中学2020届高三上学期期中考试化学试题河北省石家庄市行唐县三中2020届高三11月月考化学试题甘肃省张掖市第二中学2020届高三上学期11月月考化学试题甘肃省武威第一中学2020届高三12月月考化学试题山东省日照市五莲县2020届高三上学期10月模块诊断性测试化学试题辽宁省抚顺市第十中学2018-2019学年高二下学期期中考试化学试题河北省安平中学2019-2020学年高一上学期第四次月考化学试题江西省南昌市进贤一中2019-2020学年高一上学期第二次月考化学试题
2019高三·全国·专题练习
6 . 某同学为了验证Fe3+是否能将H2SO3氧化成SO42-,用50 mL 0.1 mol·L-1 FeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:
(1)检验吸收液中的SO42-操作为_____________________________________________ ,证明Fe3+能够把H2SO3氧化成SO42-。
(2)请配平并完成上述反应中的化学方程式:2FeCl3+SO2+________ =________ +H2SO4+________ ,反应中的氧化产物是________ (写化学式)。
(3)吸收液中除了含有H+、Cl-、SO42-以外,对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe2+;
假设2:溶液中存在Fe3+、Fe2+;
假设3:溶液中存在_____________________________________________________ 。
②设计方案,进行实验,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1 mol·L-1 KMnO4溶液、0.1 mol·L-1 KSCN溶液、品红稀溶液。
(1)检验吸收液中的SO42-操作为
(2)请配平并完成上述反应中的化学方程式:2FeCl3+SO2+
(3)吸收液中除了含有H+、Cl-、SO42-以外,对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe2+;
假设2:溶液中存在Fe3+、Fe2+;
假设3:溶液中存在
②设计方案,进行实验,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1 mol·L-1 KMnO4溶液、0.1 mol·L-1 KSCN溶液、品红稀溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3 mL,并滴入 | 若出现红色,则假设2成立,1、3不成立;若未出现红色,则假设2不成立,假设1或3成立 |
| 步骤2: | |
| 步骤3: |
您最近一年使用:0次
解题方法
7 . FeCl3溶液是实验室中使用较为广泛的一种试剂,下列有关FeCl3溶液的作用或实验现象解释合理的是( )
| A.FeCl3溶液使蓝色石蕊试纸变红:Fe3++3H2O=3H++Fe(OH)3 |
| B.检测FeCl3溶液中的Fe3+用KSCN溶液:Fe3++3SCN-⇌Fe(SCN)3 |
| C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Cu2++Fe2+ |
| D.向FeCl3溶液中滴加氨水出现红褐色沉淀:Fe3++3OH-=Fe(OH)3↓ |
您最近一年使用:0次
名校
8 . 下列有关物质性质与用途具有对应关系的是
| A.SO2具有氧化性,可用于漂白纸浆 |
| B.Si的熔点高,可用作半导体材料 |
| C.FeCl3溶液显酸性,可用于蚀刻铜制的电路板 |
| D.漂白液中含有强氧化性物质,可作漂白剂和消毒剂 |
您最近一年使用:0次
2019-11-19更新
|
323次组卷
|
4卷引用:2020届高三《新题速递·化学》12月第01期(考点01-06)
名校
9 . 下列说法中正确的是( )
| A.除去NaCl固体中的少量KNO3,将固体溶解后蒸发结晶,趁热过滤,洗涤,干燥 |
| B.FeCl3可用于腐蚀Cu刻制印刷电路板,这说明铁的金属性比铜强 |
| C.配制质量分数为20 %的NaOH溶液时,需要用到的玻璃仪器为容量瓶、烧杯、玻璃棒 |
| D.工业上用氯气和石灰水反应制漂白粉,保存漂白粉的塑料袋要密封 |
您最近一年使用:0次
2019-11-15更新
|
217次组卷
|
4卷引用:2020届高三化学大二轮增分强化练——卤素及其化合物
名校
10 . 在100 mL FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有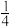 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
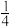 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )| A.4 mol • L-1 | B. mol • L-1 mol • L-1 | C.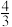 mol • L-1 mol • L-1 | D.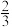 mol • L-1 mol • L-1 |
您最近一年使用:0次
2019-11-05更新
|
347次组卷
|
2卷引用:2019年秋高三化学复习强化练习—— 氧化还原反应



