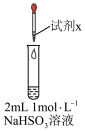
1 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Cu+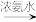 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为___________ 。
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是___________ 。
②实验表明假设b合理,实验I反应的离子方程式有___________ 、 。
。
(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-___________ 。
下述实验III证实了假设合理,装置如下图。___________ (补全实验操作及现象)。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和 。
。
①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是___________ 。___________ 。
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:___________ 。
| 实验 | 装置 | 试剂x | 操作及现象 |
| I |
| 1 mol/LCuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅 |
| II | 1 mol/LCuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化 |
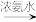 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
 。
。(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-
下述实验III证实了假设合理,装置如下图。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和
 。
。①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:
您最近一年使用:0次
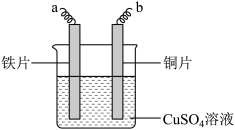
2 . I.NaHSO3、CuSO4为实验室常用的化学试剂,均易溶于水,且水溶液显酸性。在铁片镀铜实验中,为提高电镀效果,常用CuSO4溶液作为电镀液。装置如图所示,a接电源_____ 极,阳极的电极反应式为:_____ 。电镀过程中c(Cu2+)_____ (填“基本不变”、“变大”或“变小”)。
II.某实验小组对NaHSO3溶液分别与CuSO4、CuCl2溶液的反应进行探究。
(1)推测实验B产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_____ ,反应的离子方程式为_____ 。
(2)对实验B产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是_____ ;
②实验表明假设b合理,实验B反应的离子方程式有_____ 、H++HSO =SO2↑+H2O。
=SO2↑+H2O。
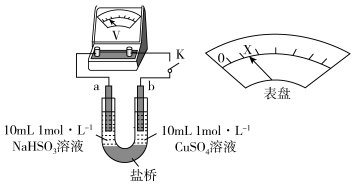
(3)对比实验A、B,提出假设:Cl-增强了Cu2+的氧化性。下述实验C证实了假设合理,装置如图(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_____________________________________ (补全实验操作及现象)。
(4)将实验A的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO 。已知:
。已知:
I.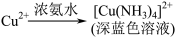 ;
;
II.
III.Cu2O是一种红色粉末状固体,几乎不溶于水,但溶于氨水,形成稳定的、无色的配合物[Cu(NH3)2]+。
①通过实验D证实红色沉淀中含有Cu+和Cu2+。
实验D: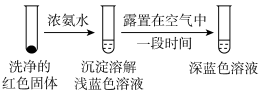
证实红色沉淀中含有Cu+的实验证据是_____ ;
②有同学认为实验D不足以证实红色沉淀中含有Cu2+,设计实验D的对比实验E,证实了Cu2+的存在。实验E的方案和现象是_____ 。(要求:用图示表示,参照实验D)

II.某实验小组对NaHSO3溶液分别与CuSO4、CuCl2溶液的反应进行探究。
| 实验 | 装置 | 试剂x | 操作及现象 |
A | 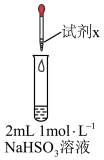 | 1mol·L−1CuSO4溶液 | 加入2mLCuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
B | 1mol·L−1CuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
(2)对实验B产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验B反应的离子方程式有
 =SO2↑+H2O。
=SO2↑+H2O。(3)对比实验A、B,提出假设:Cl-增强了Cu2+的氧化性。下述实验C证实了假设合理,装置如图(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管

(4)将实验A的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO
 。已知:
。已知:I.
 ;
;II.

III.Cu2O是一种红色粉末状固体,几乎不溶于水,但溶于氨水,形成稳定的、无色的配合物[Cu(NH3)2]+。
①通过实验D证实红色沉淀中含有Cu+和Cu2+。
实验D:

证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验D不足以证实红色沉淀中含有Cu2+,设计实验D的对比实验E,证实了Cu2+的存在。实验E的方案和现象是
您最近一年使用:0次
名校
解题方法
3 . 向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
| A.Cu2+是H2O2分解反应的催化剂 |
| B.Cu2+将H2O2还原为O2 |
| C.H2O2既表现氧化性又表现还原性 |
| D.发生了反应:Cu2O+H2O2+4H+=2Cu2++3H2O |
您最近一年使用:0次
2021-06-23更新
|
3172次组卷
|
39卷引用:北京市西城区2018届高三4月一模理综化学试题
北京市西城区2018届高三4月一模理综化学试题北京市北京师范大学附属中学2020—2021学年高一上学期期中考试化学试题北京师范大学附属中学2021-2022学年高一上学期期中考试化学试题北京市第三十五中学2021-2022学年高一上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2019届高三上学期第一次月考化学试题福建省尤溪县第一中学2019届高三第一学期第一次月考化学试题【区级联考】天津市河东区2019届高三高考一模考试化学试题河南省洛阳市第一高级中学2019-2020学年高一9月月考化学试题河北省辛集中学2020届高三9月月考化学试题(已下线)【新东方】2020-18安徽省淮南市寿县一中2020 届高三素质测试化学试题湖南省长沙市雅礼中学2020届高三上学期第2次月考化学试题(已下线)第三节 氧化还原反应(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)湖南省常德市第二中学2021届高三上学期开学考试化学试题(已下线)第1章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)江西省上饶市万年中学2020-2021学年高一上学期期中考试化学试题河北省保定市定州市第二中学2020-2021学年高一上学期11月月考化学试题天津市静海区第一中学2020-2021学年高一12月考化学试题上海市普陀区2021届高三二模化学试题河北省石家庄二中2020-2021学年高一第二学期6月月考化学试题(已下线)专题1.3.1 氧化还原反应(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题卷二 氧化还原反应(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题江西省高安中学2021-2022学年高一上学期期中考试化学试题河南省名校联盟2021-2022学年高三上学期第三次诊断考试化学试题(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)吉林省吉林市第一中学2021-2022学年高二下学期(平行班)期中考试化学试题(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2023年高考化学一轮复习考点微专题陕西省西安高新第一中学2022-2023学年高一上学期期中考试化学试题天津市第四十七中学2021-2022学年高一上学期第二次月考化学试题天津市北辰区四十七中学2022-2023高一上学期期末考试化学试题山东省菏泽第一中学2022-2023学年高一上学期期末考试化学试题(已下线)题型49 臭氧和过氧化氢 环境保护(已下线)【2023】【高一下】【其他】【杭二中-期中复习卷】【高中化学】【邵威宏收集】安徽省安庆市第一中学2023-2024学年高一上学期第一次阶段测化学试题四川省眉山市彭山区第一中学2023-2024学年高一上学期10月月考化学试题天津市滨海新区塘沽第一中学2022届高三毕业班第三次月考化学试题
名校
4 . 化学小组同学学习了  与
与  反应后,猜想
反应后,猜想  也能与
也能与  发生反应。为了验证猜想,进行实验。
发生反应。为了验证猜想,进行实验。
(1)【实验探究】
【实验假设】
甲同学分析了实验Ⅰ无明显现象的原因,做出如下假设:
假设 : 由于反应温度较低,导致
: 由于反应温度较低,导致  氧化性较弱。假设
氧化性较弱。假设  : 由于
: 由于_____________ ,导致  氧化性较弱。(补全假设
氧化性较弱。(补全假设  )
)
针对上述假设,甲同学继续进行如下实验:
【实验探究】
实验结果:实验Ⅰ和实验Ⅱ均未检测出  。
。
(2)【实验探究】
乙同学用 溶液代替
溶液代替  溶液进行实验:
溶液进行实验:
实验 Ⅳ中发生的离子反应方程式为_____________ 。
(3)【实验改进】
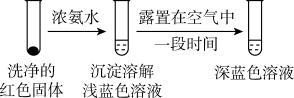
乙同学针对实验 Ⅰ进行改进,设计并完成实验Ⅴ: 向试管 中加入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。
中加入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。
乙同学因此得出结论: 对
对  与
与  发生反应有促进作用。
发生反应有促进作用。
①丙同学认为通过实验Ⅴ不能得出乙同学的结论,原因是_____________ 。
②丙同学继续设计实验:_____________ (填操作和现象),证实了乙同学结论合理。
(4)【结论分析】
综合上述实验可知, 能否氧化
能否氧化  与
与_____________ 有关。
 与
与  反应后,猜想
反应后,猜想  也能与
也能与  发生反应。为了验证猜想,进行实验。
发生反应。为了验证猜想,进行实验。(1)【实验探究】
实验Ⅰ |
|
甲同学分析了实验Ⅰ无明显现象的原因,做出如下假设:
假设
 : 由于反应温度较低,导致
: 由于反应温度较低,导致  氧化性较弱。假设
氧化性较弱。假设  : 由于
: 由于 氧化性较弱。(补全假设
氧化性较弱。(补全假设  )
)针对上述假设,甲同学继续进行如下实验:
【实验探究】
序号 | 实验 | 加入试剂或操作 |
实验Ⅱ |
| 加热试管 |
实验Ⅲ | 加入 |
 。
。(2)【实验探究】
乙同学用
 溶液代替
溶液代替  溶液进行实验:
溶液进行实验:实验Ⅳ |
|
(3)【实验改进】
乙同学针对实验 Ⅰ进行改进,设计并完成实验Ⅴ: 向试管
 中加入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。
中加入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。乙同学因此得出结论:
 对
对  与
与  发生反应有促进作用。
发生反应有促进作用。①丙同学认为通过实验Ⅴ不能得出乙同学的结论,原因是
②丙同学继续设计实验:
(4)【结论分析】
综合上述实验可知,
 能否氧化
能否氧化  与
与
您最近一年使用:0次
名校
解题方法
5 . 实验小组探究KI与Cu(NO3)2的反应,进行实验一:
实验一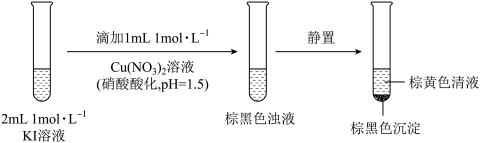
注:本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______ 溶液(试剂a),清液变为______ 色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL______ 溶液(硝酸酸化,pH=1.5),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成I2的原因是酸性条件下,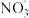 氧化了I-。
氧化了I-。
②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除____________ 氧化I-的可能性。
③若要确证实验一中是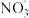 氧化了I-,应在实验一的基础上进行检验
氧化了I-,应在实验一的基础上进行检验______ 的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b._________ 吸附I2。为证明上述假设是否成立,取棕黑色沉淀进行实验二:
实验二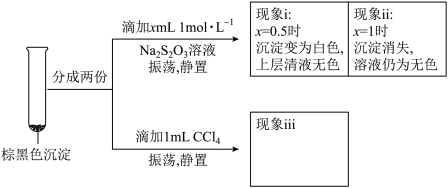
已知:CuI难溶于CCl4;I2+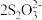 ==2I-+
==2I-+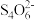 (无色);Cu++S2O32-==
(无色);Cu++S2O32-==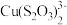 (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
(无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
②现象iii为______________ 。
③用化学平衡移动原理解释产生现象ii的原因:________________ 。
实验一

注:本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量
(2)探究生成I2的原因。
①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL
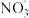 氧化了I-。
氧化了I-。②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除
③若要确证实验一中是
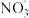 氧化了I-,应在实验一的基础上进行检验
氧化了I-,应在实验一的基础上进行检验(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b.
实验二

已知:CuI难溶于CCl4;I2+
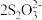 ==2I-+
==2I-+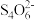 (无色);Cu++S2O32-==
(无色);Cu++S2O32-==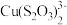 (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
(无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。②现象iii为
③用化学平衡移动原理解释产生现象ii的原因:
您最近一年使用:0次
2020-05-02更新
|
377次组卷
|
2卷引用:北京市101中学2019-2020学年高三化学统考三
6 . 向CuSO4酸性溶液中加入H2O2溶液,很快有大量气体逸出,同时放热。一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法不正确 的是( )
| A.逸出气体的主要成分是O2 | B.H2O2既表现氧化性又表现还原性 |
| C.Cu2+将H2O2还原 | D.发生了反应Cu2O+H2O2+4H+=2Cu2++3H2O |
您最近一年使用:0次
2018-06-16更新
|
380次组卷
|
2卷引用:【全国百强校】北京四中2017-2018学年高一下学期期中考试(选考)化学试题
7 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Ⅰ.Cu2+ [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
Ⅱ. Cu+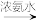 [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液)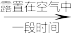 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_______ ,反应的离子方程式为_______ 。
(2)对实验Ⅰ产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是_______ ;
②实验表明假设b合理,实验I反应的离子方程式有_____ 、H++ HSO3-= SO2↑+H2O。
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_______ (补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32−。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ: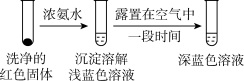
证实红色沉淀中含有Cu+的实验证据是_______ ;
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:_______ 。
| 实验 | 装置 | 试剂x | 操作及现象 |
| Ⅰ | 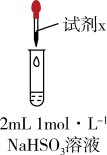 | 1 mol·L−1CuCl2溶液 | 加入2mL CuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| Ⅱ | 1 mol·L−1CuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
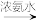 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)Ⅱ. Cu+
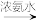 [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到
(2)对实验Ⅰ产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管

(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32−。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ:

证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:
您最近一年使用:0次
2020-01-13更新
|
290次组卷
|
4卷引用:北京市朝阳区2020届高三上学期期末教学统一检测化学试题
解题方法
8 . 室温下,某实验小组探究等量且表面积相同的镁条与硫酸铜溶液的反应。(注:反应前镁条用砂纸打磨除去表面氧化膜且镁条过量)
(1)实验Ⅰ中生成的无色无味气体的主要成分是________ ,产生原因是_________ (用简单文字和离子方程式表示)。设计实验Ⅲ的目的是________ 。
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因_________ 。由实验Ⅳ可以推测,黑褐色不溶物中还含有_______ 。残余固体加入浓硝酸时,反应的化学方程式是________ 。
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜【Cu2(OH)2SO4】是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是【Cu2(OH)2SO4】;
ii.是Cu(OH)2和【Cu2(OH)2SO4】的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立________ 。
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与__________ 有关。
| 实验 | 操作 | 实验现象 |
| Ⅰ | 4mL 0.1mol/LCuSO4溶液(pH约为4.2) | 1.有无色无味气体生成 2.镁条表面逐渐生成大量黑褐色膨松状不溶物 3.反应一段时间后,溶液逐渐变浑浊,有蓝绿色沉淀生成 |
| Ⅱ |  4mL 0.5mol/LCuSO4溶液(pH约为3.6) | 1.有大量无色无味气体生成 2.镁条表面逐渐生成红褐色不溶物 3.反应一段时间后,溶液中逐渐有蓝绿色沉淀生成,镁条上红褐色物质脱落,有光亮的红色物质生成 |
| Ⅲ | 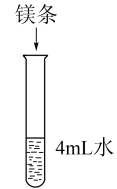 | 开始无明显现象,一段时间后产生微量无色无味气体 |
(1)实验Ⅰ中生成的无色无味气体的主要成分是
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
| 实验 | 操作 | 实验现象 |
Ⅳ | 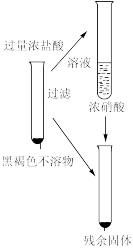 | 1.加入浓盐酸后,沉淀部分溶解。溶液为黄色 2.多次洗涤后的残余固体加入浓硝酸,有大量红棕色气体生成,溶液变为蓝色 |
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜【Cu2(OH)2SO4】是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是【Cu2(OH)2SO4】;
ii.是Cu(OH)2和【Cu2(OH)2SO4】的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与
您最近一年使用:0次
9 . 某课外小组探究Cu(Ⅱ)盐与 溶液的反应。
溶液的反应。
【查阅资料】
i.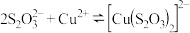 (绿色)
(绿色)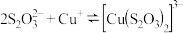 (无色);
(无色);
ii.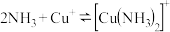 (无色),
(无色), 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);
(蓝色);
iii. 易被氧化为
易被氧化为 或
或 。
。
【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与 可能会发生两种反应。
可能会发生两种反应。
假设1: 与
与 在溶液中发生络合反应生成
在溶液中发生络合反应生成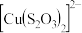 ;
;
假设2:Cu(Ⅱ)有___________ 性,与 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究 与
与 溶液的反应。
溶液的反应。
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是___________ (填化学符号)。
(2)甲同学认为实验一能证明假设2成立,他的理由是___________ 。
实验二:探究 与
与 溶液的反应。
溶液的反应。

(3)乙同学利用已知资料进一步确证了实验二的无色溶液中存在Cu(Ⅰ)。他的实验方案是:取少量无色溶液,___________ 。
(4)经检验白色沉淀为CuCl,从化学平衡的角度解释继续加 溶液后CuCl沉淀溶解的原因:
溶液后CuCl沉淀溶解的原因:___________ 。
(5)经检验氧化产物以 形式存在。写出
形式存在。写出 与
与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
【获得结论】
综合以上实验,同学们认为Cu(Ⅱ)盐与 在液中的反应与多种因素有关,得到实验结论:
在液中的反应与多种因素有关,得到实验结论:
①随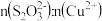 的增大,
的增大,___________ ;
②___________ 。
 溶液的反应。
溶液的反应。【查阅资料】
i.
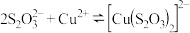 (绿色)
(绿色)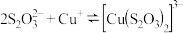 (无色);
(无色);ii.
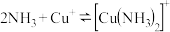 (无色),
(无色), 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);
(蓝色);iii.
 易被氧化为
易被氧化为 或
或 。
。【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与
 可能会发生两种反应。
可能会发生两种反应。假设1:
 与
与 在溶液中发生络合反应生成
在溶液中发生络合反应生成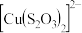 ;
;假设2:Cu(Ⅱ)有
 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。【实验操作及现象分析】
实验一:探究
 与
与 溶液的反应。
溶液的反应。| 实验操作 | 实验序号h |  (mL) (mL) |  (mL) (mL) | 逐滴加入 溶液时的实验现象 溶液时的实验现象 |
 | a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
(2)甲同学认为实验一能证明假设2成立,他的理由是
实验二:探究
 与
与 溶液的反应。
溶液的反应。
(3)乙同学利用已知资料进一步确证了实验二的无色溶液中存在Cu(Ⅰ)。他的实验方案是:取少量无色溶液,
(4)经检验白色沉淀为CuCl,从化学平衡的角度解释继续加
 溶液后CuCl沉淀溶解的原因:
溶液后CuCl沉淀溶解的原因:(5)经检验氧化产物以
 形式存在。写出
形式存在。写出 与
与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:【获得结论】
综合以上实验,同学们认为Cu(Ⅱ)盐与
 在液中的反应与多种因素有关,得到实验结论:
在液中的反应与多种因素有关,得到实验结论:①随
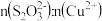 的增大,
的增大,②
您最近一年使用:0次
2021-04-09更新
|
1081次组卷
|
12卷引用:北京市海淀区2021届高三一模化学试题
北京市海淀区2021届高三一模化学试题北京一零一中学2021-2022学年高三上学期 9月开学练习化学试题北京市回民学校2022届高三下学期统测化学试题北京一零一中学2022-2023学年高三上学期统练六化学试题(已下线)北京市海淀区2022届高三一模(实验探究题)北京市广渠门中学2023-2024学年高三上学期开学考试化学试题北京市第二中学2023-2024学年高三上学期期中测试化学试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题福建省厦门英才学校2021届高三4模考试化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)福建省厦门双十中学2021-2022学年高二下学期3月月考化学试题(已下线)题型53 创新探究类实验题
10 . 某研究小组探究CuSO4溶液和弱酸盐的反应。
【资料】H2S2O3是一种弱酸,易分解为SO2和S。
(1)实验I中过程i产生的蓝色絮状沉淀为Cu(OH)2,同时产生的少量气泡主要成分是_______ 。
(2)实验Ⅱ中过程ii产生的天蓝色粉末状沉淀中肯定含有的阴离子是_______ 。
(3)对比实验Ⅰ、Ⅱ中过程ii,II中产生气泡明显更快的原因是_______ 。
(4)实验Ⅲ中,经检验产生的黑色沉淀为CuS。推测CuS的产生原因。
推测1. 酸性条件下,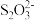 发生分解,随后分解产物再与Cu2+产生CuS;
发生分解,随后分解产物再与Cu2+产生CuS;
推测2. 酸性条件下,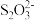 与Cu2+直接反应产生CuS,同时有
与Cu2+直接反应产生CuS,同时有 生成。
生成。
经实验及理论证明推测1和推测2均合理。
①证明推测1合理,应设计的实验方案是_______ 。
②推测2发生反应的离子方程式是_______ 。
③从化学反应速率和限度的角度解释酸性条件下,Na2S2O3溶液与CuSO4溶液酸性条件下反应,实验现象中反应初期产生黄色沉淀,反应中后期产生黑色沉淀的原因_______ 。
【资料】H2S2O3是一种弱酸,易分解为SO2和S。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 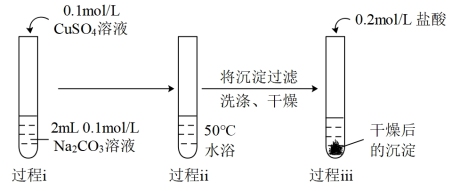 | 过程ⅰ:立即产生蓝色絮状沉淀,继续滴加至1mL,沉淀增多且蓝色加深,并出现少量气泡。 过程ⅱ:产生气泡增多且速率明显加快,蓝色絮状沉淀沉降在试管底部。 过程ⅲ:沉淀溶解并有极少量的气泡生成。 |
| Ⅱ | 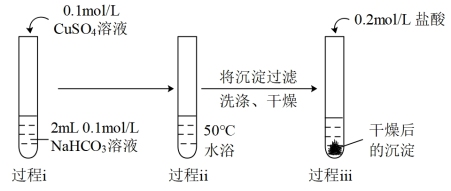 | 过程ⅰ:立即产生浅蓝绿色絮状沉淀,继续滴加至1mL,沉淀增多且蓝绿色加深,并出现少量气泡。 过程ⅱ:产生的气泡比实验Ⅰ过程ⅱ增加更多更快,最终得到天蓝色粉末状沉淀。 过程ⅲ:沉淀溶解并有较多气泡生成。 |
| Ⅲ | 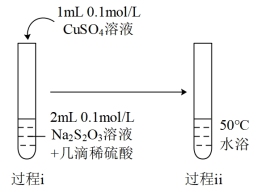 | 过程ⅰ:较快出现淡黄色悬浮物。 过程ⅱ:黄色逐渐加深,依次变为土黄色、棕色,最终变为黑色,同时产生刺激性气味气体,且通入品红试剂出现溶液褪色现象。 |
(2)实验Ⅱ中过程ii产生的天蓝色粉末状沉淀中肯定含有的阴离子是
(3)对比实验Ⅰ、Ⅱ中过程ii,II中产生气泡明显更快的原因是
(4)实验Ⅲ中,经检验产生的黑色沉淀为CuS。推测CuS的产生原因。
推测1. 酸性条件下,
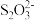 发生分解,随后分解产物再与Cu2+产生CuS;
发生分解,随后分解产物再与Cu2+产生CuS;推测2. 酸性条件下,
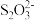 与Cu2+直接反应产生CuS,同时有
与Cu2+直接反应产生CuS,同时有 生成。
生成。经实验及理论证明推测1和推测2均合理。
①证明推测1合理,应设计的实验方案是
②推测2发生反应的离子方程式是
③从化学反应速率和限度的角度解释酸性条件下,Na2S2O3溶液与CuSO4溶液酸性条件下反应,实验现象中反应初期产生黄色沉淀,反应中后期产生黑色沉淀的原因
您最近一年使用:0次



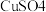 固体,振荡
固体,振荡


