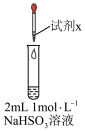
1 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Cu+ [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为___________ 。
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是___________ 。
②实验表明假设b合理,实验I反应的离子方程式有___________ 、 。
。
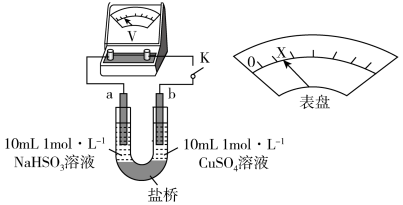
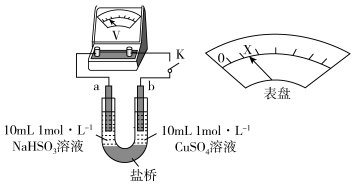
(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-___________ 。
下述实验III证实了假设合理,装置如下图。___________ (补全实验操作及现象)。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和 。
。
①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是___________ 。___________ 。
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:___________ 。
| 实验 | 装置 | 试剂x | 操作及现象 |
| I |
| 1 mol/LCuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅 |
| II | 1 mol/LCuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化 |
 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
 。
。(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-
下述实验III证实了假设合理,装置如下图。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和
 。
。①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:
您最近半年使用:0次
名校
解题方法
2 . 某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
已知:CuCl为白色固体,难溶于水,能溶于浓盐酸。下列说法不正确的是
| 装置 |
| |
| 序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 1.5mL1mol·L-1CuSO4溶液和3.5mL1mol·L-1NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL1mol·L-1CuCl2溶液和3.5mL1mol·L-1NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
| A.取少量Cu2O固体于试管中,加入5mL0.1mol·L-1NaOH溶液,持续通入SO2,若试管底部有少量紫红色固体,溶液呈绿色,证明实验Ⅰ中砖红色沉淀为Cu2O |
| B.将实验Ⅱ中白色沉淀洗涤干净后,加入浓盐酸,沉淀溶解,然后加入蒸馏水,产生白色沉淀,证明白色沉淀为CuCl |
| C.实验Ⅱ与实验Ⅰ现象不同是因为阴离子不同造成的 |
D.实验Ⅰ、Ⅱ中不一定生成了SO |
您最近半年使用:0次
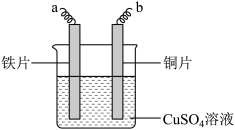
3 . I.NaHSO3、CuSO4为实验室常用的化学试剂,均易溶于水,且水溶液显酸性。在铁片镀铜实验中,为提高电镀效果,常用CuSO4溶液作为电镀液。装置如图所示,a接电源_____ 极,阳极的电极反应式为:_____ 。电镀过程中c(Cu2+)_____ (填“基本不变”、“变大”或“变小”)。
II.某实验小组对NaHSO3溶液分别与CuSO4、CuCl2溶液的反应进行探究。
(1)推测实验B产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_____ ,反应的离子方程式为_____ 。
(2)对实验B产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是_____ ;
②实验表明假设b合理,实验B反应的离子方程式有_____ 、H++HSO =SO2↑+H2O。
=SO2↑+H2O。
(3)对比实验A、B,提出假设:Cl-增强了Cu2+的氧化性。下述实验C证实了假设合理,装置如图(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_____________________________________ (补全实验操作及现象)。
(4)将实验A的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO 。已知:
。已知:
I.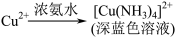 ;
;
II.
III.Cu2O是一种红色粉末状固体,几乎不溶于水,但溶于氨水,形成稳定的、无色的配合物[Cu(NH3)2]+。
①通过实验D证实红色沉淀中含有Cu+和Cu2+。
实验D: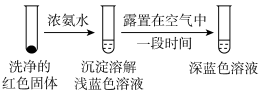
证实红色沉淀中含有Cu+的实验证据是_____ ;
②有同学认为实验D不足以证实红色沉淀中含有Cu2+,设计实验D的对比实验E,证实了Cu2+的存在。实验E的方案和现象是_____ 。(要求:用图示表示,参照实验D)

II.某实验小组对NaHSO3溶液分别与CuSO4、CuCl2溶液的反应进行探究。
| 实验 | 装置 | 试剂x | 操作及现象 |
A | 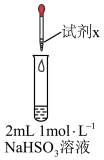 | 1mol·L−1CuSO4溶液 | 加入2mLCuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
B | 1mol·L−1CuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
(2)对实验B产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验B反应的离子方程式有
 =SO2↑+H2O。
=SO2↑+H2O。(3)对比实验A、B,提出假设:Cl-增强了Cu2+的氧化性。下述实验C证实了假设合理,装置如图(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管

(4)将实验A的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO
 。已知:
。已知:I.
 ;
;II.

III.Cu2O是一种红色粉末状固体,几乎不溶于水,但溶于氨水,形成稳定的、无色的配合物[Cu(NH3)2]+。
①通过实验D证实红色沉淀中含有Cu+和Cu2+。
实验D:

证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验D不足以证实红色沉淀中含有Cu2+,设计实验D的对比实验E,证实了Cu2+的存在。实验E的方案和现象是
您最近半年使用:0次
4 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Ⅰ.Cu2+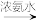 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
Ⅱ. Cu+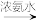 [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液)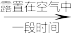 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_______ ,反应的离子方程式为_______ 。
(2)对实验Ⅰ产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是_______ ;
②实验表明假设b合理,实验I反应的离子方程式有_____ 、H++ HSO3-= SO2↑+H2O。
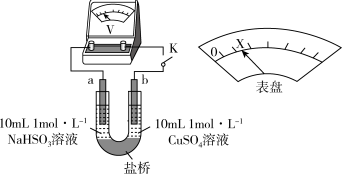
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_______ (补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32−。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ: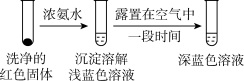
证实红色沉淀中含有Cu+的实验证据是_______ ;
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:_______ 。
| 实验 | 装置 | 试剂x | 操作及现象 |
| Ⅰ | 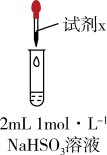 | 1 mol·L−1CuCl2溶液 | 加入2mL CuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| Ⅱ | 1 mol·L−1CuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
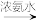 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)Ⅱ. Cu+
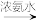 [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液)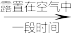 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到
(2)对实验Ⅰ产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管

(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32−。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ:

证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:
您最近半年使用:0次
2020-01-13更新
|
285次组卷
|
4卷引用:北京市朝阳区2020届高三上学期期末教学统一检测化学试题