解题方法
1 . 在实验室制取乙烯时,其反应为CH3CH2OH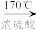 CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
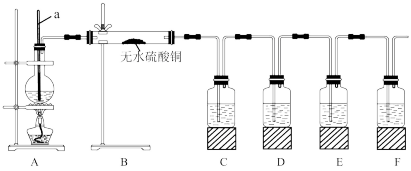
限用试剂(试剂均足量):乙醇、浓硫酸、品红溶液、氢氧化钠溶液、酸性高锰酸钾溶液、溴水。
(1)仪器a的名称为___ 。
(2)请根据实验的要求完成下列填空:
①B中可观察到的现象为___ 。
②D中的试剂为___ 。
③E中的试剂为__ ,其作用为___ 。
④F中的试剂为___ ,可能的实验现象为___ 。
(3)简述装置B置于装置A、C之间的理由:___ 。
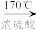 CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
限用试剂(试剂均足量):乙醇、浓硫酸、品红溶液、氢氧化钠溶液、酸性高锰酸钾溶液、溴水。
(1)仪器a的名称为
(2)请根据实验的要求完成下列填空:
①B中可观察到的现象为
②D中的试剂为
③E中的试剂为
④F中的试剂为
(3)简述装置B置于装置A、C之间的理由:
您最近半年使用:0次
2021-10-29更新
|
316次组卷
|
2卷引用:【石家庄新东方】河北省沧衡八校联盟2020-2021学年高一下学期期中考试化学试题
解题方法
2 . Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O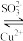 Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______ 。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:____ Cu2++ ____ SO32-+ ____ =____ Cu2O↓+ ____ + ____ HSO3-
【实验探究】
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______ 。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______ 。
(5)iii中砖红色沉淀消失的原因是_______ 。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______ 。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______ 、_______ 。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O
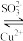 Cu(SO3)23-(无色)
Cu(SO3)23-(无色) (1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:
【实验探究】
| 操作 | 现象 |
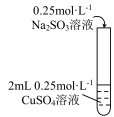 | i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是
(5)iii中砖红色沉淀消失的原因是
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是
您最近半年使用:0次
3 . CuCl 晶体微溶于水和稀硫酸,不溶于乙醇,但易溶于浓盐酸和氯化铵溶液,发生的反应为:CuCl+Cl- CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
(1)实验室保存新制CuCl 晶体的方法是__________ 。
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为_____________ 。
②(NH4)2SO3要适当过量,目的为保证Cu2+的还原速率、_____________ 。
③已知Cu2+的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是_______________ 。

(3)已知:CuCl 固体、CuOH 固体分别为白色和橙黄色,且Ksp(CuCl)= 1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl -=CuCl。则实验过程中的实验现象为_________________ 。
 CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:(1)实验室保存新制CuCl 晶体的方法是
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为
②(NH4)2SO3要适当过量,目的为保证Cu2+的还原速率、
③已知Cu2+的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是

(3)已知:CuCl 固体、CuOH 固体分别为白色和橙黄色,且Ksp(CuCl)= 1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl -=CuCl。则实验过程中的实验现象为
您最近半年使用:0次
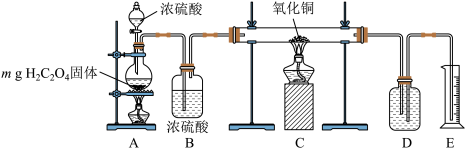
4 . 实验室用下图所示装置制备CO并用其还原CuO。制备CO的原理为H2C2O4 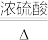 CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO
CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO  Cu2O+ CO2,CO +Cu2O
Cu2O+ CO2,CO +Cu2O  2Cu+CO2。下列说法正确的是
2Cu+CO2。下列说法正确的是
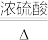 CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO
CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO  Cu2O+ CO2,CO +Cu2O
Cu2O+ CO2,CO +Cu2O  2Cu+CO2。下列说法正确的是
2Cu+CO2。下列说法正确的是
| A.装置C中黑色固体变为红色,证明氧化铜已经全部被还原为铜 |
| B.若装置A中固体完全反应,装置D中盛装浓NaOH溶液,根据装置E中溶液的体积可以计算CO在还原实验中的利用率 |
| C.取反应后的装置C中的固体于试管中,加入硝酸,可检验CuO是否被还原完全 |
| D.根据上述反应原理,推测CaC2O4经长时间加强热,产物为CaCO3、CO2、CO |
您最近半年使用:0次
名校
5 . 某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
(1)假设2中的沉淀为________________ 。
(2)假设1中沉淀为Cu(OH)2的理论依据是____________________________________ 。
(3)无水乙醇洗涤的目的_________________________ 。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设__ (填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用____________ 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_________________ 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为____________________ 。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。

步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
(1)假设2中的沉淀为
(2)假设1中沉淀为Cu(OH)2的理论依据是
(3)无水乙醇洗涤的目的
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设
(5)乙同学认为只要将上图中B装置的试剂改用
(6)乙同学更换B试剂后验证假设3成立的实验现象是
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为
您最近半年使用:0次
2016-12-09更新
|
230次组卷
|
7卷引用:2017届河北省石家庄二中高三上第二期联考化学试卷
11-12高三上·河北承德·期末
6 . 现用如下实验装置测定铜和氧化铜混合物中铜元素的含量。

试回答下列问题:
(1)A中盛装盐酸的仪器名称为___________________ 。
(2)A中可观察到的现象为__________________________________ 。
(3)B装置的作用是____________________________ 。
(4)在给D装置加热前,应该进行的一步操作是________ ,其目的是:________________ 。
(5)已知D装置中铜和氧化铜混合物的质量为10 g,经称量,反应前后E装置的质量分别为100.2 g和102.0 g,原混合物中铜元素的质量分数为________ (假设各装置中的反应或吸收都是完全的)。
(6)如不加F装置,会使实验结果_______ (填“偏低”或“偏高”)。

试回答下列问题:
(1)A中盛装盐酸的仪器名称为
(2)A中可观察到的现象为
(3)B装置的作用是
(4)在给D装置加热前,应该进行的一步操作是
(5)已知D装置中铜和氧化铜混合物的质量为10 g,经称量,反应前后E装置的质量分别为100.2 g和102.0 g,原混合物中铜元素的质量分数为
(6)如不加F装置,会使实验结果
您最近半年使用:0次
解题方法
7 . 某实验小组同学为了探究铜的相关性质的反应及产物,进行了如下系列实验。
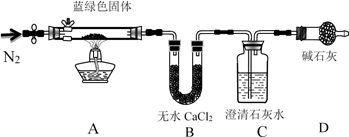
【实验1】铜与浓硫酸反应及产物性质实验装置如图所示。
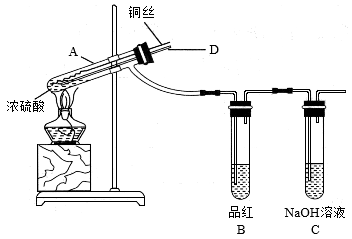
实验步骤:①先连接好装置,检验气密性,加入试剂;②加热具支试管A直到B中品红褪色,熄灭酒精灯;③将 丝上提离开液面。
丝上提离开液面。
(1)反应过程中以及熄灭酒精灯时,因为有导管D的存在,不必担心B中的液体会倒吸,其原因是_______ 。
【实验2】实验中发现具支试管A内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜以及被掩蔽的氧化亚铜。
(2)具支试管A内产生的白色固体主要成分为_________ 。
查阅资料:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成 和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀硫酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀硫酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:
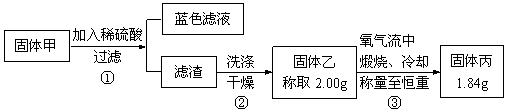
(3)③中在煅烧过程中一定发生的反应的化学方程式为_______ 。
(4)下列对于固体甲的成分的判断正确的是(填字母选项)_________ 。
A.固体甲中, 和
和 不能同时存在
不能同时存在
B.固体甲中, 和
和 至少有一种
至少有一种
C.固体甲中若没有 ,则一定有
,则一定有
D.固体甲中若存在 ,也可能有
,也可能有
【实验3】下图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
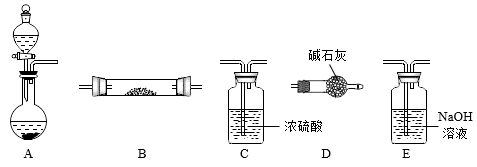
(5)若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
①当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是 、无水
、无水 粉末。此实验的目的是
粉末。此实验的目的是________ 。
②为了使B中 反应充分,在不改变现有药品的条件下,可采取的方法有(写一种)
反应充分,在不改变现有药品的条件下,可采取的方法有(写一种)____________ 。
【实验1】铜与浓硫酸反应及产物性质实验装置如图所示。

实验步骤:①先连接好装置,检验气密性,加入试剂;②加热具支试管A直到B中品红褪色,熄灭酒精灯;③将
 丝上提离开液面。
丝上提离开液面。(1)反应过程中以及熄灭酒精灯时,因为有导管D的存在,不必担心B中的液体会倒吸,其原因是
【实验2】实验中发现具支试管A内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜以及被掩蔽的氧化亚铜。
(2)具支试管A内产生的白色固体主要成分为
查阅资料:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成
 和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀硫酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀硫酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:

(3)③中在煅烧过程中一定发生的反应的化学方程式为
(4)下列对于固体甲的成分的判断正确的是(填字母选项)
A.固体甲中,
 和
和 不能同时存在
不能同时存在B.固体甲中,
 和
和 至少有一种
至少有一种C.固体甲中若没有
 ,则一定有
,则一定有
D.固体甲中若存在
 ,也可能有
,也可能有
【实验3】下图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。

(5)若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
①当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是
 、无水
、无水 粉末。此实验的目的是
粉末。此实验的目的是②为了使B中
 反应充分,在不改变现有药品的条件下,可采取的方法有(写一种)
反应充分,在不改变现有药品的条件下,可采取的方法有(写一种)
您最近半年使用:0次
解题方法
8 . 碱式碳酸铜在生产生活中有着重要的应用。某学习小组欲在实验室探究制备碱式碳酸铜的最佳实验条件,并测定所制得产品的化学式。
已知:xCuCO3·yCu(OH)2·zH2O为绿色或暗绿色固体,Cu4SO4(OH)6·2H2O为蓝色固体。
I.探究制备碱式碳酸铜的最佳实验条件
(1)实验需要0.50 moL/L Na2CO3溶液和0.50 mol/L CuSO4溶液各500 mL,配制上述溶液,所使用的玻璃仪器中,除烧杯和胶头滴管外,还有___________ 。
(2)实验中测得反应物配比及温度对产物的影响分别如表1、表2所示:
表1反应物配比对产物的影响
表2 温度对产物的影响
①由此得出制备碱式碳酸铜的最佳实验条件为 ___________ 。
②95℃时,观察到先有绿色沉淀生成,随后变为黑色。沉淀由绿色变为黑色的原因为___________ (用化学方程式表示)。
③根据最佳实验条件,甲同学采用先混合溶液再加热的方法,成功制得绿色产品;乙同学采用先分别加热溶液再混合的方法,得到的产品却是蓝色的。试分析乙同学实验结果的原因为___________ 。
II.测定产品碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]的化学式。
按照I的方案,小组同学制得了碱式碳酸铜,并采用如下装置测定其化学式(可重复使用)。
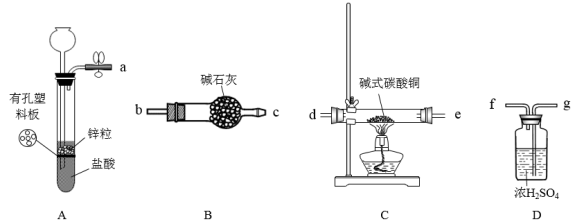
(3)按气流方向,装置的连接顺序为:a→( ) ( ) → ( ) ( ) → ( ) ( ) → ( ) ( ) → ( ) ( ) →尾气处理。
(4)根据完整的实验装置进行实验,实验步骤如下:先检查装置的气密性,再装入药品___________ (请按正确的顺序填入步骤的标号)。
①停止加热,充分冷却
②加热C 一段时间
③打开A中的活塞通氢气
④收集气体并检验纯度
⑤关闭A中的活塞
(5)称取9.55g xCuCO3·yCu(OH)2·zH2O产品,充分反应后,硬质玻璃管中得到4.8 g残留物,同时生成2.2 g二氧化碳和2.7 g水。则该产品的化学式为___________ 。
已知:xCuCO3·yCu(OH)2·zH2O为绿色或暗绿色固体,Cu4SO4(OH)6·2H2O为蓝色固体。
I.探究制备碱式碳酸铜的最佳实验条件
(1)实验需要0.50 moL/L Na2CO3溶液和0.50 mol/L CuSO4溶液各500 mL,配制上述溶液,所使用的玻璃仪器中,除烧杯和胶头滴管外,还有
(2)实验中测得反应物配比及温度对产物的影响分别如表1、表2所示:
表1反应物配比对产物的影响
| n(CuSO4):n(Na2CO3) | 1:1.0 | 1:1.1 | 1:1.2 | 1:1.3 |
| 产物生成速度 | 较慢 | 慢 | 快 | 较快 |
| 沉淀量/g | 0.4281 | 0.5332 | 0.5490 | 0.5371 |
| 沉淀颜色 | 蓝色 | 浅蓝色 | 绿色 | 绿色 |
| 温度/℃ | 室温 | 65 | 75 | 85 | 95 |
| 产物生成速度 | _______ | 较慢 | 快 | 较快 | 快 |
| 沉淀量/g | 无 | 1.3033 | 1.4512 | 1.2799 | 0.9159 |
| 沉淀颜色 | _____ | 绿色 | 绿色 | 绿色稍显黑色 | 黑色 |
②95℃时,观察到先有绿色沉淀生成,随后变为黑色。沉淀由绿色变为黑色的原因为
③根据最佳实验条件,甲同学采用先混合溶液再加热的方法,成功制得绿色产品;乙同学采用先分别加热溶液再混合的方法,得到的产品却是蓝色的。试分析乙同学实验结果的原因为
II.测定产品碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]的化学式。
按照I的方案,小组同学制得了碱式碳酸铜,并采用如下装置测定其化学式(可重复使用)。

(3)按气流方向,装置的连接顺序为:a→
(4)根据完整的实验装置进行实验,实验步骤如下:先检查装置的气密性,再装入药品
①停止加热,充分冷却
②加热C 一段时间
③打开A中的活塞通氢气
④收集气体并检验纯度
⑤关闭A中的活塞
(5)称取9.55g xCuCO3·yCu(OH)2·zH2O产品,充分反应后,硬质玻璃管中得到4.8 g残留物,同时生成2.2 g二氧化碳和2.7 g水。则该产品的化学式为
您最近半年使用:0次
名校
9 . I.回答下列问题:
(1)欲量取20.00 mL KMnO4酸性溶液,应选用的仪器是________________ 。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_____________ 、___________ 。
(3)在测定硫酸铜晶体中结晶水含量的实验中,称量操作至少要进行__________ 次。
II.氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
(1)新制氢氧化铜悬浊液的配制。实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4~6滴,振荡即成。这样操作的目的是________________________________________________________________________________ 。
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究,提出猜想:_______________________________________________ 。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应,生成+2价的铜离子和单质铜;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣。
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次至固体恒重,称得质量为b g,比较a、b关系。
方案4:取该红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。
你认为合理的方案是____________________________ 。
(3)研究性学习小组乙针对甲的质疑,设计新的探究方案,装置如下图所示。
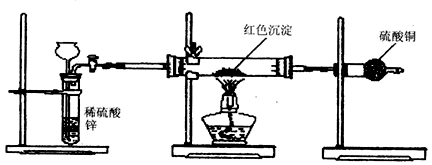
你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):________________ 。
①通入氢气体积;②反应前,红色沉淀 + 硬质玻璃管的总质量;③完全反应后红色固体 + 硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量。
(4)研究性学习小组丙上网查阅新闻得知:“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求。他们收集上述红色沉淀制备化学试剂:蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:____________________________________________________________________________ 。
(1)欲量取20.00 mL KMnO4酸性溶液,应选用的仪器是
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
(3)在测定硫酸铜晶体中结晶水含量的实验中,称量操作至少要进行
II.氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
(1)新制氢氧化铜悬浊液的配制。实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4~6滴,振荡即成。这样操作的目的是
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究,提出猜想:
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应,生成+2价的铜离子和单质铜;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣。
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次至固体恒重,称得质量为b g,比较a、b关系。
方案4:取该红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。
你认为合理的方案是
(3)研究性学习小组乙针对甲的质疑,设计新的探究方案,装置如下图所示。

你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):
①通入氢气体积;②反应前,红色沉淀 + 硬质玻璃管的总质量;③完全反应后红色固体 + 硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量。
(4)研究性学习小组丙上网查阅新闻得知:“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求。他们收集上述红色沉淀制备化学试剂:蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:
您最近半年使用:0次
2017-11-07更新
|
955次组卷
|
2卷引用:河北省定州中学2018届高三下学期开学考试化学试题



