名校
1 . 氧化亚铜和溴化亚铜均是常见的一价铜化合物,氧化亚铜在强酸性溶液中易发生歧化反应,溴化亚铜常用作有机合成原料和反应催化剂。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为___________ g。
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到___________ ,则说明样品中含有Cu2O杂质。
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:___________ 。
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____ +_________。
+_________。
该反应完毕的现象标志是___________ ,洗涤CuBr沉淀时采用二氧化硫的水溶液而不采用蒸馏水的目的是___________ 。
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
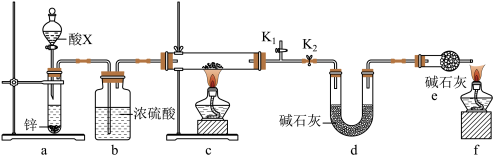
①装置a中所加的酸X是___________ (填化学式)。
②通过测定下列物理量,能达到实验目的的是___________ (填字母)。
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是___________ 。
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____
 +_________。
+_________。该反应完毕的现象标志是
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。

①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
您最近半年使用:0次
13-14高三上·山东济南·期中
解题方法
2 . 某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下:提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
(1)I.解决问题1
a.需用到的药品除1mol•L﹣1CuSO4溶液、稀硫酸外还需________ (填试剂的化学式)溶液.
b.用胆矾晶体配制1mol•L﹣1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、
玻璃棒、胶头滴管外,还有________ (填仪器名称).
c.为达到实验目的,请你补全实验内容和步骤:
①用CuSO4溶液制备Cu(OH)2;
②________ .
(2)Ⅱ.解决问题2
取一定量I中制备获得的氢氧化铜固体于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
a.写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:________ .
b.从实验Ⅱ可得出的结论是在高温下正一价铜比正二价铜________ (填稳定或不稳定),溶液中正一价铜比正二价铜________ (填稳定或不稳定).
(3)Ⅲ.解决问题3设计如下装置(夹持装置未画出):
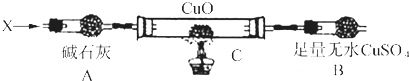
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g气体Y.
a.仪器A的名称是________ .
b.X的化学式为________ .
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
(1)I.解决问题1
a.需用到的药品除1mol•L﹣1CuSO4溶液、稀硫酸外还需
b.用胆矾晶体配制1mol•L﹣1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、
玻璃棒、胶头滴管外,还有
c.为达到实验目的,请你补全实验内容和步骤:
①用CuSO4溶液制备Cu(OH)2;
②
(2)Ⅱ.解决问题2
取一定量I中制备获得的氢氧化铜固体于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
a.写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:
b.从实验Ⅱ可得出的结论是在高温下正一价铜比正二价铜
(3)Ⅲ.解决问题3设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g气体Y.
a.仪器A的名称是
b.X的化学式为
您最近半年使用:0次
名校
解题方法
3 . 某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下所示:
【提出猜想】
问题1:在周期表中,铜与铝的位置很靠近,铜不如铝活泼,氢氧化铝具有两性。那么,氢氧化铜也具有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价铁的稳定性。那么,正一价铜的稳定性也小于正二价铜的稳定性吗?
问题3:氧化铜具有氧化性,能被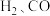 还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?
还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?
【实验探究】
Ⅰ.解决问题1
(1)需用到的药品除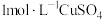 溶液、稀硫酸外,还需
溶液、稀硫酸外,还需____________ (填试剂的化学式)溶液。
(2)为达到本实验目的,你认为应进行的相关实验是(填实验内容):
①__________________ ;②__________________ 。
Ⅱ.解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到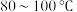 时得到黑色固体粉末;继续加热至
时得到黑色固体粉末;继续加热至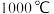 以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁浄试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题:
以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁浄试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题:
(3)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:______________________________ 。
(4)从实验Ⅱ可得出的结论是:__________________________________________ 。
(5)往蓝色溶液中逐滴加入过量的氨水,发生反应的离子方程式为:______________ 、______________ 。
Ⅲ.解决问题3
设计如图装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水 变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的
变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的 燃烧管完全反应后,消耗
燃烧管完全反应后,消耗 ,测得B装置增重
,测得B装置增重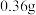 ,并收集到
,并收集到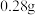 单质气体Y。
单质气体Y。
(6)C装置中发生反应的化学方程式为________________________________ 。
【提出猜想】
问题1:在周期表中,铜与铝的位置很靠近,铜不如铝活泼,氢氧化铝具有两性。那么,氢氧化铜也具有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价铁的稳定性。那么,正一价铜的稳定性也小于正二价铜的稳定性吗?
问题3:氧化铜具有氧化性,能被
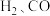 还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?
还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?【实验探究】
Ⅰ.解决问题1
(1)需用到的药品除
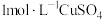 溶液、稀硫酸外,还需
溶液、稀硫酸外,还需(2)为达到本实验目的,你认为应进行的相关实验是(填实验内容):
①
Ⅱ.解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到
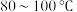 时得到黑色固体粉末;继续加热至
时得到黑色固体粉末;继续加热至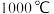 以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁浄试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题:
以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁浄试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题:(3)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:
(4)从实验Ⅱ可得出的结论是:
(5)往蓝色溶液中逐滴加入过量的氨水,发生反应的离子方程式为:
Ⅲ.解决问题3
设计如图装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水
 变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的
变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的 燃烧管完全反应后,消耗
燃烧管完全反应后,消耗 ,测得B装置增重
,测得B装置增重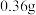 ,并收集到
,并收集到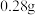 单质气体Y。
单质气体Y。(6)C装置中发生反应的化学方程式为
您最近半年使用:0次
4 . 已知木炭还原氧化铜实验中发生的主要反应:C+2CuO 2Cu+CO2↑,化学兴趣小组对该实验产物(假设反应物已完全反应)作如图探究:
2Cu+CO2↑,化学兴趣小组对该实验产物(假设反应物已完全反应)作如图探究:

探究一:检验产物的成分
提出问题:实验产物是暗红色固体,很难观察到紫红色固体。暗红色固体是什么?
查阅资料:氧化亚铜(Cu2O)为红色固体:Cu2O+H2SO4=CuSO4+Cu+H2O。
猜想与假设:暗红色固体除铜外还可能含有Cu2O。
(1)取少量暗红色固体,加入稀硫酸,如果观察到现象:____ ,说明暗红色固体含有Cu2O。用氢氧化钠可检验生成物中有Cu2+,该反应的方程式是____ 。
探究二:测定产物中Cu2O的含量
原理C+2CuO 2Cu+CO2↑,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的。
2Cu+CO2↑,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的。
(2)装置e的作用是____ ,若不加装置e,实验结果会偏____ (填“大”或“小”)。
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是____ 。
①打开K2:关闭K1②检查装置的气密性 ③连接仪器 ④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置____ (填“a”、“b”或“c”)的质量达到实验目的。
 2Cu+CO2↑,化学兴趣小组对该实验产物(假设反应物已完全反应)作如图探究:
2Cu+CO2↑,化学兴趣小组对该实验产物(假设反应物已完全反应)作如图探究:
探究一:检验产物的成分
提出问题:实验产物是暗红色固体,很难观察到紫红色固体。暗红色固体是什么?
查阅资料:氧化亚铜(Cu2O)为红色固体:Cu2O+H2SO4=CuSO4+Cu+H2O。
猜想与假设:暗红色固体除铜外还可能含有Cu2O。
(1)取少量暗红色固体,加入稀硫酸,如果观察到现象:
探究二:测定产物中Cu2O的含量
原理C+2CuO
 2Cu+CO2↑,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的。
2Cu+CO2↑,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的。(2)装置e的作用是
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2:关闭K1②检查装置的气密性 ③连接仪器 ④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置
您最近半年使用:0次
解题方法
5 . 下列装置不能达到相应实验目的的是
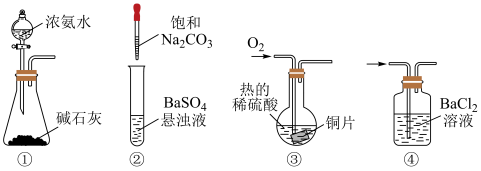

| A.装置①用于制备氨气 |
B.装置②用于验证 可转化为 可转化为 |
C.装置③可用铜制 溶液 溶液 |
D.装置④用于检验 中是否含有 中是否含有 |
您最近半年使用:0次
解题方法
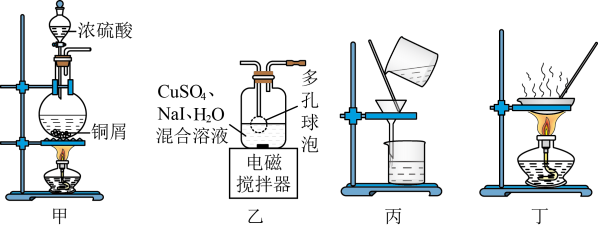
6 . 实验室可用反应 来制备CuI(CuI受热易被氧化)。下列实验装置和操作
来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能 达到实验目的的是
 来制备CuI(CuI受热易被氧化)。下列实验装置和操作
来制备CuI(CuI受热易被氧化)。下列实验装置和操作
A.用甲装置制备 | B.用乙装置制备CuI |
| C.用丙装置分离出CuI | D.用丁装置干燥CuI固体 |
您最近半年使用:0次
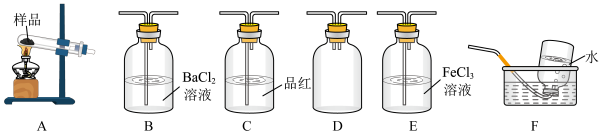
7 . 某学习小组设计实验探究CuSO4分解产物
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。
回答下列有关问题
(1)CuSO4水溶液呈酸性,其原因是______________________ (用离子方程式表示)。
(2)上述装置按气流从左至右排序为A、D、___________ E、F(填代号)。
(3)装置D的作用是___________ ;能证明有SO3生成的实验现象是___________ 。
(4)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有___________ ;待C中有明显现象后,F开始收集气体,F装置中集气瓶收集到了少量气体,该气体是___________ (填化学式)。
(5)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a 滴加少量的NH4SCN溶液 b 滴加少量的K3[Fe(CN)6]溶液
c 滴加酸性KMnO4溶液 d 滴加盐酸酸化的BaCl2溶液
其中,方案合理的有___________ (填代号),写出E装置中可能发生反应的离子方程式:_________ 。
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)
查阅资料知,铜有+2、+1价。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(6)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是___________ 。
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(7)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:_______ 。
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。

回答下列有关问题
(1)CuSO4水溶液呈酸性,其原因是
(2)上述装置按气流从左至右排序为A、D、
(3)装置D的作用是
(4)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有
(5)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a 滴加少量的NH4SCN溶液 b 滴加少量的K3[Fe(CN)6]溶液
c 滴加酸性KMnO4溶液 d 滴加盐酸酸化的BaCl2溶液
其中,方案合理的有
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)
查阅资料知,铜有+2、+1价。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(6)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(7)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:
您最近半年使用:0次
8 . 某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下所示
【提出猜想】
问题1:在周期表中,铜与铝的位置很靠近,铜不如铝活泼,氢氧化铝具有两性。那么,氢氧化铜也具有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价铁的稳定性。那么,正一价铜的稳定性也小于正二价铜的稳定性吗?
问题3:氧化铜具有氧化性,能被H2、CO还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?
【实验探究】
I.解决问题1
(1)需用到的药品除1mol・L-1CuSO4溶液、稀硫酸外,还需_________ (填试剂的化学式)溶液。
(2)用胆矾晶体配制1mol・L-1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管、量筒外,还有________ (填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:①_________ ;②_______________ 。
Ⅱ.解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题:
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_____________ 。
(2)从实验Ⅱ可得出的结论是_______________________ 。
Ⅲ.解决问题3
设计如下装置(夹持装置未画出):
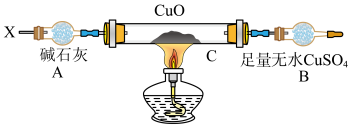
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水CuSO4变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01molX,测得B装置增重0.36g,并收集到0.28g单质气体Y。
(1)X气体的摩尔质量是_________________ 。
(2)C装置中发生反应的化学方程式为__________________________ 。
【提出猜想】
问题1:在周期表中,铜与铝的位置很靠近,铜不如铝活泼,氢氧化铝具有两性。那么,氢氧化铜也具有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价铁的稳定性。那么,正一价铜的稳定性也小于正二价铜的稳定性吗?
问题3:氧化铜具有氧化性,能被H2、CO还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?
【实验探究】
I.解决问题1
(1)需用到的药品除1mol・L-1CuSO4溶液、稀硫酸外,还需
(2)用胆矾晶体配制1mol・L-1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管、量筒外,还有
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:①
Ⅱ.解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题:
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:
(2)从实验Ⅱ可得出的结论是
Ⅲ.解决问题3
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水CuSO4变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01molX,测得B装置增重0.36g,并收集到0.28g单质气体Y。
(1)X气体的摩尔质量是
(2)C装置中发生反应的化学方程式为
您最近半年使用:0次
2019-03-24更新
|
276次组卷
|
3卷引用:2014届上海市上海理工大学附属中学高三上学期第三次月考化学试卷
(已下线)2014届上海市上海理工大学附属中学高三上学期第三次月考化学试卷【全国百强校】湖南省长沙市雅礼中学2019届高三上学期月考(五)化学试题2020届高考化学二轮复习大题精准训练——化学实验方案的设计及评价
2018高三·全国·专题练习
9 . 某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下。
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1。
(1)需用到的药品除铜、铝、1 mol·L-1 CuSO4溶液、稀H2SO4外还需________ (填试剂的化学式)溶液。
(2)配制1 mol·L-1 CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、玻璃棒、量筒、胶头滴管外,还有________________ (填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:
①Cu与稀H2SO4反应;
②____________________ ;
③____________________ 。
Ⅱ.解决问题2。
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100 ℃得到黑色固体粉末;继续加热至1 000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:________________ 。
(5)从实验Ⅱ可得出的结论是____________________________ 。
Ⅲ.解决问题3。
设计如下装置(夹持装置未画出):
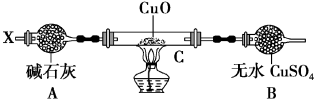
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.27 g,并收集到0.14 g单质气体Y。
(6)研究小组同学验证燃烧管生成的红色物质是铜,你认为他们验证的方法是____________________ 。
(7)X气体的摩尔质量是____________ 。
(8)C中发生反应的化学方程式为______________________ 。
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1。
(1)需用到的药品除铜、铝、1 mol·L-1 CuSO4溶液、稀H2SO4外还需
(2)配制1 mol·L-1 CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、玻璃棒、量筒、胶头滴管外,还有
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:
①Cu与稀H2SO4反应;
②
③
Ⅱ.解决问题2。
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100 ℃得到黑色固体粉末;继续加热至1 000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:
(5)从实验Ⅱ可得出的结论是
Ⅲ.解决问题3。
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.27 g,并收集到0.14 g单质气体Y。
(6)研究小组同学验证燃烧管生成的红色物质是铜,你认为他们验证的方法是
(7)X气体的摩尔质量是
(8)C中发生反应的化学方程式为
您最近半年使用:0次
名校
10 . 氯化亚铜(CuCl)是一种重要的化工原料,化学小组用如图装置(部分夹持装置略去)制备CuCl。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3,打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间气体。
Ⅱ.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是_______ ,置C中的试剂为_______ 。
(2)步骤I中通入SO2发生反应的离子方程式是_______ 。
(3)步骤Ⅱ中采用抽滤法过滤的主要目的是:_____ ;抽滤采用下图装置。滤完毕需进行下列操作,从实验安全角度考虑,你认为最合理的第一步操作为_______ (填标号)。
(4)某小组同学发现,将分液漏斗中的0.1 mol·L-1盐酸换为6 mol·L-1盐酸,通入SO2,最终未得到白色沉淀。对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应查阅资料知: CuCl+Cl- CuCl
CuCl ,据此设计实验:将上述未得到沉淀的溶液
,据此设计实验:将上述未得到沉淀的溶液__________ (填操作),若观察到有白色沉淀析出,证明猜想一正确。
猜想二:________ 。设计验证猜想二是否成立的实验方案:________ 。
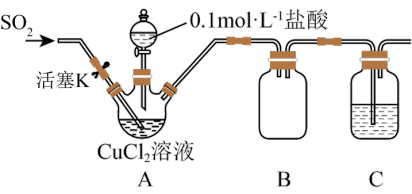
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3,打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间气体。
Ⅱ.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是
(2)步骤I中通入SO2发生反应的离子方程式是
(3)步骤Ⅱ中采用抽滤法过滤的主要目的是:
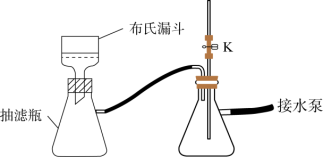
(4)某小组同学发现,将分液漏斗中的0.1 mol·L-1盐酸换为6 mol·L-1盐酸,通入SO2,最终未得到白色沉淀。对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应查阅资料知: CuCl+Cl-
 CuCl
CuCl ,据此设计实验:将上述未得到沉淀的溶液
,据此设计实验:将上述未得到沉淀的溶液猜想二:
您最近半年使用:0次



