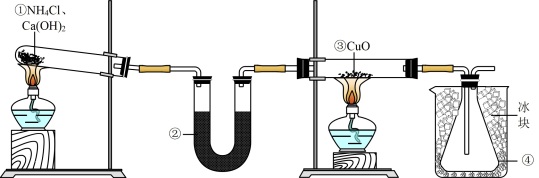
1 . 某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:
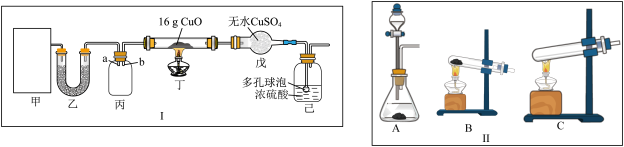
(1)实验室制备氨气有多种方法,现欲用NH4C1与Ca(OH)2反应制取NH3,则甲中的气体发生装置___________ (从Ⅱ中选用);用浓氨水与生石灰反应也可制取NH3,反应的化学方程式为__________
(2)装置丙用于收集NH3,应将导管__________ (填“a”或“b”)延长至集气瓶底部,装置乙中盛放的试剂为__________ ,装置己的作用为____________ (答两点)。
(3)若装置丁中黑色固体变红,则装置戊中现象为_________
(4)研究小组的同学通过讨论、分析后认为充分反应后生成的红色固体可能是Cu或Cu2O或二者的混合物,通过查阅资料知:Cu2O+2H+=Cu+Cu2++H2O。为探究固体的成分,提出了如下两种方案。
I. 甲同学取少量红色固体与稀硝酸混合,最终得到蓝色溶液,由此推测红色产物中有Cu2O。
①你对甲同学实验设计的评价是__________ (请给出必要的文字解释)。
②Cu2O与稀硝酸反应的离子方程式为_____________
Ⅱ.乙同学认为不需要借助任何化学试剂,只需要称量生成的红色固体的质量(设为xg)就能确定产物成分,当x取值范围为_____ 时,表明产物中既有Cu,又有Cu2O。

(1)实验室制备氨气有多种方法,现欲用NH4C1与Ca(OH)2反应制取NH3,则甲中的气体发生装置
(2)装置丙用于收集NH3,应将导管
(3)若装置丁中黑色固体变红,则装置戊中现象为
(4)研究小组的同学通过讨论、分析后认为充分反应后生成的红色固体可能是Cu或Cu2O或二者的混合物,通过查阅资料知:Cu2O+2H+=Cu+Cu2++H2O。为探究固体的成分,提出了如下两种方案。
I. 甲同学取少量红色固体与稀硝酸混合,最终得到蓝色溶液,由此推测红色产物中有Cu2O。
①你对甲同学实验设计的评价是
②Cu2O与稀硝酸反应的离子方程式为
Ⅱ.乙同学认为不需要借助任何化学试剂,只需要称量生成的红色固体的质量(设为xg)就能确定产物成分,当x取值范围为
您最近半年使用:0次
2 . 下列操作或装置能达到实验目的的是
A.收集NO2 并防止其污染环境 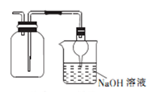 | B.称取一定量的氢氧化钠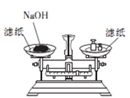 | C.验证浓硫酸与铜反应后产物中是否含有铜离子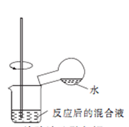 | D.制取碳酸氢钠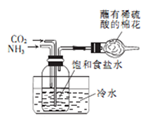 |
您最近半年使用:0次
3 . 胆矾(CuSO4·5H2O)是一种重要化工原料。某研究小组以生锈的铜屑为原料(主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2)制备胆矾流程如图,下列说法不正确的是
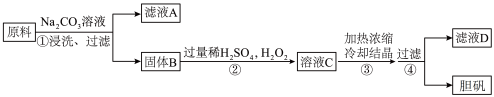

| A.步骤②中包含了氧化还原反应,氧化剂与还原剂的物质的量比为1∶1 |
| B.步骤③④得到的胆矾晶体,可以用水进行洗涤干燥 |
| C.往滤液D中加入淀粉-KI溶液,无明显现象 |
| D.将25g胆矾晶体与75g水混合,配制得到质量分数为16%的硫酸铜溶液 |
您最近半年使用:0次
解题方法
4 . 铝、铁、铜是生活中常见的金属。
(1)铝、铁、铜三种金属都能作导线,是因为它们都具有________ 。
(2)铝在空气中不易被锈蚀,是因为_____________ (用化学方程式表示)。
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、____ 共同作用的结果。
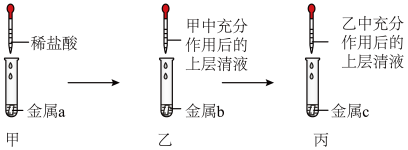
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为______ 时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为________________ 若金属a、b、c依次为铁、铝、铜时,则无法比较___ 和___ 的活动性强弱。

(1)铝、铁、铜三种金属都能作导线,是因为它们都具有
(2)铝在空气中不易被锈蚀,是因为
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为
您最近半年使用:0次
2020-08-06更新
|
76次组卷
|
2卷引用:开学考试化学试卷03——2020年秋季高一新生入学分班考试化学试卷(全国通用)
解题方法
5 . 实验室制备四水甲酸铜[Cu(HCOO)2∙4H2O]晶体实验步骤如下。
(1)碱式碳酸铜的制备:
a.步骤i是将一定量胆矾和碳酸氢钠固体一起放到研钵中研磨,其目的是______ 。
b.步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到_____ (写实验现象),说明温度过高。
c.相关的化学方程式______ 。
(2)四水甲酸铜晶体的制备:将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,乘热过滤除去少量不溶性杂质,然后蒸发冷却过滤,在用少量无水乙醇洗涤晶体2—3次晾干,得到产品。
a.相关的化学方程式______ 。
b.趁热过滤中,必须趁热的原因是______ 。
c.用乙醇洗涤晶体的目的______ 。
(1)碱式碳酸铜的制备:
a.步骤i是将一定量胆矾和碳酸氢钠固体一起放到研钵中研磨,其目的是
b.步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到
c.相关的化学方程式
(2)四水甲酸铜晶体的制备:将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,乘热过滤除去少量不溶性杂质,然后蒸发冷却过滤,在用少量无水乙醇洗涤晶体2—3次晾干,得到产品。
a.相关的化学方程式
b.趁热过滤中,必须趁热的原因是
c.用乙醇洗涤晶体的目的
您最近半年使用:0次
名校
解题方法
6 . 某实验小组利用如图装置制备 并探究其性质。下列说法正确的是
并探究其性质。下列说法正确的是
 并探究其性质。下列说法正确的是
并探究其性质。下列说法正确的是
A.①中固体可换为 分解制备氨气 分解制备氨气 |
B.②中药品可为无水 |
| C.反应一段时间后,可取③中的固体溶解于稀硝酸中确认反应是否完全 |
| D.反应一段时间后,④中锥形瓶收集到的液体呈碱性 |
您最近半年使用:0次
10-11高三·山东济宁·阶段练习
7 . 实验室里常用“碘锤”的玻璃仪器做碘的升华实验,该仪器为两头密封的玻璃窗,中间带有一根玻璃短柄。用此仪器进行有关实验时,具有装置简单、操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是

| A.NH4Cl受热分解的实验 |
| B.无水CuSO4与胆矾的互变实验 |
| C.白磷和红磷(已经抽出O2)在一定温度下相互转变的实验 |
| D.KMnO4受热分解的实验 |
您最近半年使用:0次
解题方法
8 . 氯化亚铜(CuCl)为白色晶体,易被氧化,微溶于水,能溶于浓盐酸,不溶于醇。利用下图装置制备CuCl (省略夹持和加热装置),在溶液中存在: 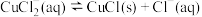 ,已知CuCl
,已知CuCl (aq)无色。下列说法
(aq)无色。下列说法错误 的是

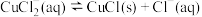 ,已知CuCl
,已知CuCl (aq)无色。下列说法
(aq)无色。下列说法
| A.仪器a的名称为恒压滴液漏斗 |
| B.烧瓶中的溶液由蓝色逐渐转变为无色 |
| C.为加快反应速率,可以用过量浓硝酸代替浓盐酸 |
| D.为避免CuCl的溶解损耗,可用95%的乙醇溶液洗涤沉淀 |
您最近半年使用:0次
名校
解题方法
9 . 黄铜矿( )是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为
)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为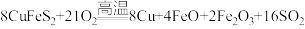 。
。
(1)若 中
中 的化合价为+2,反应中被还原的元素是
的化合价为+2,反应中被还原的元素是_______ (填元素符号)。
(2)上述冶炼过程产生大量 。下列处理方案中合理的是
。下列处理方案中合理的是_______ (填代号)
a. 高空排放 b. 用于制备硫酸
c. 用纯碱溶液吸收制 d. 用浓硫酸吸收
d. 用浓硫酸吸收
(3)实验室制备、收集干燥的 ,并探究
,并探究 与
与 溶液的反应,所需仪器如下。
溶液的反应,所需仪器如下。
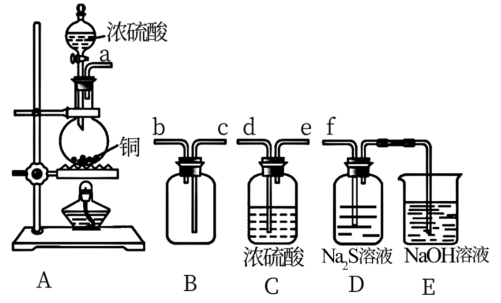
①其中装置A产生SO2,反应的化学方程式为_______ 。
②请按气流方向连接各仪器接口,顺序为a→_______ →_______ →_______ →_______ →f,装置D中观察到的现象是_______ 。装置E中发生的反应离子方程式为_______ 。
 )是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为
)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为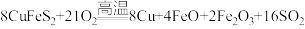 。
。(1)若
 中
中 的化合价为+2,反应中被还原的元素是
的化合价为+2,反应中被还原的元素是(2)上述冶炼过程产生大量
 。下列处理方案中合理的是
。下列处理方案中合理的是a. 高空排放 b. 用于制备硫酸
c. 用纯碱溶液吸收制
 d. 用浓硫酸吸收
d. 用浓硫酸吸收(3)实验室制备、收集干燥的
 ,并探究
,并探究 与
与 溶液的反应,所需仪器如下。
溶液的反应,所需仪器如下。
①其中装置A产生SO2,反应的化学方程式为
②请按气流方向连接各仪器接口,顺序为a→
您最近半年使用:0次
2021-01-27更新
|
224次组卷
|
3卷引用:山东省菏泽地区2020-2021学年高一上学期期末联考化学试题
解题方法
10 . 过渡金属的单质及化合物很多有催化性能,氯化铜、氯化亚铜经常用作有机合成催化剂。实验室中用氯气与粗铜(杂质只有Fe)反应,制备铜的氯化物的流程如下。
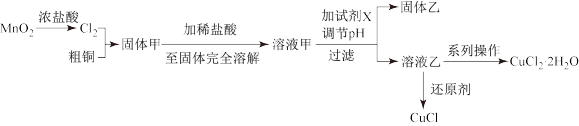
查阅资料:
氯化亚铜:白色微溶于水,在干燥空气中稳定,受潮则易变蓝到棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:从水溶液中结晶时,在26~42℃得到二水物,在15℃以下得到四水物,在15~25.7℃得到三水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
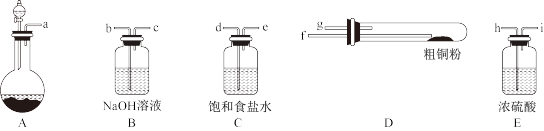
①按气流方向连接各仪器接口顺序是:a→_____ 、_____ →h、i→_____ 、_____ →_____ 。
②本套装置有两个仪器需要加热,加热的顺序为先_____ 后_____ 。
(2)分析流程:
①固体甲需要加稀盐酸溶解,其理由是_____ ;
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)_____ 。
a Cu(OH)2 b NH3·H2O c CuO d CuSO4
查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________ ,Fe3+完全沉淀时溶液的pH为________ 。(提示:lg2=0.3)
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、________ 、_______ 、洗涤、干燥。
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式:____________ 。
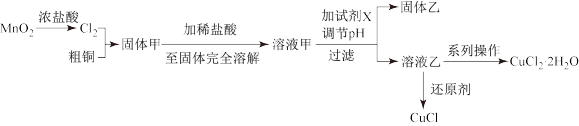
查阅资料:
氯化亚铜:白色微溶于水,在干燥空气中稳定,受潮则易变蓝到棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:从水溶液中结晶时,在26~42℃得到二水物,在15℃以下得到四水物,在15~25.7℃得到三水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→
②本套装置有两个仪器需要加热,加热的顺序为先
(2)分析流程:
①固体甲需要加稀盐酸溶解,其理由是
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)
a Cu(OH)2 b NH3·H2O c CuO d CuSO4
查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式:
您最近半年使用:0次



