1 . 为探究CO还原CuO的固体产物成分,某同学用以下装置(夹持装置已省略)进行有关实验:
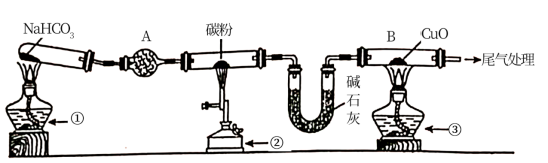
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请回答:
(1)装置A的作用是___ 。
(2)点燃①、②、③的先后顺序是①→____ →____ 。
(3)反应一段时间后,取仪器B中少量固体,加入稀H2SO4,溶液变蓝色且有红色不溶性固体。据此现象能否说明反应产物中含Cu2O?___ (填“能”或“不能”),理由是___ 。

已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请回答:
(1)装置A的作用是
(2)点燃①、②、③的先后顺序是①→
(3)反应一段时间后,取仪器B中少量固体,加入稀H2SO4,溶液变蓝色且有红色不溶性固体。据此现象能否说明反应产物中含Cu2O?
您最近半年使用:0次
2021-05-21更新
|
316次组卷
|
5卷引用:浙江省2020年7月普通高中学业水平考试化学试题
浙江省2020年7月普通高中学业水平考试化学试题浙江省上海外国语大学附属宏达高级中学2020-2021学年高二10月月考化学试题(已下线)【浙江新东方】高中化学20210513-022【2021】【高一下】(已下线)【浙江新东方】双师304高一下浙江省平阳县万全综合高级中学2021-2022学年高一下学期期中考试化学试题
名校
2 . 碱式碳酸铜又名孔雀石,主要成分为Cu2(OH)2CO3,呈绿色,是一种具有广泛用途的化工产品。某化学小组探究制备碱式碳酸铜的反应条件并制备少量碱式碳酸铜。
试剂:0.25 mol·L-1 Na2CO3溶液、0.5 mol·L-1 NaOH溶液、0.5 mol·L-1 Cu(NO3)2溶液各100mL
实验1:探究Cu(NO3)2与NaOH和Na2CO3溶液配比
取三种反应溶液,以表中的比例混合,在60℃条件下进行实验,并观察现象。
注:“+”越多表示沉淀的相对量越多
实验2:探究反应温度
按上述实验得到的合适反应液用量,在不同温度下进行实验,并观察现象。
实验3:制备碱式碳酸铜
按最佳物料比取50mL 0.5 mol·L-1 Cu(NO3)2溶液、50mL 0.5 mol·L-1 NaOH溶液和相应体积的0.25 mol·L-1Na2CO3溶液,在最佳反应温度下进行实验,待反应完全后,静置,过滤、洗涤、干燥后,得到2.5 g产品。
请回答下列问题:
(1)本实验配制溶液时用到的玻璃仪器除烧杯、玻璃棒以外还有_______ 。
(2)制备碱式碳酸铜时,Cu(NO3)2、NaOH和Na2CO3溶液的最佳物质的量之比为_______ ,最佳反应温度为_______ ,本实验的加热方式为_______ 。
(3)请写出本实验制备碱式碳酸铜的化学方程式_______ 。
(4)实验2中在80℃反应生成的沉淀中有少量黑色的物质,产生该物质的原因可能是_______ 。
(5)简述实验3中洗涤沉淀的操作_______ 。
(6)计算本实验的产率_______ %(保留三位有效数字)。
试剂:0.25 mol·L-1 Na2CO3溶液、0.5 mol·L-1 NaOH溶液、0.5 mol·L-1 Cu(NO3)2溶液各100mL
实验1:探究Cu(NO3)2与NaOH和Na2CO3溶液配比
取三种反应溶液,以表中的比例混合,在60℃条件下进行实验,并观察现象。
| 编号 | V[Cu(NO3)2]/mL | V(NaOH)/mL | V(Na2CO3)/mL | 沉淀数量 | 沉淀颜色 |
| 1 | 2 | 2 | 2.8 | + + + | 蓝色 |
| 2 | 2 | 2 | 2.4 | + + + | 蓝色 |
| 3 | 2 | 2 | 2 | + + | 浅绿色 |
| 4 | 2 | 2 | 1.6 | + | 浅绿色 |
实验2:探究反应温度
按上述实验得到的合适反应液用量,在不同温度下进行实验,并观察现象。
| 反应温度/℃ | 沉淀数量 | 沉淀颜色 |
| 室温 | + + + + | 蓝色 |
| 40 | + + + + | 蓝色 |
| 60 | + | 浅绿色 |
| 75 | + + | 绿色 |
| 80 | + + + | 绿色(少量黑色) |
按最佳物料比取50mL 0.5 mol·L-1 Cu(NO3)2溶液、50mL 0.5 mol·L-1 NaOH溶液和相应体积的0.25 mol·L-1Na2CO3溶液,在最佳反应温度下进行实验,待反应完全后,静置,过滤、洗涤、干燥后,得到2.5 g产品。
请回答下列问题:
(1)本实验配制溶液时用到的玻璃仪器除烧杯、玻璃棒以外还有
(2)制备碱式碳酸铜时,Cu(NO3)2、NaOH和Na2CO3溶液的最佳物质的量之比为
(3)请写出本实验制备碱式碳酸铜的化学方程式
(4)实验2中在80℃反应生成的沉淀中有少量黑色的物质,产生该物质的原因可能是
(5)简述实验3中洗涤沉淀的操作
(6)计算本实验的产率
您最近半年使用:0次
3 . 碳粉、CO、H2均可作为实验室还原CuO的还原剂,实验小组对CuO的还原反应及还原产物组成进行探究。
查阅资料:
I .CuO还原反应中相关信息如表所示:
II .CuO高温分解生成Cu2O,Cu2O+2H+=Cu+Cu2++H2O;
II .PdCl2溶液能吸收CO,生成黑色Pd沉淀和一种氢化物、一种氧化物。
回答下列问题:
(1)实验室还原CuO适宜选用的还原剂为_______ ,理由为_______ 。
(2)小组同学用如图所示装置探究碳粉与CuO反应的产物。

①仪器a的名称为_______ 。
②试剂X的作用为_______ 。
③若气体产物中含有CO,则观察到的现象为_______ ;其中反应的化学方程式为_______ 。
(3)某小组同学为测定碳粉还原CuO后固体混合物中单质Cu的质量分数,设计如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸,过滤、洗涤、干燥,所得沉淀的质量为0.160 g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25.00mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.500 0 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为12.00mL。已知:2Cu2++5I-=2CuI↓+ ,
, +2
+2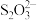 =
=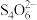 +3I-。
+3I-。
①溶解样品时,不能用稀硫酸代替稀硝酸的原因为_______ .。
②通过计算说明还原产物中是否含有Cu2O:_______ 。
③若CuI吸附部分 ,会导致所测Cu单质的质量分数
,会导致所测Cu单质的质量分数_______ .(填“偏大”“偏小”或“无影响”)。
查阅资料:
I .CuO还原反应中相关信息如表所示:
| 还原剂 | 反应温度/℃ | 产物性状 |
| 碳粉 | >800 | 可能混有砖红色固体或黑色固体 |
| CO | >500 | 可能混有砖红色固体 |
| H2 | 300左右 | 紫红色固体 |
II .PdCl2溶液能吸收CO,生成黑色Pd沉淀和一种氢化物、一种氧化物。
回答下列问题:
(1)实验室还原CuO适宜选用的还原剂为
(2)小组同学用如图所示装置探究碳粉与CuO反应的产物。

①仪器a的名称为
②试剂X的作用为
③若气体产物中含有CO,则观察到的现象为
(3)某小组同学为测定碳粉还原CuO后固体混合物中单质Cu的质量分数,设计如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸,过滤、洗涤、干燥,所得沉淀的质量为0.160 g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25.00mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.500 0 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为12.00mL。已知:2Cu2++5I-=2CuI↓+
 ,
, +2
+2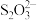 =
=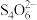 +3I-。
+3I-。①溶解样品时,不能用稀硫酸代替稀硝酸的原因为
②通过计算说明还原产物中是否含有Cu2O:
③若CuI吸附部分
 ,会导致所测Cu单质的质量分数
,会导致所测Cu单质的质量分数
您最近半年使用:0次
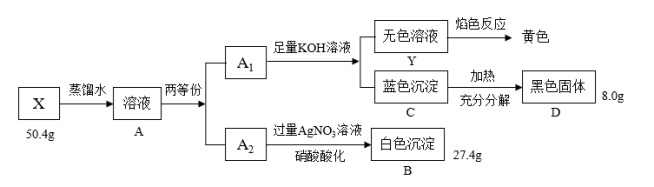
4 . Ⅰ.绿色粉末状固体化合物X由三种元素组成,取50.4gX,用蒸馏水完全溶解得绿色溶液A,将溶液A分成A1和A2两等份,完成如下实验:
请回答
(1)X的化学式是____ 。
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:____ 。
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式____ 。
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是____ 。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中____ (填实验现象),则可证明三草酸合铁酸钾热分解的气体产物是H2O、CO、CO2。
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:____ 。

请回答
(1)X的化学式是
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:
您最近半年使用:0次
2020-11-30更新
|
329次组卷
|
2卷引用:浙江省十校联盟2021届高三10月联考化学试题
19-20高三·浙江·阶段练习
5 . I.无机矿物盐X含五种元素,某学习小组进行了如下实验:
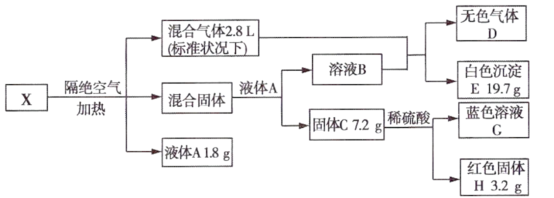
已知:混合固体由两种物质组成,物质的量之比为2:1,总质量为22.5g;通入混合气体后溶液B中溶质恰好反应完全,白色沉淀E可溶于稀盐酸;无色气体D为单一气体,可使带火星木条复燃;固体C为砖红色。
请回答:.
(1)X中5种元素是____________ (用元素符号表示)。
(2)无机矿物盐X的化学式为____________ 。
(3)固体C与稀硫酸反应的离子方程式为____________ 。
II.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均匀时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成,他们进行了如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有____________ 。
(2)用以下装置可以说明产物中有Fe3O4存在,检查装置的气密性。往装置中添加相应的药品,接下来的一步操作为____________ 。

(3)为进一步证明黑色粉末中是否含有Fe3O4,某同学设计的实验方案为:取少量黑色粉末于试管中,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因____________ 。

已知:混合固体由两种物质组成,物质的量之比为2:1,总质量为22.5g;通入混合气体后溶液B中溶质恰好反应完全,白色沉淀E可溶于稀盐酸;无色气体D为单一气体,可使带火星木条复燃;固体C为砖红色。
请回答:.
(1)X中5种元素是
(2)无机矿物盐X的化学式为
(3)固体C与稀硫酸反应的离子方程式为
II.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末能被磁铁吸引。查阅资料得知:在温度不同、受热不均匀时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成,他们进行了如下实验。
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
(2)用以下装置可以说明产物中有Fe3O4存在,检查装置的气密性。往装置中添加相应的药品,接下来的一步操作为

(3)为进一步证明黑色粉末中是否含有Fe3O4,某同学设计的实验方案为:取少量黑色粉末于试管中,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象。请分析此方案是否可行,并解释原因
您最近半年使用:0次
解题方法
6 . 某化学实验小组为了探究氨气的还原性设计了如下实验:
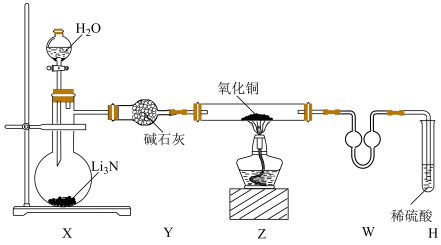
已知:Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+ CuSO4+H2O。
(1)装置X中发生反应的化学方程式为____________ ,装置W的作用是____________ 。
(2)随着反应的进行,装置Z中的固体逐渐变成红色,为了探究红色固体的成分,充分反应后进行了如下实验:
(3)为了测定该红色固体的定量组成,该化学实验小组又进行了如下实验:称量20.8 g该红色固体,加入足量稀硫酸,充分搅拌,将反应后的混合物过滤、洗涤、干燥、称重,得固体12.8 g。则20.8 g红色固体中的成分及质量为________ 。
(4)由(3)可知,装置Z中发生反应的化学方程式为_________ 。

已知:Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+ CuSO4+H2O。
(1)装置X中发生反应的化学方程式为
(2)随着反应的进行,装置Z中的固体逐渐变成红色,为了探究红色固体的成分,充分反应后进行了如下实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 无现象 | ①红色固体为 |
| 溶液变蓝 | ②红色固体中肯定含有 |
(4)由(3)可知,装置Z中发生反应的化学方程式为
您最近半年使用:0次
2020-11-06更新
|
228次组卷
|
2卷引用:河南省豫南九校2021届高三11月联考化学试题
7 . 某化学实验小组同学用惰性电极电解饱和食盐水(含少量 、
、 ),并进行下图相关实验,电解一段时间后,各部分装置及对应的现象为:(1)中黑色固体变红;(2)中电极a附近溶液出现浑浊;(3)中溶液出现浑浊;(4)中溶液红色褪去。下列对实验现象解释不合理的是
),并进行下图相关实验,电解一段时间后,各部分装置及对应的现象为:(1)中黑色固体变红;(2)中电极a附近溶液出现浑浊;(3)中溶液出现浑浊;(4)中溶液红色褪去。下列对实验现象解释不合理的是

 、
、 ),并进行下图相关实验,电解一段时间后,各部分装置及对应的现象为:(1)中黑色固体变红;(2)中电极a附近溶液出现浑浊;(3)中溶液出现浑浊;(4)中溶液红色褪去。下列对实验现象解释不合理的是
),并进行下图相关实验,电解一段时间后,各部分装置及对应的现象为:(1)中黑色固体变红;(2)中电极a附近溶液出现浑浊;(3)中溶液出现浑浊;(4)中溶液红色褪去。下列对实验现象解释不合理的是
| A.(1)中红色物质中可能含有少量氧化亚铜 |
B.(2)中a电极附近浑浊是 所致 所致 |
| C.(3)中发生了置换反应 |
D.(4)中红色褪去是因为 被消耗,溶液不再具有强碱性所致 被消耗,溶液不再具有强碱性所致 |
您最近半年使用:0次
解题方法
8 . 铝、铁、铜是生活中常见的金属。
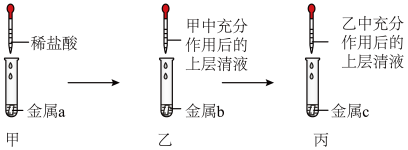
(1)铝、铁、铜三种金属都能作导线,是因为它们都具有________ 。
(2)铝在空气中不易被锈蚀,是因为_____________ (用化学方程式表示)。
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、____ 共同作用的结果。
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为______ 时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为________________ 若金属a、b、c依次为铁、铝、铜时,则无法比较___ 和___ 的活动性强弱。

(1)铝、铁、铜三种金属都能作导线,是因为它们都具有
(2)铝在空气中不易被锈蚀,是因为
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为
您最近半年使用:0次
2020-08-06更新
|
76次组卷
|
2卷引用:开学考试化学试卷03——2020年秋季高一新生入学分班考试化学试卷(全国通用)
19-20高三·浙江·阶段练习
解题方法
9 . 化合物X(仅由两种元素组成)具有良好的电学和光学性能。为研究该化合物的性质,进行如下实验:
①将X在隔绝空气的条件下高温加热,有无色无味气体A和紫红色固体B生成;
②称取4.12g X样品加入足量稀硫酸中,充分反应后,溶液显蓝色,同时也有紫红色固体B产生。过滤,向滤液中加入足量氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体C(标准状况下体积为0. 448L,假设气体全部逸出)。
回答下列问题:
(1)气体A分子的结构式为________ ,气体 C的分子式为_____________ 。
(2)X中所含金属元素的名称为_________ , X 中该金属元素的化合价为__________ 。
(3)X可由气体C和固体B在高温条件下发生置换反应得到,写出该反应方程式_____ 。
(4)为进一步探究气体C的性质,某同学用如图所示装置(末端还有部分装置省略)进行实验,一段时间后。观察到M装置的硬质玻璃管里有黑色固体产生,N装置U形管里无水硫酸铜变蓝。

该同学根据上述现象得出结论:黑色固体为单质铁,说明气体C有还原性。你认为该同学作出的“黑色固体为单质铁”判断是否正确?说明理由____________ 。
①将X在隔绝空气的条件下高温加热,有无色无味气体A和紫红色固体B生成;
②称取4.12g X样品加入足量稀硫酸中,充分反应后,溶液显蓝色,同时也有紫红色固体B产生。过滤,向滤液中加入足量氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体C(标准状况下体积为0. 448L,假设气体全部逸出)。
回答下列问题:
(1)气体A分子的结构式为
(2)X中所含金属元素的名称为
(3)X可由气体C和固体B在高温条件下发生置换反应得到,写出该反应方程式
(4)为进一步探究气体C的性质,某同学用如图所示装置(末端还有部分装置省略)进行实验,一段时间后。观察到M装置的硬质玻璃管里有黑色固体产生,N装置U形管里无水硫酸铜变蓝。

该同学根据上述现象得出结论:黑色固体为单质铁,说明气体C有还原性。你认为该同学作出的“黑色固体为单质铁”判断是否正确?说明理由
您最近半年使用:0次
10 . CuCl2是常见的化学试剂,学习小组开展了与CuCl2相关的系列实验。回答下列问题:
I.利用废铜屑制备CuCl2(实验装置如下图所示)
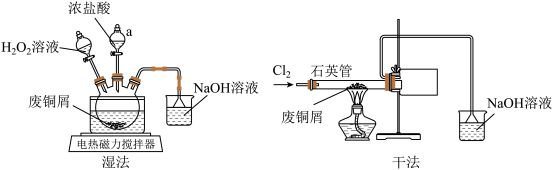
(1)仪器a的名称为_______ 。
(2)“湿法”制备CuCl2的化学方程式为_______ 。
(3)①石英管内可能观察到的现象为_______ 。
②石英管直接伸入收集装置,该管较粗,其优点是_______ 。
(4)除上述两种方法外,实验室中还可先将铜粉_______ (填试剂及操作),再加入适量稀盐酸反应得到CuCl2溶液。
II.探究Al与CuCl2溶液的反应
将铝片放入盛有0.1mol·L-1CuCl2溶液的试管中,观察到现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体,溶液颜色变浅。
(5)紫红色固体为_______ (填化学式)。
(6)经检验产生的气体为H2.在CuCl2溶液中存在Cu2++2H2O=Cu(OH)2+2H+、2A1+6H+=2A13++3H2↑,小组成员认为应产生Cu(OH)2,但实际实验中并未观察到蓝色沉淀。于是他们提出了以下两种猜测并进行相关验证。完成下列表格:
③在猜测ii成立的基础上,该小组成员查阅文献发现体系中可能存在反应:2A13++3Cu(OH)2=2Al(OH)3+3Cu2+,列式计算平衡常数分析该反应进行的趋势___________________ 。(已知:Ksp[Cu(OH)2]=2.2×10-20;Ksp[A1(OH)3]=1.3×10-33。一般认为,K>105时反应进行较完全,K<10-5时反应难以进行)文献显示生成的Al(OH)3可能以胶体形式存在,这是未观察到白色沉淀的可能原因,但仍需进一步深入研究。
I.利用废铜屑制备CuCl2(实验装置如下图所示)

(1)仪器a的名称为
(2)“湿法”制备CuCl2的化学方程式为
(3)①石英管内可能观察到的现象为
②石英管直接伸入收集装置,该管较粗,其优点是
(4)除上述两种方法外,实验室中还可先将铜粉
II.探究Al与CuCl2溶液的反应
将铝片放入盛有0.1mol·L-1CuCl2溶液的试管中,观察到现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体,溶液颜色变浅。
(5)紫红色固体为
(6)经检验产生的气体为H2.在CuCl2溶液中存在Cu2++2H2O=Cu(OH)2+2H+、2A1+6H+=2A13++3H2↑,小组成员认为应产生Cu(OH)2,但实际实验中并未观察到蓝色沉淀。于是他们提出了以下两种猜测并进行相关验证。完成下列表格:
| 猜测 | 实验 | 现象 | 结论 |
| i.① | 取少量Cu(OH)2悬浊液,加入打磨过的铝片,振荡 | 无明显现象 | 猜想i不成立 |
| ii.Cu(OH)2与Al3+发生了反应 | ② | 固体立即溶解,溶液呈浅绿色 | 猜想ii成立 |
您最近半年使用:0次



