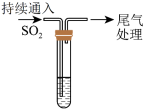
1 . 某中学同学在做铜与浓硫酸(装置如图)的反应实验时,发现有如下的反应现象:加热初期,铜丝表面变黑;继续加热,有大量气泡产生,品红溶液褪色,溶液变为墨绿色浊液,试管底部开始有灰白色沉淀生成;再加热,试管中出现“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多;冷却,静置,将试管中液体倒入另一支盛水试管中,管壁发汤,溶液略带蓝色,将灰白色固体倒入水中,形成蓝色溶液。

(1)资料:聚四氯乙烯受热分解产生氯化氢,[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。该反应中,品红溶液褪色,体现SO2的______ 性,NaOH溶液的作用是______ 。
该中学同学分成几个小组分别对上述现象探究:
(2)甲组同学查相关文献资料获知:在较低温度(100℃)下,浓硫酸氧化性相对较弱,生成的黑色沉淀为Cu2S,溶液变蓝,但没有气泡产生。请根据文献资料写出反应的化学方程式:______ 。
(3)乙组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
请解释形成墨绿色的原因:______ 。
(4)丙组同学对白雾的成分经检验为H2SO4,请设计实验证明该白雾为硫酸:______ 。溶液的蓝色变浅,灰白色沉淀增多,这现象体现浓硫酸的______ 性。
(5)丁组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:
滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有______ 。
滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,溶液呈略黄色[CuCln]2-n(n=1~4)。写出CuS与浓盐酸反应的离子方程式:______ 。
最后,丁组同学经过实验论证证明黑色沉淀中除了有CuS、Cu2S,还有S等。

(1)资料:聚四氯乙烯受热分解产生氯化氢,[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。该反应中,品红溶液褪色,体现SO2的
该中学同学分成几个小组分别对上述现象探究:
(2)甲组同学查相关文献资料获知:在较低温度(100℃)下,浓硫酸氧化性相对较弱,生成的黑色沉淀为Cu2S,溶液变蓝,但没有气泡产生。请根据文献资料写出反应的化学方程式:
(3)乙组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
| 现象 | ||
| I组 | 取灼烧后的铜丝 | 溶液变蓝 |
| Ⅱ组 | 直接取其铜丝(表面有聚四氯乙烯薄膜) | 溶液变成墨绿色 |
(4)丙组同学对白雾的成分经检验为H2SO4,请设计实验证明该白雾为硫酸:
(5)丁组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:
滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有
滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,溶液呈略黄色[CuCln]2-n(n=1~4)。写出CuS与浓盐酸反应的离子方程式:
最后,丁组同学经过实验论证证明黑色沉淀中除了有CuS、Cu2S,还有S等。
您最近半年使用:0次
名校
解题方法
2 . 某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
已知:CuCl为白色固体,难溶于水,能溶于浓盐酸。下列说法不正确的是
| 装置 |
| |
| 序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 1.5mL1mol·L-1CuSO4溶液和3.5mL1mol·L-1NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL1mol·L-1CuCl2溶液和3.5mL1mol·L-1NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
| A.取少量Cu2O固体于试管中,加入5mL0.1mol·L-1NaOH溶液,持续通入SO2,若试管底部有少量紫红色固体,溶液呈绿色,证明实验Ⅰ中砖红色沉淀为Cu2O |
| B.将实验Ⅱ中白色沉淀洗涤干净后,加入浓盐酸,沉淀溶解,然后加入蒸馏水,产生白色沉淀,证明白色沉淀为CuCl |
| C.实验Ⅱ与实验Ⅰ现象不同是因为阴离子不同造成的 |
D.实验Ⅰ、Ⅱ中不一定生成了SO |
您最近半年使用:0次
名校
3 . 用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能 出现“亮→暗(或灭)→亮”现象的是
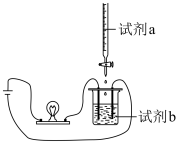

| 选项 | A | B | C | D |
| 试剂a |  |  |  |  |
| 试剂b |  | 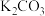 |  |  |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 . 某研究性学习小组为研究 与浓
与浓 的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、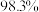
 、品红溶液(遇二氧化硫会褪色)、澄清石灰水、
、品红溶液(遇二氧化硫会褪色)、澄清石灰水、 、
、 溶液等药品,铜丝被卷成螺旋状,一端没入浓
溶液等药品,铜丝被卷成螺旋状,一端没入浓 中,另一端露置在液面上方。
中,另一端露置在液面上方。
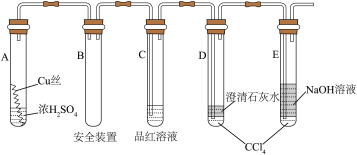
以下是该学习小组部分交流记录及后续探究实验的记录
根据上述材料回答下列问题
(1)D、E两支试管中 的作用是
的作用是___________ 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:___________ 。
(3)对A试管中的浓 和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:
和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:___________ 。
(4)根据上述研究,结合所学知识,你认为液面上方铜丝表面的黑色物质成分可能是___________ 和___________ 液面下方铜丝表面的黑色物质成分又可能是___________ 。(写化学式)
 与浓
与浓 的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)实验选用细铜丝、
 、品红溶液(遇二氧化硫会褪色)、澄清石灰水、
、品红溶液(遇二氧化硫会褪色)、澄清石灰水、 、
、 溶液等药品,铜丝被卷成螺旋状,一端没入浓
溶液等药品,铜丝被卷成螺旋状,一端没入浓 中,另一端露置在液面上方。
中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录
| 材料一:小组交流摘录 学生1:加热前,无现象发生:加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究! 学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的  。 。学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色  固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现: 固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现: (黑色)。 (黑色)。材料二:探究实验剪辑 实验1将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。 实验2截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝色。 实验3将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少  左右。 左右。 |
(1)D、E两支试管中
 的作用是
的作用是(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:
(3)对A试管中的浓
 和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:
和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:(4)根据上述研究,结合所学知识,你认为液面上方铜丝表面的黑色物质成分可能是
您最近半年使用:0次
解题方法
5 . SO2在生产生活中有重要作用。
(1)实验室用Na2SO3和浓硫酸制取SO2的化学方程式为_________ 。
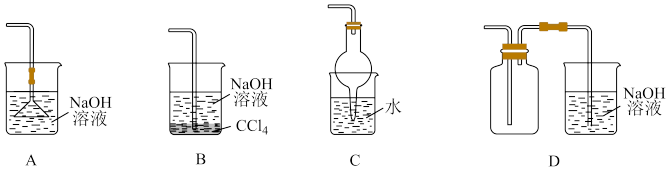
(2)下列装置适用于实验室对SO2进行尾气吸收的是_________ (填标号)。
(3)将SO2通入紫色石蕊溶液中,可观察到的现象是_________ 。
(4)某合作学习小组为探究SO2与新制Cu(OH)2悬浊液反应,设计并进行实验如下:
①经检测,实验Ⅰ、Ⅱ所得绿色溶液均能使品红溶液褪色,原因是_________ 。
②查阅资料可知,实验Ⅰ、Ⅱ所得黄色固体为Cu2O,则生成Cu2O的离子方程式为_________ ,(已知:Cu2O在酸性条件下不稳定, )
)
③为探究实验Ⅱ中白色沉淀的成分,该小组同学进行如下实验:
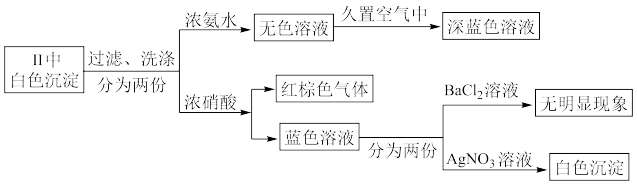
已知:[Cu(NH3)2]+无色,易被氧化为深蓝色[Cu(NH3)4]2+,由上可知,该白色沉淀为_________ (填化学式)。
④根据以上实验可知,SO2与新制Cu(OH)2悬浊液反应,与SO2的用量、_________ 等因素有关。
(1)实验室用Na2SO3和浓硫酸制取SO2的化学方程式为
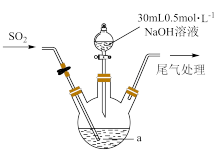
(2)下列装置适用于实验室对SO2进行尾气吸收的是

(3)将SO2通入紫色石蕊溶液中,可观察到的现象是
(4)某合作学习小组为探究SO2与新制Cu(OH)2悬浊液反应,设计并进行实验如下:
| 装置 | 实验 | a中试剂 | 实验操作 | 通入SO2气体后a中现象 |
 | Ⅰ | 15mL CuSO4溶液 CuSO4溶液 | 先打开分液漏斗活塞,将NaOH溶液全部滴入a中,制得蓝色Cu(OH)2悬浊液;再关闭活塞,打开止水夹,持续通入SO2气体 | 开始可观察到局部有黄色固体生成,待Cu(OH)2全部溶解后,得到绿色溶液和少量紫红色固体。 |
| Ⅱ | 15mL CuCl2溶液 CuCl2溶液 | 开始可观察到局部有黄色固体生成,待Cu(OH)2全部溶解后,得到绿色溶液和大量白色固体, |
②查阅资料可知,实验Ⅰ、Ⅱ所得黄色固体为Cu2O,则生成Cu2O的离子方程式为
 )
)③为探究实验Ⅱ中白色沉淀的成分,该小组同学进行如下实验:

已知:[Cu(NH3)2]+无色,易被氧化为深蓝色[Cu(NH3)4]2+,由上可知,该白色沉淀为
④根据以上实验可知,SO2与新制Cu(OH)2悬浊液反应,与SO2的用量、
您最近半年使用:0次
名校
解题方法
6 . 某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。请回答下列问题:
和胆矾晶体。请回答下列问题:
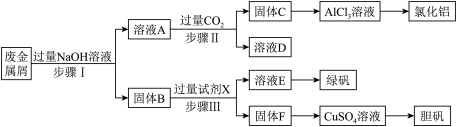
(1)写出步骤I反应的离子方程式__________________________________________________ ;
(2)步骤II中,溶液A中含铝化合物与过量 反应生成固体C的离⼦⽅程式为
反应生成固体C的离⼦⽅程式为____________ ;
(3)在步骤II时,⽤如图装置制取 并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是________ 。

(4)步骤III中试剂X是__________ 。
(5)取步骤III所得溶液E,滴加足量NaOH溶液,观察到的现象为__________ ,产生明显现象的化学方程式为__________ 。
 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。请回答下列问题:
和胆矾晶体。请回答下列问题:
(1)写出步骤I反应的离子方程式
(2)步骤II中,溶液A中含铝化合物与过量
 反应生成固体C的离⼦⽅程式为
反应生成固体C的离⼦⽅程式为(3)在步骤II时,⽤如图装置制取
 并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
并通入溶液A中。⼀段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是
(4)步骤III中试剂X是
(5)取步骤III所得溶液E,滴加足量NaOH溶液,观察到的现象为
您最近半年使用:0次
2022-11-24更新
|
299次组卷
|
2卷引用:天津市第一中学2022-2023学年高一上学期第二次月考化学试题
名校
解题方法
7 . 某小组为了探究 溶液和
溶液和 溶液反应的情况,开展了如下活动。回答下列问题:
溶液反应的情况,开展了如下活动。回答下列问题:
【查阅资料】
①CuCl、CuI为难溶于水的白色固体;
② 在酸性环境中易歧化为Cu和
在酸性环境中易歧化为Cu和 ;
;
③ (无色溶液)
(无色溶液)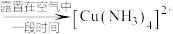 (深蓝色溶液)
(深蓝色溶液)
【理论预测】 溶液和
溶液和 溶液反应的主要含铜产物的可能情况:
溶液反应的主要含铜产物的可能情况:
(1)二者因发生复分解反应生成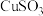 ;二者因发生双水解反应生成
;二者因发生双水解反应生成___________ ;二者因发生氧化还原反应生成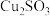 、CuCl;……
、CuCl;……
【实验探究一】 溶液和
溶液和 溶液反应
溶液反应
(2)取少量实验1中已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到___________ ,反应的离子方程式为___________ ;露置一段时间,又观察到___________ ,证明白色沉淀为CuCl。
【实验探究二】棕黄色沉淀的成分探究
(3)实验1中棕黄色沉淀存在时间较短,难以获得。实验小组将实验1中的 溶液替换为等体积等浓度的
溶液替换为等体积等浓度的___________ 溶液,成功制备了棕黄色沉淀,并进行了如下实验。
(4)实验2中可观察到现象:___________ ,证棕黄色沉淀中含有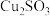 。
。
(5)实验3中因发生了反应___________ 、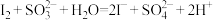 ,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是
,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是 ,试剂1是
,试剂1是___________ ;据此证明棕黄色沉淀中含有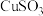 。
。
 溶液和
溶液和 溶液反应的情况,开展了如下活动。回答下列问题:
溶液反应的情况,开展了如下活动。回答下列问题:【查阅资料】
①CuCl、CuI为难溶于水的白色固体;
②
 在酸性环境中易歧化为Cu和
在酸性环境中易歧化为Cu和 ;
;③
 (无色溶液)
(无色溶液)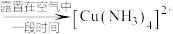 (深蓝色溶液)
(深蓝色溶液)【理论预测】
 溶液和
溶液和 溶液反应的主要含铜产物的可能情况:
溶液反应的主要含铜产物的可能情况:(1)二者因发生复分解反应生成
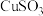 ;二者因发生双水解反应生成
;二者因发生双水解反应生成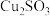 、CuCl;……
、CuCl;……【实验探究一】
 溶液和
溶液和 溶液反应
溶液反应| 编号 | 实验操作 | 实验现象 |
| 1 | 2mL0.2  溶液和1mL0.2 溶液和1mL0.2  溶液混合 溶液混合 | 立即有棕黄色沉淀生成,3min后沉淀颜色变浅并伴有少量白色沉淀产生,再振荡1min后沉淀全部变为白色 |
(2)取少量实验1中已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到
【实验探究二】棕黄色沉淀的成分探究
(3)实验1中棕黄色沉淀存在时间较短,难以获得。实验小组将实验1中的
 溶液替换为等体积等浓度的
溶液替换为等体积等浓度的| 编号 | 实验操作 |
| 2 | 取少量洗净的裟黄色沉淀于试管中,并加入一定量的稀硫酸 |
| 3 | 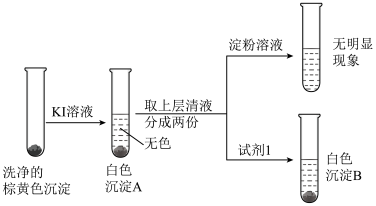 注:实验所用试剂均经过除氧处理 |
(4)实验2中可观察到现象:
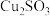 。
。(5)实验3中因发生了反应
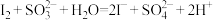 ,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是
,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是 ,试剂1是
,试剂1是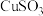 。
。
您最近半年使用:0次
8 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
I.测定绿矾中结晶水含量
为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
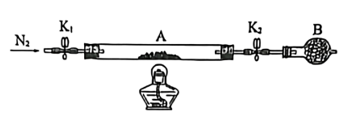
(1)将下列实验操作步骤正确排序________→________→________→________→c→e(填字母)______ ;重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却到室温
(2)根据实验记录,计算绿矾化学式中结晶水数目x=______ (列式表示)。
II.探究绿矾的热分解产物
该小组用如图所示装置进行实验(夹持仪器略)。
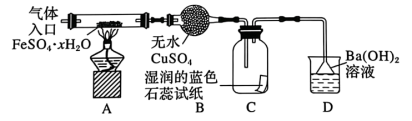
(3)在实验过程中,观察到A中固体变红棕色,B中的现象:______ ;C中试纸的颜色变化是_____ 。
(4)D中有白色沉淀生成,该沉淀的化学式为______ 。有同学认为还应该增加一个实验,取D中沉淀,加入一定量的盐酸以确定其组成,从而确定FeSO4·xH2O的分解产物,你认为是否必要?______ (填“是”或者“否”)请说明你的理由:______ 。
III.测定绿矾热分解时的温度与剩余固体质量关系
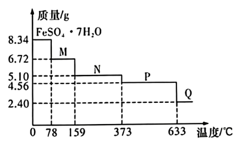
(5)将8.34gFeSO4∙7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。已知M(FeSO4∙7H2O)=278g∙mol-1,在100℃时,M的化学式为______ 。
I.测定绿矾中结晶水含量
为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。

(1)将下列实验操作步骤正确排序________→________→________→________→c→e(填字母)
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却到室温
(2)根据实验记录,计算绿矾化学式中结晶水数目x=
II.探究绿矾的热分解产物
该小组用如图所示装置进行实验(夹持仪器略)。

(3)在实验过程中,观察到A中固体变红棕色,B中的现象:
(4)D中有白色沉淀生成,该沉淀的化学式为
III.测定绿矾热分解时的温度与剩余固体质量关系
(5)将8.34gFeSO4∙7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。已知M(FeSO4∙7H2O)=278g∙mol-1,在100℃时,M的化学式为

您最近半年使用:0次
名校
9 . 某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO
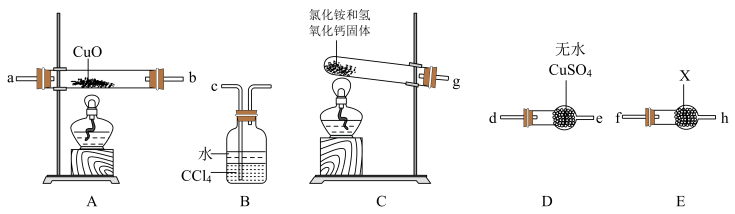
(1)装置C中发生的反应化学方程式为___________ 。
(2)试剂X为___________ 。
(3)请将提供的装置按合理顺序连接:g→___________ 。
(4)装置B的作用是___________ 。
(5)证明NH3能还原CuO的实验现象是___________ 。
Ⅱ.探究还原产物的成分
[查阅资料] Cu2O粉末呈红色,在酸性溶液中不稳定:
Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
[实验探究]
(6)
Ⅰ.验证NH3能还原CuO

(1)装置C中发生的反应化学方程式为
(2)试剂X为
(3)请将提供的装置按合理顺序连接:g→
(4)装置B的作用是
(5)证明NH3能还原CuO的实验现象是
Ⅱ.探究还原产物的成分
[查阅资料] Cu2O粉末呈红色,在酸性溶液中不稳定:
Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
[实验探究]
(6)
| 实验操作 | 实验现象 | 实验结论 |
| 取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | 证明红色固体为 |
| 若 | 证明红色固体肯定含有Cu2O,可能含有Cu |
您最近半年使用:0次
10 . 为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示:
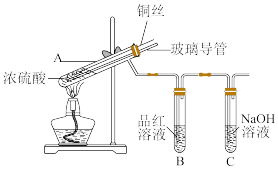
(1)装置A中发生反应的化学方程式为:_______ 。
(2)装置B中的现象为:_______ 。
(3)熄灭酒精灯后,B中的液体不会倒吸,其原因是:_______ 。
(4)拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是:_______ 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成 和铜单质,在空气中充分煅烧,可以转化为氧化铜。
和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
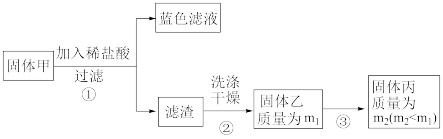
(5)确定乙是否煅烧完全的操作是:_______ 。
(6)煅烧过程中一定发生的化学反应方程式为:_______ 。
(7)由以上实验得出的结论是:甲中一定含有:_______ 。
【实验1】铜与浓硫酸反应,实验装置如图所示:

(1)装置A中发生反应的化学方程式为:
(2)装置B中的现象为:
(3)熄灭酒精灯后,B中的液体不会倒吸,其原因是:
(4)拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是:
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成
 和铜单质,在空气中充分煅烧,可以转化为氧化铜。
和铜单质,在空气中充分煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:

(5)确定乙是否煅烧完全的操作是:
(6)煅烧过程中一定发生的化学反应方程式为:
(7)由以上实验得出的结论是:甲中一定含有:
您最近半年使用:0次