名校
1 . FeCl3是中学常见的试剂,某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备___________ 。
(2)F的名称为___________ ,从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a-
,正确的接口顺序为a-___________ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的离子方程式
的离子方程式___________ 。
Ⅱ.探究FeCl3溶液与Cu的反应
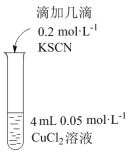
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想___________ (填“1”或“2”)不合理。
(5)根据实验2中的现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色);
(淡黄色);
反应B: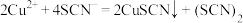 (黄色)。
(黄色)。
ii. 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A___________ (填“>”或“<”)B,说明反应B___________ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式___________ 。
(6)若向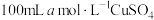 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量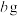 ,则
,则 的产率为
的产率为___________ (写出表达式即可)。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备
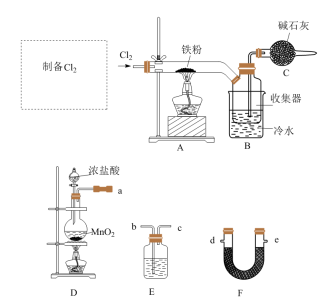
(2)F的名称为
 ,正确的接口顺序为a-
,正确的接口顺序为a-(3)写出装置D中制备
 的离子方程式
的离子方程式Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |
| 加入铜粉后无现象 |
| 实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后, 溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验2中的现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色);
(淡黄色);反应B:
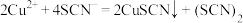 (黄色)。
(黄色)。ii.
 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式(6)若向
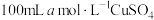 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量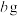 ,则
,则 的产率为
的产率为
您最近半年使用:0次
2023-03-10更新
|
1011次组卷
|
3卷引用:广东省广州大学附属中学2023-2024学年高三上学期开学考试化学试题
2 . 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况、某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐。该小组同学利用下图装置进行实验(部分夹持仪器略)。
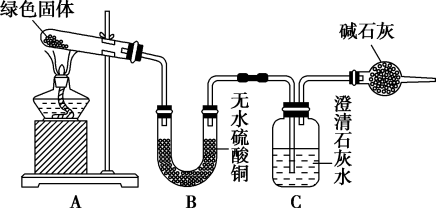
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色。B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)实验前,应检查装置的气密性,检查该装置气密性的方法是_______ 。
(2)加热后试管中剩余的黑色物质是_______ 。
(3)假设该绿色物质是一种纯净物,则其化学式可能是_______ (填化学式),加热分解的化学方程式为_______ 。
(4)上述实验步骤③中的反应的离子方程式为_______ 。
(5)实验装置最后干燥管的作用是_______ 。
(6)如果将B、C两装置对调,能否达到实验目的_______ (填“能”或“不能”),为什么?_______ 。

①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色。B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)实验前,应检查装置的气密性,检查该装置气密性的方法是
(2)加热后试管中剩余的黑色物质是
(3)假设该绿色物质是一种纯净物,则其化学式可能是
(4)上述实验步骤③中的反应的离子方程式为
(5)实验装置最后干燥管的作用是
(6)如果将B、C两装置对调,能否达到实验目的
您最近半年使用:0次
3 . 胆矾(CuSO4·5H2O)是一种重要化工原料。某研究小组以生锈的铜屑为原料(主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2)制备胆矾流程如图,下列说法不正确的是
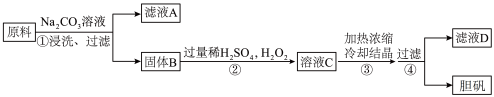

| A.步骤②中包含了氧化还原反应,氧化剂与还原剂的物质的量比为1∶1 |
| B.步骤③④得到的胆矾晶体,可以用水进行洗涤干燥 |
| C.往滤液D中加入淀粉-KI溶液,无明显现象 |
| D.将25g胆矾晶体与75g水混合,配制得到质量分数为16%的硫酸铜溶液 |
您最近半年使用:0次
解题方法
4 . SO2在生产生活中有重要作用。
(1)实验室用Na2SO3和浓硫酸制取SO2的化学方程式为_________ 。
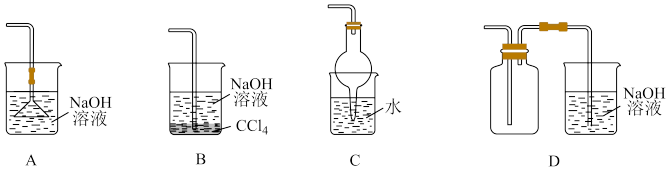
(2)下列装置适用于实验室对SO2进行尾气吸收的是_________ (填标号)。
(3)将SO2通入紫色石蕊溶液中,可观察到的现象是_________ 。
(4)某合作学习小组为探究SO2与新制Cu(OH)2悬浊液反应,设计并进行实验如下:
①经检测,实验Ⅰ、Ⅱ所得绿色溶液均能使品红溶液褪色,原因是_________ 。
②查阅资料可知,实验Ⅰ、Ⅱ所得黄色固体为Cu2O,则生成Cu2O的离子方程式为_________ ,(已知:Cu2O在酸性条件下不稳定,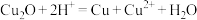 )
)
③为探究实验Ⅱ中白色沉淀的成分,该小组同学进行如下实验:
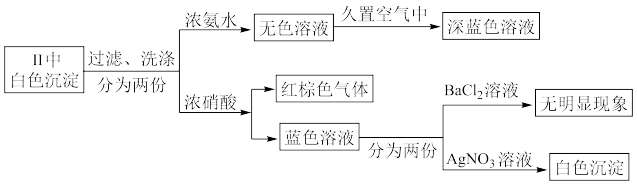
已知:[Cu(NH3)2]+无色,易被氧化为深蓝色[Cu(NH3)4]2+,由上可知,该白色沉淀为_________ (填化学式)。
④根据以上实验可知,SO2与新制Cu(OH)2悬浊液反应,与SO2的用量、_________ 等因素有关。
(1)实验室用Na2SO3和浓硫酸制取SO2的化学方程式为
(2)下列装置适用于实验室对SO2进行尾气吸收的是

(3)将SO2通入紫色石蕊溶液中,可观察到的现象是
(4)某合作学习小组为探究SO2与新制Cu(OH)2悬浊液反应,设计并进行实验如下:
| 装置 | 实验 | a中试剂 | 实验操作 | 通入SO2气体后a中现象 |
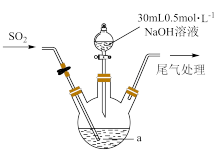 | Ⅰ | 15mL CuSO4溶液 CuSO4溶液 | 先打开分液漏斗活塞,将NaOH溶液全部滴入a中,制得蓝色Cu(OH)2悬浊液;再关闭活塞,打开止水夹,持续通入SO2气体 | 开始可观察到局部有黄色固体生成,待Cu(OH)2全部溶解后,得到绿色溶液和少量紫红色固体。 |
| Ⅱ | 15mL CuCl2溶液 CuCl2溶液 | 开始可观察到局部有黄色固体生成,待Cu(OH)2全部溶解后,得到绿色溶液和大量白色固体, |
②查阅资料可知,实验Ⅰ、Ⅱ所得黄色固体为Cu2O,则生成Cu2O的离子方程式为
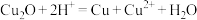 )
)③为探究实验Ⅱ中白色沉淀的成分,该小组同学进行如下实验:

已知:[Cu(NH3)2]+无色,易被氧化为深蓝色[Cu(NH3)4]2+,由上可知,该白色沉淀为
④根据以上实验可知,SO2与新制Cu(OH)2悬浊液反应,与SO2的用量、
您最近半年使用:0次
解题方法
5 . 某化学实验小组为了探究氨气的还原性设计了如下实验:
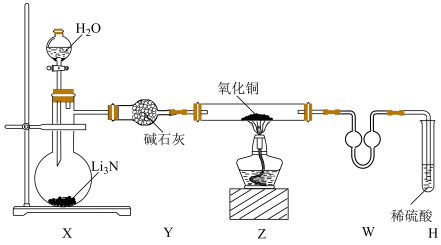
已知:Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+ CuSO4+H2O。
(1)装置X中发生反应的化学方程式为____________ ,装置W的作用是____________ 。
(2)随着反应的进行,装置Z中的固体逐渐变成红色,为了探究红色固体的成分,充分反应后进行了如下实验:
(3)为了测定该红色固体的定量组成,该化学实验小组又进行了如下实验:称量20.8 g该红色固体,加入足量稀硫酸,充分搅拌,将反应后的混合物过滤、洗涤、干燥、称重,得固体12.8 g。则20.8 g红色固体中的成分及质量为________ 。
(4)由(3)可知,装置Z中发生反应的化学方程式为_________ 。

已知:Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+ CuSO4+H2O。
(1)装置X中发生反应的化学方程式为
(2)随着反应的进行,装置Z中的固体逐渐变成红色,为了探究红色固体的成分,充分反应后进行了如下实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 无现象 | ①红色固体为 |
| 溶液变蓝 | ②红色固体中肯定含有 |
(4)由(3)可知,装置Z中发生反应的化学方程式为
您最近半年使用:0次
2020-11-06更新
|
228次组卷
|
2卷引用:广东省清远市2021届高三上学期摸底考试(11月) 化学试题
6 . CuCl2是常见的化学试剂,学习小组开展了与CuCl2相关的系列实验。回答下列问题:
I.利用废铜屑制备CuCl2(实验装置如下图所示)
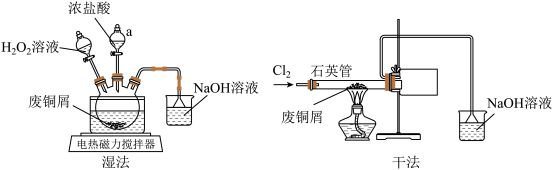
(1)仪器a的名称为_______ 。
(2)“湿法”制备CuCl2的化学方程式为_______ 。
(3)①石英管内可能观察到的现象为_______ 。
②石英管直接伸入收集装置,该管较粗,其优点是_______ 。
(4)除上述两种方法外,实验室中还可先将铜粉_______ (填试剂及操作),再加入适量稀盐酸反应得到CuCl2溶液。
II.探究Al与CuCl2溶液的反应
将铝片放入盛有0.1mol·L-1CuCl2溶液的试管中,观察到现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体,溶液颜色变浅。
(5)紫红色固体为_______ (填化学式)。
(6)经检验产生的气体为H2.在CuCl2溶液中存在Cu2++2H2O=Cu(OH)2+2H+、2A1+6H+=2A13++3H2↑,小组成员认为应产生Cu(OH)2,但实际实验中并未观察到蓝色沉淀。于是他们提出了以下两种猜测并进行相关验证。完成下列表格:
③在猜测ii成立的基础上,该小组成员查阅文献发现体系中可能存在反应:2A13++3Cu(OH)2=2Al(OH)3+3Cu2+,列式计算平衡常数分析该反应进行的趋势___________________ 。(已知:Ksp[Cu(OH)2]=2.2×10-20;Ksp[A1(OH)3]=1.3×10-33。一般认为,K>105时反应进行较完全,K<10-5时反应难以进行)文献显示生成的Al(OH)3可能以胶体形式存在,这是未观察到白色沉淀的可能原因,但仍需进一步深入研究。
I.利用废铜屑制备CuCl2(实验装置如下图所示)

(1)仪器a的名称为
(2)“湿法”制备CuCl2的化学方程式为
(3)①石英管内可能观察到的现象为
②石英管直接伸入收集装置,该管较粗,其优点是
(4)除上述两种方法外,实验室中还可先将铜粉
II.探究Al与CuCl2溶液的反应
将铝片放入盛有0.1mol·L-1CuCl2溶液的试管中,观察到现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体,溶液颜色变浅。
(5)紫红色固体为
(6)经检验产生的气体为H2.在CuCl2溶液中存在Cu2++2H2O=Cu(OH)2+2H+、2A1+6H+=2A13++3H2↑,小组成员认为应产生Cu(OH)2,但实际实验中并未观察到蓝色沉淀。于是他们提出了以下两种猜测并进行相关验证。完成下列表格:
| 猜测 | 实验 | 现象 | 结论 |
| i.① | 取少量Cu(OH)2悬浊液,加入打磨过的铝片,振荡 | 无明显现象 | 猜想i不成立 |
| ii.Cu(OH)2与Al3+发生了反应 | ② | 固体立即溶解,溶液呈浅绿色 | 猜想ii成立 |
您最近半年使用:0次
7 . 某化学小组设计实验,探究“NO2是否能与炽热的铜反应生成氧化铜和氮气”。
已知:①NO和FeSO4溶液反应:NO+FeSO4=FeSO4·NO(棕色)
②酸性KMnO4溶液吸收NO生成NO 和Mn2+
和Mn2+
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu2++Cu+H2O
设计实验所需装置如图所示(每个装置中液态试剂均足量,且不考虑A装置挥发出的硝酸对后续装置的影响)。
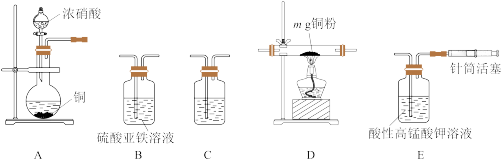
回答下列问题:
(1)该实验装置较复杂,检查气密性时采用分段检查的方法,请写出A装置气密性的检验方法___ 。
(2)该实验装置的连接顺序为:___ (填装置字母代号),C装置中盛装试剂是___ (填名称)。
(3)开始实验先引发A中反应,一段时间后再点燃D处酒精灯,这样操作的目的是___ 。
(4)实验过程中观察到下列现象,请回答:
①B中浅绿色溶液变棕色得出实验结论是___
a.二氧化氮与铜反应的还原产物一定有NO
b.二氧化氮与铜反应的还原产物一定无NO
c.二氧化氮与铜反应的还原产物可能有NO
②E中有明显现象,该现象是___ ,写出发生反应的离子方程式___ 。
(5)当D中铜粉完全反应时冷却至室温,停止A中反应,测得反应后D中固体粉末质量为ag,
①当a=___ (用含m的代数式表示)时,铜被氧化的产物全部是CuO;
②设计最简单的实验方案,验证反应后D中固体是否含有Cu2O___ (试剂选任)
已知:①NO和FeSO4溶液反应:NO+FeSO4=FeSO4·NO(棕色)
②酸性KMnO4溶液吸收NO生成NO
 和Mn2+
和Mn2+③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu2++Cu+H2O
设计实验所需装置如图所示(每个装置中液态试剂均足量,且不考虑A装置挥发出的硝酸对后续装置的影响)。

回答下列问题:
(1)该实验装置较复杂,检查气密性时采用分段检查的方法,请写出A装置气密性的检验方法
(2)该实验装置的连接顺序为:
(3)开始实验先引发A中反应,一段时间后再点燃D处酒精灯,这样操作的目的是
(4)实验过程中观察到下列现象,请回答:
①B中浅绿色溶液变棕色得出实验结论是
a.二氧化氮与铜反应的还原产物一定有NO
b.二氧化氮与铜反应的还原产物一定无NO
c.二氧化氮与铜反应的还原产物可能有NO
②E中有明显现象,该现象是
(5)当D中铜粉完全反应时冷却至室温,停止A中反应,测得反应后D中固体粉末质量为ag,
①当a=
②设计最简单的实验方案,验证反应后D中固体是否含有Cu2O
您最近半年使用:0次
解题方法
8 . 孔雀石的主要成分为Cu2(OH)2CO3,还含少量的FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如表。请回答:
(1)孔雀石首先要粉碎,其目的是_____ ;溶液A中的金属阳离子有_________ ;若调pH=9.0将杂质铁元素除去,其后果是:________________________________ 。
(2) “除杂”时先加入足量H2O2,目的是________________________ ;再加入CuO固体调节溶液pH的范围至_________ ,其中加入CuO作用是____________________ 。
(3)操作X包括_________________________________ 、过滤和洗涤等;在进行该操作时,将溶液B再适当酸化目的是_________________________________________ 。
(4)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)________________ 。

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如表。请回答:
(1)孔雀石首先要粉碎,其目的是
(2) “除杂”时先加入足量H2O2,目的是
(3)操作X包括
(4)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)
您最近半年使用:0次
解题方法
9 . 氯化亚铜(CuCl)为白色晶体,易被氧化,微溶于水,能溶于浓盐酸,不溶于醇。利用下图装置制备CuCl (省略夹持和加热装置),在溶液中存在: 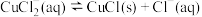 ,已知CuCl
,已知CuCl (aq)无色。下列说法
(aq)无色。下列说法错误 的是

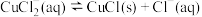 ,已知CuCl
,已知CuCl (aq)无色。下列说法
(aq)无色。下列说法
| A.仪器a的名称为恒压滴液漏斗 |
| B.烧瓶中的溶液由蓝色逐渐转变为无色 |
| C.为加快反应速率,可以用过量浓硝酸代替浓盐酸 |
| D.为避免CuCl的溶解损耗,可用95%的乙醇溶液洗涤沉淀 |
您最近半年使用:0次