2021·湖北·模拟预测
解题方法
1 . 某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu2O,制备流程如下:
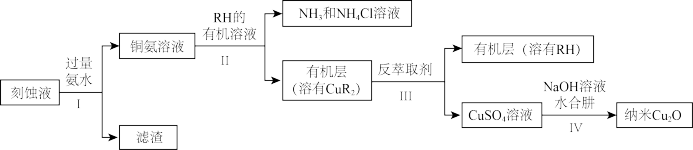
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu;Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4∙H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:___________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是__________
(3)步骤III,反萃取剂为________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是________
A. B.
B. C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_____
②若无操作误差,测定结果总是偏高的原因是_____

已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu;Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4∙H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:
(2)步骤II,需对水层多次萃取并合并萃取液的目的是
(3)步骤III,反萃取剂为
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是
A.
 B.
B. C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为
②若无操作误差,测定结果总是偏高的原因是
您最近半年使用:0次
2 . 五水合硫酸铜(CuSO4·5H2O)是蓝色晶体,某学生实验小组利用铜屑制备CuSO4·5H2O,并进行了相关实验。具体合成路线如下:

回答下列问题:
(1)铜屑需经预处理除去表面油污,方法是___________ 。
(2)步骤①的实验装置如图(a)所示(夹持、加热仪器略),其中浓硝酸需要逐滴加入,其原因是___________ 。(写出两点即可)
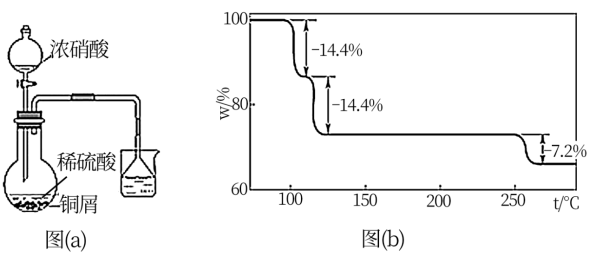
(3)CuSO4·5H2O在受热时质量分数(w)随温度的变化情况如图(b)所示。据此分析可知,CuSO4·5H2O受热过程可能发生的化学反应是___________ (填标号)。
A.

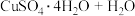
B.

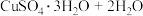
C.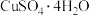

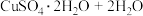
D.


(4)制备过程中若加热不当会导致晶体发白,为了得到蓝色的CuSO4·5H2O晶体,步骤③最适宜采用___________ (填标号)加热。
A. 电热套B.
电热套B. 酒精灯C.
酒精灯C. 水浴锅 D.煤气灯
水浴锅 D.煤气灯
(5)CuSO4·5H2O保存不当会失水风化,为测定所得产品中结晶水的含量,学生小组进行了如下实验:
①准确称取产品(CuSO4·xH2O)mg置于250mL锥形瓶中,用适量水溶解,加入足量KI,得到白色沉淀和I2的棕黄色溶液,相应的离子方程式为___________ 。
②以淀粉为指示剂,用浓度为cmol·L-1的Na2S2O3标准溶液滴定上述反应中生成的I2,滴定终点时的颜色变化为___________ 。
③滴定达终点时消耗Na2S2O3溶液VmL,则x=___________ (列表达式)。
(已知:滴定反应的离子方程式为: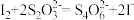 )
)
(6)请从原子经济性和环境友好的角度,设计由铜制备CuSO4·5H2O的合成路线___________ 。

回答下列问题:
(1)铜屑需经预处理除去表面油污,方法是
(2)步骤①的实验装置如图(a)所示(夹持、加热仪器略),其中浓硝酸需要逐滴加入,其原因是

(3)CuSO4·5H2O在受热时质量分数(w)随温度的变化情况如图(b)所示。据此分析可知,CuSO4·5H2O受热过程可能发生的化学反应是
A.


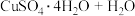
B.


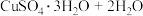
C.
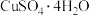

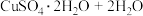
D.
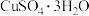


(4)制备过程中若加热不当会导致晶体发白,为了得到蓝色的CuSO4·5H2O晶体,步骤③最适宜采用
A.
 电热套B.
电热套B. 酒精灯C.
酒精灯C. 水浴锅 D.煤气灯
水浴锅 D.煤气灯
(5)CuSO4·5H2O保存不当会失水风化,为测定所得产品中结晶水的含量,学生小组进行了如下实验:
①准确称取产品(CuSO4·xH2O)mg置于250mL锥形瓶中,用适量水溶解,加入足量KI,得到白色沉淀和I2的棕黄色溶液,相应的离子方程式为
②以淀粉为指示剂,用浓度为cmol·L-1的Na2S2O3标准溶液滴定上述反应中生成的I2,滴定终点时的颜色变化为
③滴定达终点时消耗Na2S2O3溶液VmL,则x=
(已知:滴定反应的离子方程式为:
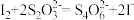 )
)(6)请从原子经济性和环境友好的角度,设计由铜制备CuSO4·5H2O的合成路线
您最近半年使用:0次
解题方法
3 . 硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉,3mol/L的硫酸,浓氨水,10%NaOH溶液,95%的乙醇溶液,0.500mol/L稀盐酸,0.500mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其晶体中氨的含量。
Ⅰ.CuSO4溶液的制备。
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为_______
Ⅱ.晶体的制备。将上述制备的CuSO4溶液按如图所示进行操作。
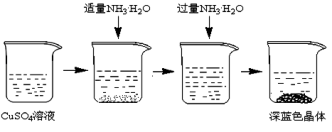
(2)向硫酸铜溶液中逐滴加入氨水至过量的过程中,可观察到的实验现象是_______
(3)请写出从上述溶液中析出深蓝色晶体的方法_______ 。采用该方法,而不采用浓缩结晶的原因是_______ 。
Ⅲ.氨含量的测定。精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/LNaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
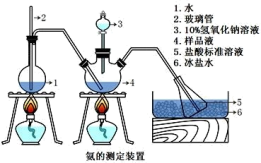
(4)样品中氨的质量分数的表达式_______ 。
(5)下列实验操作可能使氨含量测定结果偏高的原因是_______ 。
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
Ⅰ.CuSO4溶液的制备。
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为
Ⅱ.晶体的制备。将上述制备的CuSO4溶液按如图所示进行操作。

(2)向硫酸铜溶液中逐滴加入氨水至过量的过程中,可观察到的实验现象是
(3)请写出从上述溶液中析出深蓝色晶体的方法
Ⅲ.氨含量的测定。精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/LNaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。

(4)样品中氨的质量分数的表达式
(5)下列实验操作可能使氨含量测定结果偏高的原因是
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
您最近半年使用:0次
名校
解题方法
4 . 硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol·L-1的硫酸、浓氨水、10%NaOH溶液、95%的乙醇溶液、0.500mol·L-1稀盐酸、0.500mol·L-1的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在坩埚中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol·L-1的硫酸,将坩埚中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因___________ 。
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作:
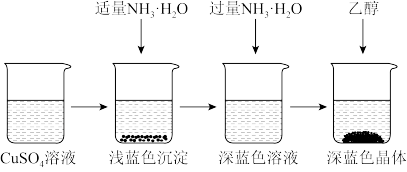
(2)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________ 。
(3)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是___________ 。
Ⅲ.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL 10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL C1mol·L-1的盐酸标准溶液完全吸收。取下接收瓶,用C2mol·L-1NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mL NaOH溶液。
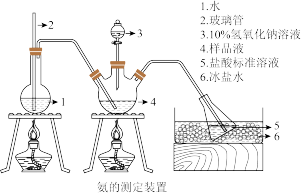
(4)玻璃管2的作用是___________ ,样品中氨的质量分数的表达式___________ 。
(5)下列实验操作可能使氨含量测定结果偏低的原因是___________ (填序号)。
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
I.CuSO4溶液的制备
①称取4g铜粉,在坩埚中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol·L-1的硫酸,将坩埚中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作:

(2)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式
(3)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是
Ⅲ.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL 10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL C1mol·L-1的盐酸标准溶液完全吸收。取下接收瓶,用C2mol·L-1NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mL NaOH溶液。

(4)玻璃管2的作用是
(5)下列实验操作可能使氨含量测定结果偏低的原因是
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
您最近半年使用:0次
5 . 硫酸铜是一种常见的化工产品,它在纺织、印染、 医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
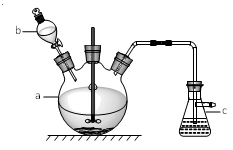
①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为_______ ;
(2)写出仪器a中反应的离子方程式:____________________ 。
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是_______________ 。
(4)为提高尾气吸收,防止空气污染,下列装置___________ (填字母)适合吸收逸出的气体(反应中产生的气体因来不及被石灰乳吸收而逸出)。

(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:___________ 。除去硫酸铜晶体中的少量硝酸铜可采用重结晶方法,检验硝酸铜是否被除净的方法:__________________ 。
(6)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成 100 mL 溶液,每次取 20. 00 mL,用 c mol • L-1 EDTA (H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。 滴定反应为Cu2++ H2Y2-→CuY2-+2H+。计算蓝色晶体中Cu2+质量分数w=____ 。

①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为
(2)写出仪器a中反应的离子方程式:
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是
(4)为提高尾气吸收,防止空气污染,下列装置

(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:
T/K | 273 | 293 | 313 | 333 | 353 | 373 | |
溶解度/ (g/100 g) | 五水硫酸铜 | 23.1 | 32.0 | 44.6 | 61.8 | 83.8 | 114.0 |
硝酸铜 | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 | |
您最近半年使用:0次
6 . (1)称量一定质量表面含油污的纯铜屑(铜含量为99.84%),置于坩埚中灼烧,将油污充分氧化后除去,直至铜屑表面均呈黑色。冷却后称量,固体质量比灼烧前增加了3.2 %,固体中铜与氧化铜的质量之比为_______。(请将结果化为小数,且保留至小数点后两位)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
您最近半年使用:0次
名校
解题方法
7 . 绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
Ⅰ.醋酸铜晶体的制备中

(1)用离子方程式表示过程①产物中OH-的来源:___________ ;
(2)过程②对应的化学方程式是:___________ 。
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2 +I2=
+I2= +2I-)
+2I-)
iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是_________ ;
(4)醋酸铜产品中铜元素的质量分数是_______ 。
Ⅰ.醋酸铜晶体的制备中

(1)用离子方程式表示过程①产物中OH-的来源:
(2)过程②对应的化学方程式是:
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2
 +I2=
+I2= +2I-)
+2I-)iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是
(4)醋酸铜产品中铜元素的质量分数是
您最近半年使用:0次
解题方法
8 . 实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。回答下列相关问题:

Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式_______________________________________ 。
(2)在制取SO2时,使用H2SO4溶液的浓度为__________ 时(填序号,从下列浓度中选取),制备SO2的速率明显快。请解释不选下列其它浓度硫酸的原因____________________ 。
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式___________________________ 。
②取红色沉淀物滴加盐酸,反应的离子方程式______________________________________ 。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-⇌I ,I2+2S2O
,I2+2S2O =S4O
=S4O +2I-。
+2I-。
①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为____________ 。
②CuI沉淀物对I 具有强的吸附能力,由此会造成CuSO4质量分数测定值
具有强的吸附能力,由此会造成CuSO4质量分数测定值_______ (填“偏大”或“偏小”)。

Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式
(2)在制取SO2时,使用H2SO4溶液的浓度为
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式
②取红色沉淀物滴加盐酸,反应的离子方程式
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-⇌I
 ,I2+2S2O
,I2+2S2O =S4O
=S4O +2I-。
+2I-。①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为
②CuI沉淀物对I
 具有强的吸附能力,由此会造成CuSO4质量分数测定值
具有强的吸附能力,由此会造成CuSO4质量分数测定值
您最近半年使用:0次
名校
9 . 铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式_____________________________ 。
(2)为了保护环境和节约资源,通常先用 和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式__________________________ 。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应: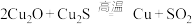 ,该反应的氧化剂是
,该反应的氧化剂是________ ;当生成 时,反应中转移的电子为
时,反应中转移的电子为______  。
。
(4)研究性学习小组用“间接碘量法”测定某试样中 (不含能与I-反应的氧化性杂质)的含量,取
(不含能与I-反应的氧化性杂质)的含量,取 试样配成
试样配成 溶液,每次取
溶液,每次取 ,滴加
,滴加 溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
溶液后有白色碘化物沉淀生成,写出该反应的离子方程式__________________________ 。
(5)继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫化硫酸钠标准溶液滴定,发生反应的化学方程式为: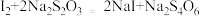 ,平均消耗
,平均消耗 的
的 溶液
溶液 。则试样中
。则试样中 的质量分数为
的质量分数为______________________ 。
(1)写出铜与稀硝酸反应的化学方程式
(2)为了保护环境和节约资源,通常先用
 和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:
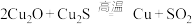 ,该反应的氧化剂是
,该反应的氧化剂是 时,反应中转移的电子为
时,反应中转移的电子为 。
。(4)研究性学习小组用“间接碘量法”测定某试样中
 (不含能与I-反应的氧化性杂质)的含量,取
(不含能与I-反应的氧化性杂质)的含量,取 试样配成
试样配成 溶液,每次取
溶液,每次取 ,滴加
,滴加 溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
溶液后有白色碘化物沉淀生成,写出该反应的离子方程式(5)继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫化硫酸钠标准溶液滴定,发生反应的化学方程式为:
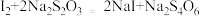 ,平均消耗
,平均消耗 的
的 溶液
溶液 。则试样中
。则试样中 的质量分数为
的质量分数为
您最近半年使用:0次
2020-04-29更新
|
123次组卷
|
2卷引用:天津市滨海新区塘沽一中2020届高三第一次月考
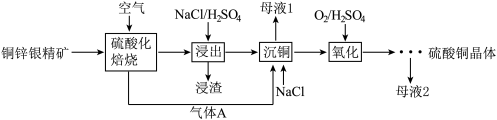
10 . 铜锌银精矿化学成分如下:
利用铜锌银精矿制备硫酸铜晶体的流程如下:
回答下列问题:
(l)“气体A”为____ (填化学式),“浸渣”中主要为硫酸铅和____ (填化学式)。
(2)“沉铜”得到Cu2Cl2固体,目的是____________ 。
(3)“氧化”工序中,恰好反应时氧化剂和还原剂物质的量之比为____ 。
(4)“母液2”中阴离子含量最多的是____ ,该溶液最好返回 __ 工序循环使用。
(5)依据铜锌银精矿化学成分进行分析,精矿中含有FeS2,理由是________ 。
| 元素 | Cu | Zn | Ag | S | Fe | Pb |
| 元素质量分数/% | 17.60 | 18.30 | 0.146 | 33.15 | 18.17 | 7.86 |
利用铜锌银精矿制备硫酸铜晶体的流程如下:

回答下列问题:
(l)“气体A”为
(2)“沉铜”得到Cu2Cl2固体,目的是
(3)“氧化”工序中,恰好反应时氧化剂和还原剂物质的量之比为
(4)“母液2”中阴离子含量最多的是
(5)依据铜锌银精矿化学成分进行分析,精矿中含有FeS2,理由是
您最近半年使用:0次



