 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为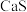 和
和 )为原料开发的一种合成介孔
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题: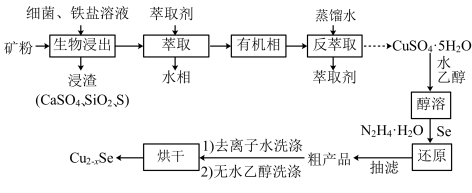
(1)基态
 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)“生物浸出”时,
 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为(3)将“浸渣”溶于
 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出(4)实验室“萃取”时,用到的主要仪器是
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是
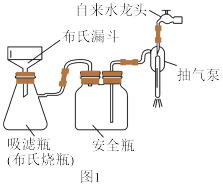
(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为
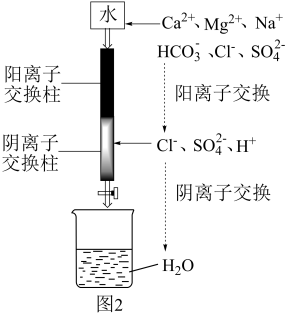
(7)某工厂用10吨该矿石合成介孔
 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,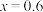 ,则最终可以得到
,则最终可以得到
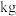 。
。

回答下列问题:
(1)铜屑需经预处理除去表面油污,方法是
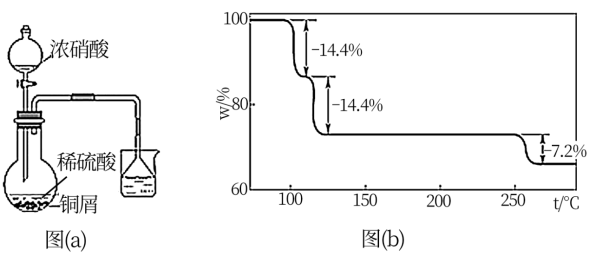
(2)步骤①的实验装置如图(a)所示(夹持、加热仪器略),其中浓硝酸需要逐滴加入,其原因是
(3)CuSO4·5H2O在受热时质量分数(w)随温度的变化情况如图(b)所示。据此分析可知,CuSO4·5H2O受热过程可能发生的化学反应是
A.


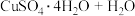
B.


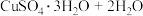
C.
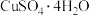

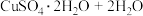
D.
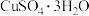


(4)制备过程中若加热不当会导致晶体发白,为了得到蓝色的CuSO4·5H2O晶体,步骤③最适宜采用
A.
 电热套B.
电热套B. 酒精灯C.
酒精灯C. 水浴锅 D.煤气灯
水浴锅 D.煤气灯
(5)CuSO4·5H2O保存不当会失水风化,为测定所得产品中结晶水的含量,学生小组进行了如下实验:
①准确称取产品(CuSO4·xH2O)mg置于250mL锥形瓶中,用适量水溶解,加入足量KI,得到白色沉淀和I2的棕黄色溶液,相应的离子方程式为
②以淀粉为指示剂,用浓度为cmol·L-1的Na2S2O3标准溶液滴定上述反应中生成的I2,滴定终点时的颜色变化为
③滴定达终点时消耗Na2S2O3溶液VmL,则x=
(已知:滴定反应的离子方程式为:
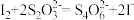 )
)(6)请从原子经济性和环境友好的角度,设计由铜制备CuSO4·5H2O的合成路线
题号 | 题型 | 分值 | 能力层次 | 知识点 | |
1 | 单选 | 2 | 了解 | 常见 | |
2 | 单选 | 2 | 了解 | 化学符号及名称的综合 | |
3 | 单选 | 2 | 了解 | 物质的性质与用途 | |
4 | 单选 | 2 | 了解 | 离子共存 | |
5 | 单选 | 2 | 了解 | 化学实验方案的评价 | |
6 | 单选 | 2 | 了解 | 离子方程式的书写判断 | |
7 | 单选 | 2 | 理解 | 常见元素单质及其化合物的综合应用 | |
8 | 单选 | 2 | 理解 | 元素周期律 | |
9 | 单选 | 2 | 理解 | 物质间的转化 | |
10 | 单选 | 2 | 理解 | 化学反应中的能量变化、化学反应速率、反应限度、弱电解质的电离 | |
11 | 不定项 | 4 | 理解 | 燃料电池 | |
12 | 不定项 | 4 | 理解 | 有机化学 | |
13 | 不定项 | 4 | 理解 | 实验原理和操作 | |
14 | 不定项 | 4 | 综合运用 | 弱电解质的电离平衡、水解平衡 | |
15 | 不定项 | 4 | 综合运用 | 化学平衡 | |
16 | 16-1 | 填空 | 2 | 了解 | 工业流程条件控制 |
16-2 | 填空 | 2 | 理解 | 实验操作分析 | |
16-3 | 填空 | 2 | 综合运用 | 离子方程式书写 | |
16-4 | 填空 | 2 | 理解 | 图像分析 | |
16-5 | 填空 | 2 | 理解 | 产物分析 | |
16-6 | 填空 | 2 | 理解 | 化学方程式书写 | |
17 | 17-1 | 填空 | 2 | 了解 | 常见有机化合物的官能团 |
17-2 | 填空 | 2 | 了解 | 判断有机反应类型 | |
17-3 | 填空 | 3 | 理解 | 同分异构体的书写 | |
17-4 | 填空 | 3 | 综合运用 | 有机物的结构推断 | |
17-5 | 填空 | 5 | 综合运用 | 设计合理路线合成简单有机物 | |
18 | 18-1-1 | 填空 | 2 | 综合运用 | Ksp计算 |
18-1-2 | 填空 | 2 | 理解 | 平衡常数计算 | |
18-2-1 | 填空 | 2 | 理解 | 滴定过程的误差分析 | |
18-2-2 | 填空 | 6 | 综合运用 | 化学计算 | |
19 | 19-1 | 填空 | 2 | 理解 | 加热方式的选择 |
19-2 | 填空 | 2 | 理解 | 实验分析 | |
19-3-1 | 填空 | 2 | 理解 | 化学方程式书写 | |
19-3-2 | 填空 | 2 | 了解 | 容器名称 | |
19-4 | 填空 | 2 | 综合运用 | 实验条件控制 | |
19-5 | 填空 | 5 | 综合运用 | 运用实验原理设计实验方案 | |
20 | 20-I-1 | 填空 | 2 | 理解 | 图像分析,论据推理 |
20-I-2 | 填空 | 2 | 理解 | 根据方程式计算 | |
20-Ⅱ-1-1-1 | 填空 | 2 | 理解 | 物质稳定性分析 | |
20-Ⅱ-1-1-2 | 填空 | 2 | 综合运用 | 离子的判断 | |
20-Ⅱ-1-2 | 填空 | 2 | 综合运用 | pH计算 | |
20-Ⅱ-2-1 | 填空 | 2 | 综合运用 | 离子方程式书写 | |
20-Ⅱ-2-2 | 填空 | 2 | 综合运用 | 根据图像论据推理 | |
21A | 21-1 | 填空 | 2 | 理解 | 电子排布式的书写 |
21-2 | 填空 | 2 | 理解 | 空间构型判断 | |
21-3 | 填空 | 2 | 理解 | 杂化方式判断 | |
21-4 | 填空 | 2 | 理解 | 键型数目比较 | |
21-5 | 填空 | 2 | 理解 | 电负性大小比较 | |
21-6 | 填空 | 2 | 理解 | 方程式书写 | |
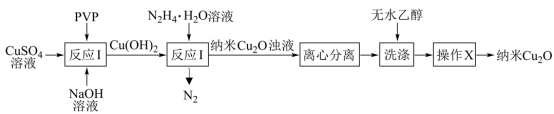
| A.反应Ⅰ为化合反应 |
| B.操作X为过滤 |
| C.反应Ⅱ中,每生成22.4L(标准状况)N2,转移4mol电子 |
| D.“洗涤”时,无水乙醇可用蒸馏水代替 |
(1)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即
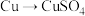 ;
;方案乙:由
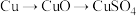 。
。这两种方案,你认为哪一种方案更合理?
(2)氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
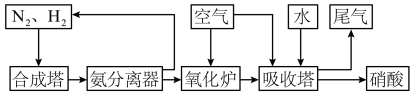
①合成塔中发生反应的化学方程式为
②向吸收塔中通入空气的作用是
③氧化炉中发生反应的化学方程式为
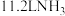 被氧化为
被氧化为 时转移电子的数目为
时转移电子的数目为④吸收塔中出来的尾气
 可用具有碱性的
可用具有碱性的 溶液吸收,其中
溶液吸收,其中 既是氧化剂又是还原剂,且三种产物的物质的量之比为1∶1∶1,写出反应的化学方程式:
既是氧化剂又是还原剂,且三种产物的物质的量之比为1∶1∶1,写出反应的化学方程式:(1)将适量的蔗糖放入一烧杯中,再加入浓硫酸,观察到蔗糖变黑,体积膨胀,并产生刺激性气味的气体。生成的黑色物质是
(2)“绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线。若以铜、氧气和硫酸为原料制取硫酸铜,请你设计符合“绿色化学”思想的反应路线(用化学方程式表示)
 、
、 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[
和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[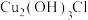 ]。以铜矿粉(含
]。以铜矿粉(含 、
、 、CuS及少量FeS等)为原料制取CuCl的工艺流程如图:
、CuS及少量FeS等)为原料制取CuCl的工艺流程如图:
已知:FeS高温条件下与氧气反应生成FeO;
 高温条件下与氧气反应生成
高温条件下与氧气反应生成 ;
; 在酸性条件下会发生歧化反应。回答下列问题:
在酸性条件下会发生歧化反应。回答下列问题:(1)“酸浸”时
 发生反应的化学方程式为
发生反应的化学方程式为(2)可在上述流程中循环利用的物质有
(3)洗涤CuCl晶体所用的试剂为
a.饱和
 溶液 b.NaOH溶液 c.无水乙醇 d.稀硫酸
溶液 b.NaOH溶液 c.无水乙醇 d.稀硫酸(4)流程中“滤渣”的主要成分是
(5)测定产品中氯化亚铜的质量分数,实验过程如下:准确称取制备的氯化亚铜产品0.250g,将其置于足量的
 溶液中,待样品全部溶解后,加入适量稀硫酸,用
溶液中,待样品全部溶解后,加入适量稀硫酸,用 的硫酸铈[
的硫酸铈[ ]标准溶液滴定到终点,消耗硫酸铈溶液24.60mL,反应中
]标准溶液滴定到终点,消耗硫酸铈溶液24.60mL,反应中 被还原为
被还原为 (已知
(已知 ),则产品中氯化亚铜的纯度为
),则产品中氯化亚铜的纯度为(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____
 +_________。
+_________。该反应完毕的现象标志是
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
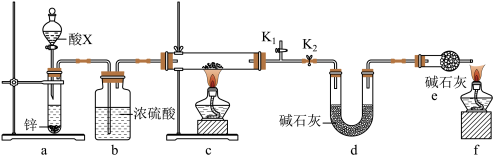
①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
Ⅰ.取已知浓度的CuSO4溶液,搅拌下滴加足量NaOH溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸(H2C2O4)溶液中加入适量K2CO3固体,制得KHC2O4和K2C2O4混合溶液。
Ⅲ将Ⅱ的混合溶液加热至80~85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由CuSO4•5H2O配制Ⅰ中的CuSO4溶液,下列仪器中不需要的有
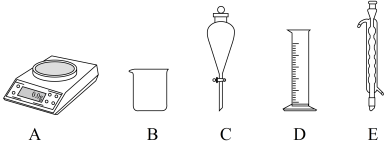
(2)长期存放的CuSO4•5H2O中,会出现少量白色固体,原因是
(3)Ⅰ中的黑色沉淀可能是
(4)Ⅱ中原料配比为n(H2C2O4):n(K2CO3)=3:2,写出反应的化学方程式
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入K2CO3时应采取
(6)Ⅲ中应采用
(7)Ⅳ中“一系列操作”包括
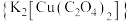 可用于无机合成、功能材料制备。实验室制备二草酸合铜(II)酸钾可采用如下步骤:
可用于无机合成、功能材料制备。实验室制备二草酸合铜(II)酸钾可采用如下步骤:I.取已知浓度的
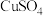 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀,加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀,加热,沉淀转变成黑色,过滤。II.向草酸
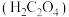 溶液中加入适量
溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。III.将II的混合溶液加热至80~85℃,加入I中的黑色沉淀。全部溶解后,趁热过滤。
IV.将III的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(II)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由
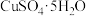 配制I中的
配制I中的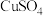 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是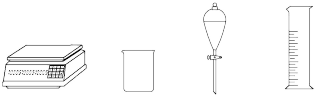
(2)长期存放的
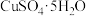 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是(3)I中的黑色沉淀是
(4)II中原料配比为
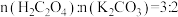 ,写出反应的化学方程式
,写出反应的化学方程式(5)II中,为防止反应过于刚烈而引起喷溅,加入
 应采取
应采取(6)III中应采用



