解题方法
1 . 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)。
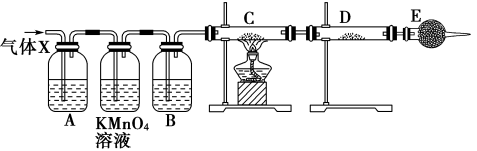
(1)上述反应中生成二氧化硫的化学方程式为_____ 。
(2)乙同学认为还可能产生氢气的理由是____ 。
(3)丙同学在安装好装置后,必须首先进行的一步操作____ 。
(4)A中加入的试剂可能是____ ,作用是____ 。
(5)如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?____ (填“能”或“不能”),原因是____ 。

(1)上述反应中生成二氧化硫的化学方程式为
(2)乙同学认为还可能产生氢气的理由是
(3)丙同学在安装好装置后,必须首先进行的一步操作
(4)A中加入的试剂可能是
(5)如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?
您最近半年使用:0次
2 . 硫酸亚铁铵是一种重要的化工原料,用途十分广泛。在无机化学工业中,它是制取其它铁化合物的原料,如用于制造氧化铁系颜料、磁性材料、黄血盐和其他铁盐等。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气。某化学小组选用如图所示部分装置进行实验(夹持装置略),验证分解产物中含有氨气和水蒸气。
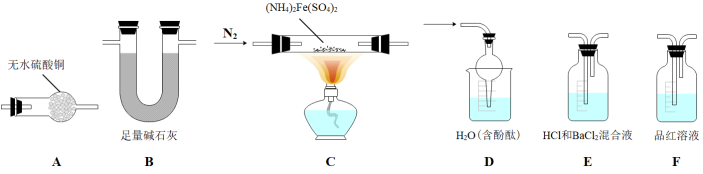
(1)加热之前应该先通氮气,防止空气中的_______ 干扰实验。
(2)所选用装置的正确连接顺序为_______ (填装置序号)。
(3)证明有水蒸气生成的实验现象为_______ 。
(4)证明有氨气生成的实验现象为_______ 。
(5)经检验C 中分解后只有红棕色粉末,用试管取少许与氢碘酸混合后,再加入少量的四氯化碳振荡,下层出现的现象为_______ ,该反应的离子方程式为_______ 。
(6)写出该实验中硫酸亚铁铵受热分解的化学方程式_______ 。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气。某化学小组选用如图所示部分装置进行实验(夹持装置略),验证分解产物中含有氨气和水蒸气。

(1)加热之前应该先通氮气,防止空气中的
(2)所选用装置的正确连接顺序为
(3)证明有水蒸气生成的实验现象为
(4)证明有氨气生成的实验现象为
(5)经检验C 中分解后只有红棕色粉末,用试管取少许与氢碘酸混合后,再加入少量的四氯化碳振荡,下层出现的现象为
(6)写出该实验中硫酸亚铁铵受热分解的化学方程式
您最近半年使用:0次
3 . 将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
(一)猜想与假设:
猜想一:固体为CuCO3,理由:___________ (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈___________ (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
(三)设计与实验:
I.固体的获取:
(1)将反应后的固、液混合物经_______ 、洗涤、低温烘干得蓝色固体。
(2)判断固体已洗净的方法及现象______
II.用下图所示装置,定性探究固体的成分。

(3)若用装置A、B组合进行实验,B中无现象,则猜想________ 正确;
(4)若用装置A、C组合进行实验,C中无现象,则猜想_______ 正确;
(5)小组同学将装置按A、_______ 、______ (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的,实验中:B中的现象为_______ ,C中的现象为_______ 。
结论:固体为Cu(OH)2和CuCO3的混合物。
III.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃∽68℃,CuCO3的分解温度为200℃∽220℃。设固体的组成为aCu(OH)2•bCuCO3.小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图,

请根据图示回答下列问题:
(6)写出AB、CD段发生反应的化学方程式:
AB段:________ ;
CD段:_______ ;
(7)通过计算可得:a∶b=_______ 。
(8)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:_______ 。
(一)猜想与假设:
猜想一:固体为CuCO3,理由:
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
(三)设计与实验:
I.固体的获取:
(1)将反应后的固、液混合物经
(2)判断固体已洗净的方法及现象
II.用下图所示装置,定性探究固体的成分。

(3)若用装置A、B组合进行实验,B中无现象,则猜想
(4)若用装置A、C组合进行实验,C中无现象,则猜想
(5)小组同学将装置按A、
结论:固体为Cu(OH)2和CuCO3的混合物。
III.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃∽68℃,CuCO3的分解温度为200℃∽220℃。设固体的组成为aCu(OH)2•bCuCO3.小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图,

请根据图示回答下列问题:
(6)写出AB、CD段发生反应的化学方程式:
AB段:
CD段:
(7)通过计算可得:a∶b=
(8)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:
您最近半年使用:0次
4 . 某实验小组对 溶液分别与
溶液分别与 、
、 溶液的反应进行探究。
溶液的反应进行探究。
已知:Ⅰ.
Ⅱ.
回答下列问题:
(1)推测实验Ⅰ中的无色气体为 ,实验验证:用湿润的品红试纸接近试管口,视察到
,实验验证:用湿润的品红试纸接近试管口,视察到___________ ,将品红试纸在烘箱中低温烘干又观察到___________ 。
(2)推测实验Ⅰ中的白色沉淀为 ,实验验证步骤如下:
,实验验证步骤如下:
①实验Ⅰ完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到___________ ,反应的离子方程式为___________ ;露置一段时间,又观察到___________ 。
(3)对比实验Ⅰ、Ⅱ,提出假设, 增强了
增强了 的氧化性。
的氧化性。
①若假设合理,实物Ⅰ反应的离子方程式为___________ 和 。
。
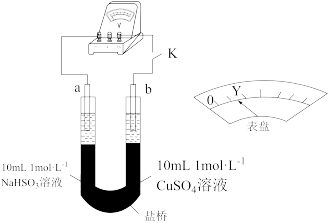
②用以下实验来验证假设合理,装置如图所示。实验方案:闭合K,电压表的指针偏转至“Y”处;向U形管___________ (补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24h或加热后,得到红色沉淀。经检验,红色沉淀中含有 、
、 和
和 。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有
。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有 和
和 。
。
实验Ⅲ:
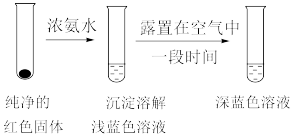
①甲同学认为红色沉淀中含有 ,他判断的理由是
,他判断的理由是___________ 。
②乙同学认为实验Ⅲ不足以证实红色沉淀中含有 ,理由是
,理由是___________ 。
 溶液分别与
溶液分别与 、
、 溶液的反应进行探究。
溶液的反应进行探究。| 实验 | 装置 | 试剂a | 操作及现象 |
| I |   溶液 溶液 |  溶液 溶液 | 加入 溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| Ⅱ |  溶液 溶液 | 加入 溶液,得到绿色溶液, 溶液,得到绿色溶液, 未见明显变化。 未见明显变化。 |
Ⅱ.

回答下列问题:
(1)推测实验Ⅰ中的无色气体为
 ,实验验证:用湿润的品红试纸接近试管口,视察到
,实验验证:用湿润的品红试纸接近试管口,视察到(2)推测实验Ⅰ中的白色沉淀为
 ,实验验证步骤如下:
,实验验证步骤如下:①实验Ⅰ完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到
(3)对比实验Ⅰ、Ⅱ,提出假设,
 增强了
增强了 的氧化性。
的氧化性。①若假设合理,实物Ⅰ反应的离子方程式为
 。
。②用以下实验来验证假设合理,装置如图所示。实验方案:闭合K,电压表的指针偏转至“Y”处;向U形管

(4)将实验Ⅱ的溶液静置24h或加热后,得到红色沉淀。经检验,红色沉淀中含有
 、
、 和
和 。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有
。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有 和
和 。
。实验Ⅲ:
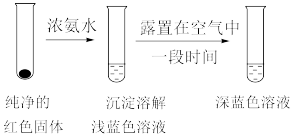
①甲同学认为红色沉淀中含有
 ,他判断的理由是
,他判断的理由是②乙同学认为实验Ⅲ不足以证实红色沉淀中含有
 ,理由是
,理由是
您最近半年使用:0次
解题方法
5 . 在实验室制取乙烯时,其反应为CH3CH2OH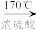 CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
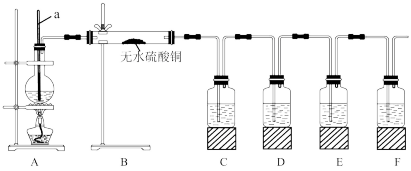
限用试剂(试剂均足量):乙醇、浓硫酸、品红溶液、氢氧化钠溶液、酸性高锰酸钾溶液、溴水。
(1)仪器a的名称为___ 。
(2)请根据实验的要求完成下列填空:
①B中可观察到的现象为___ 。
②D中的试剂为___ 。
③E中的试剂为__ ,其作用为___ 。
④F中的试剂为___ ,可能的实验现象为___ 。
(3)简述装置B置于装置A、C之间的理由:___ 。
 CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
限用试剂(试剂均足量):乙醇、浓硫酸、品红溶液、氢氧化钠溶液、酸性高锰酸钾溶液、溴水。
(1)仪器a的名称为
(2)请根据实验的要求完成下列填空:
①B中可观察到的现象为
②D中的试剂为
③E中的试剂为
④F中的试剂为
(3)简述装置B置于装置A、C之间的理由:
您最近半年使用:0次
2021-10-29更新
|
317次组卷
|
2卷引用:【石家庄新东方】河北省沧衡八校联盟2020-2021学年高一下学期期中考试化学试题
解题方法
6 . 最近我国有人报道,将0.1 mol· L-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol· L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得浑浊。
(1)设此装置中发生的是铜离子和硫离子直接相遇的反应,已知 (Cu2+/Cu)和
(Cu2+/Cu)和 (S/S2-)分别为0.345 V和-0.476V, nF
(S/S2-)分别为0.345 V和-0.476V, nF =RTlnK,
=RTlnK, 表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数
表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数____ ,写出平衡常数表达式______ 。
(2)金属铜和浑浊现象均出现在蛋壳外,这意味着____ 。
(3)该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式______ 。
(4)请对此实验结果作一简短评论____ 。
(1)设此装置中发生的是铜离子和硫离子直接相遇的反应,已知
 (Cu2+/Cu)和
(Cu2+/Cu)和 (S/S2-)分别为0.345 V和-0.476V, nF
(S/S2-)分别为0.345 V和-0.476V, nF =RTlnK,
=RTlnK, 表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数
表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数(2)金属铜和浑浊现象均出现在蛋壳外,这意味着
(3)该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式
(4)请对此实验结果作一简短评论
您最近半年使用:0次
7 . 实验室利用废弃黄铜(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
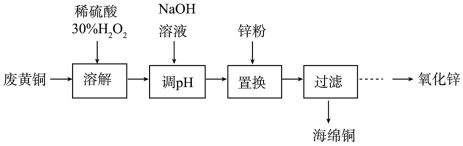
(1)为提高溶解速率,可以采取的措施有_______ (写2种)。
(2)“溶解”操作中一段时间后反应现象突然加剧,同时产生大量气体。
①反应过程中溶液的温度升高,其原因是_______ 。
②产生该现象的原因是(不考虑温度升高的影响)_______ 。
(3)相比用稀硝酸溶解废黄铜,该实验采用稀硫酸和H2O2溶解废黄铜的优点是_______ 。
(4)置换操作置换出铜单质,分离铜和锌。
①加入锌粉发生主要反应的离子方程式为_______ 。
②若没有“调pH”操作,对“置换”操作的影响是_______ 。

(1)为提高溶解速率,可以采取的措施有
(2)“溶解”操作中一段时间后反应现象突然加剧,同时产生大量气体。
①反应过程中溶液的温度升高,其原因是
②产生该现象的原因是(不考虑温度升高的影响)
(3)相比用稀硝酸溶解废黄铜,该实验采用稀硫酸和H2O2溶解废黄铜的优点是
(4)置换操作置换出铜单质,分离铜和锌。
①加入锌粉发生主要反应的离子方程式为
②若没有“调pH”操作,对“置换”操作的影响是
您最近半年使用:0次
8 . 胆矾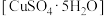 可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在
可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在 时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
(1)B装置中 的作用是
的作用是___________ 。
(2)实验中,观察到B中有白色沉淀生成,C中无明显变化,可确定产物中一定有___________ 气体产生,写出B中发生反应的离子方程式___________ 。
(3)推测D中收集到的气体是___________ ,其检验方法为___________ 。
(4)A中固体完全分解后变为红色粉末,某同学设计实验验证固体残留物仅为 ,而不含
,而不含 ,请帮他完成表中内容。已知:
,请帮他完成表中内容。已知: (试剂,仪器和用品自选)。
(试剂,仪器和用品自选)。
(5)结合上述实验现象,写出胆矾在 时隔绝空气加热完全分解的化学方程式
时隔绝空气加热完全分解的化学方程式____ 。
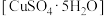 可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在
可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在 时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
(1)B装置中
 的作用是
的作用是(2)实验中,观察到B中有白色沉淀生成,C中无明显变化,可确定产物中一定有
(3)推测D中收集到的气体是
(4)A中固体完全分解后变为红色粉末,某同学设计实验验证固体残留物仅为
 ,而不含
,而不含 ,请帮他完成表中内容。已知:
,请帮他完成表中内容。已知: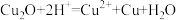 (试剂,仪器和用品自选)。
(试剂,仪器和用品自选)。| 实验步骤 | 实验预期 | 实验结论 |
准确称取 红色固体,加入足量 红色固体,加入足量 | 固体残留物仅为 |
 时隔绝空气加热完全分解的化学方程式
时隔绝空气加热完全分解的化学方程式
您最近半年使用:0次
名校
9 . 甲醛与新制氢氧化铜反应的产物随反应条件改变而有所不同。实验室对该反应在一定条件下所得产物成分进行探究,具体过程如下。
取一定量的NaOH溶液、CuSO4溶液和甲醛于锥形瓶,控制温度40-50℃回流1h,收集到大量气体X,并有红色沉淀生成。
(1)①“控制温度40-50℃”的常用加热方法是___ 。
②气体X能燃烧且完全燃烧产物不会使澄清石灰水变军浊,说明该气体是___ 。
(2)在探究甲醛的氧化产物时,发现未生成CO 。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(如图省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(如图省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。

①仪器a的名称是___ 。
②b中,NaOH溶液的作用是___ 。
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为___ 。
(3)已知:2NH3+Cu+ [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);验证红色沉淀中含Cu2O,进行如下实验步骤和现象记录:取样品,
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);验证红色沉淀中含Cu2O,进行如下实验步骤和现象记录:取样品,___ ,说明红色固体中含Cu2O。
(4)若最终测得沉淀中Cu单质和气体产物物质的量比为1:1,该条件下甲醛与新制氢氧化铜发生的主要反应化学方程式为___ 。
取一定量的NaOH溶液、CuSO4溶液和甲醛于锥形瓶,控制温度40-50℃回流1h,收集到大量气体X,并有红色沉淀生成。
(1)①“控制温度40-50℃”的常用加热方法是
②气体X能燃烧且完全燃烧产物不会使澄清石灰水变军浊,说明该气体是
(2)在探究甲醛的氧化产物时,发现未生成CO
 。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(如图省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(如图省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
①仪器a的名称是
②b中,NaOH溶液的作用是
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
(3)已知:2NH3+Cu+
 [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);验证红色沉淀中含Cu2O,进行如下实验步骤和现象记录:取样品,
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);验证红色沉淀中含Cu2O,进行如下实验步骤和现象记录:取样品,(4)若最终测得沉淀中Cu单质和气体产物物质的量比为1:1,该条件下甲醛与新制氢氧化铜发生的主要反应化学方程式为
您最近半年使用:0次
10 . 为探究CO还原CuO的固体产物成分,某同学用以下装置(夹持装置已省略)进行有关实验:
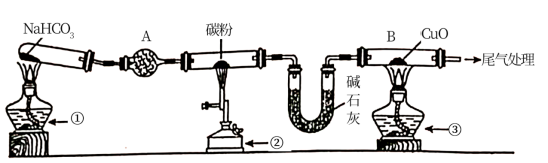
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请回答:
(1)装置A的作用是___ 。
(2)点燃①、②、③的先后顺序是①→____ →____ 。
(3)反应一段时间后,取仪器B中少量固体,加入稀H2SO4,溶液变蓝色且有红色不溶性固体。据此现象能否说明反应产物中含Cu2O?___ (填“能”或“不能”),理由是___ 。

已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请回答:
(1)装置A的作用是
(2)点燃①、②、③的先后顺序是①→
(3)反应一段时间后,取仪器B中少量固体,加入稀H2SO4,溶液变蓝色且有红色不溶性固体。据此现象能否说明反应产物中含Cu2O?
您最近半年使用:0次
2021-05-21更新
|
316次组卷
|
5卷引用:浙江省2020年7月普通高中学业水平考试化学试题
浙江省2020年7月普通高中学业水平考试化学试题浙江省上海外国语大学附属宏达高级中学2020-2021学年高二10月月考化学试题(已下线)【浙江新东方】高中化学20210513-022【2021】【高一下】(已下线)【浙江新东方】双师304高一下浙江省平阳县万全综合高级中学2021-2022学年高一下学期期中考试化学试题



