1 . 某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50mol•L-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___ 、___ 。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___ 。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___ 。
(4)从实验中可得出的结论:当温度在1000℃以上时___ (填Cu2+或Cu+,下同)稳定,在酸性溶液中___ 稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___ 。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50mol•L-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:
(4)从实验中可得出的结论:当温度在1000℃以上时
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。
| 实验步骤 | 实验结论 |
您最近一年使用:0次
2020-02-03更新
|
148次组卷
|
5卷引用:2020届高考化学二轮复习大题精准训练 ——物质性质的探究实验题
2 . 某小组同学在实验室研究Al与CuCl2溶液的反应.
(1)现象 中的红色物质是
中的红色物质是 ______ .
(2)经检验现象 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因______ .
②氢气从红色物质表面逸出的原因是______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是______ .
②用化学平衡移动原理解释CuCl溶于浓氨水的原因______ .
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有______ 性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与 CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与 CuCl2溶液反应生成了CuCl,改进之处是______ .
| 实验操作 | 实验现象 |
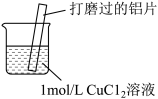 |  红色物质附着于铝片表面 红色物质附着于铝片表面 大量无色气体从红色物质表面逸出,放出大量的热 大量无色气体从红色物质表面逸出,放出大量的热 烧杯底部出现白色沉淀 烧杯底部出现白色沉淀 |
 中的红色物质是
中的红色物质是 (2)经检验现象
 中的无色气体为氢气.
中的无色气体为氢气. ①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因
②氢气从红色物质表面逸出的原因是
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液

d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是
②用化学平衡移动原理解释CuCl溶于浓氨水的原因
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与 CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与 CuCl2溶液反应生成了CuCl,改进之处是
您最近一年使用:0次
2020-01-07更新
|
177次组卷
|
2卷引用:2020届高三化学大二轮增分强化练——猜想判断型实验题
名校
解题方法
3 . 从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
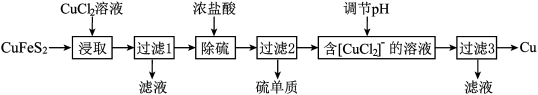
已知:CuFeS2+3CuCl2=4CuCl+FeCl2+2S
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_____ .
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为_____ .
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是_____ .(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有_____ ,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_____ .
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2此工艺与前一工艺相比主要缺点有
2Cu+SO2此工艺与前一工艺相比主要缺点有_____ .

已知:CuFeS2+3CuCl2=4CuCl+FeCl2+2S
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)过滤3所得滤液中可以循环使用的物质有
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2
 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2此工艺与前一工艺相比主要缺点有
2Cu+SO2此工艺与前一工艺相比主要缺点有
您最近一年使用:0次
2019-11-27更新
|
566次组卷
|
6卷引用:2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (题型专练)
(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (题型专练)重庆市永川景圣中学2020-2021学年高三上学期第二次月考化学试题(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)2016届江苏省清江中学高三下学期考前练习化学试卷江苏省苏州市2020届高三上学期期初调研化学试题广东省深圳市龙岗区龙城高级中学2021届高三第一次模拟考试化学试题
名校
4 . 某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含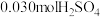 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
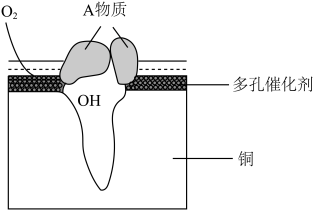
(1)该粉状锈中除了铜元素外还含有(写元素符号)___ 元素,该铜制品发生电化学腐蚀生成粉状锈时其正极电极反应式为____ 。
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____ 。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为____ 。
实验①:取A样品,加过量稀硝酸完全溶解后,再加入
 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。实验②:另取A样品4.29g,加入含
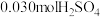 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
(1)该粉状锈中除了铜元素外还含有(写元素符号)
(2)写出该粉状锈溶于稀硫酸反应的离子方程式
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为
您最近一年使用:0次
5 . 氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
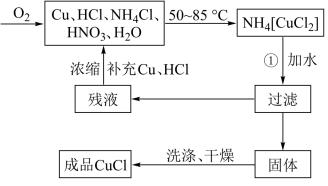
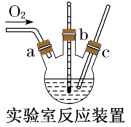
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________ 。
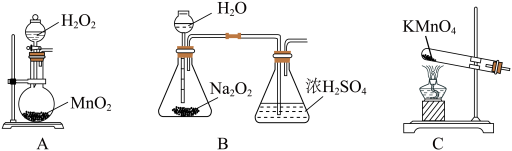
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____ (填字母序号)方案,并说明选择该装置的理由__________________________________________ 。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____ 时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________ 。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量分析:
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2,Fe2+ + Ce4+ = Fe3+ + Ce3+)
④数据处理:计算得CuCl的纯度为__________ 。


实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式
(2)本实验中通入O2的速率不宜过大,宜选择下图中的

(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为
(4)关于该实验过程中,下列说法正确的是
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量分析:
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2,Fe2+ + Ce4+ = Fe3+ + Ce3+)
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
您最近一年使用:0次
2019-08-10更新
|
853次组卷
|
3卷引用:专题13 实验题大题不丢分-2021年高考化学必做热点专题
名校
6 . 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)写出溶解过程中发生的氧化还原反应的离子方程式:_________
(2)还原过程中发生的主要反应的离子方程式:_________ 。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是__________ 。
(4)写出氯化亚铜在空气中被氧化的化学方程式________
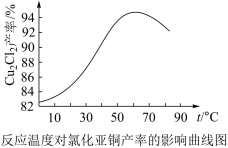
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是___ 。
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:____

(1)写出溶解过程中发生的氧化还原反应的离子方程式:
(2)还原过程中发生的主要反应的离子方程式:
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是
(4)写出氯化亚铜在空气中被氧化的化学方程式
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是

(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:
您最近一年使用:0次
2019-06-12更新
|
1147次组卷
|
2卷引用:湖北省黄冈中学2019届高三6月适应性考试(最后一卷)理综化学试题
名校
7 . 我国宋代沈括在《梦溪笔谈》中记载:信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜”。某化学兴趣小组为探究胆矾(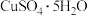 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:

已知: 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.
请回答下列问题:
(1)仪器a的名称是____ ,a中的棒香能复燃,说明热分解产物含有_____ (填化学式)。
(2)A中固体由蓝色变为黑色,B中的现象是____ 。
(3)C中冰水的作用是_____ 。
(4)D中品红溶液褪色,E中有 、
、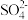 生成,写出E中生成
生成,写出E中生成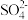 的总的离子方程式:
的总的离子方程式:____ 。
(5)若生成 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为_____ 。
(6)小组同学用滴定法测定某胆矾样品中 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(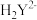 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: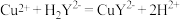 )。
)。
①样品中 的质量分数为
的质量分数为____ %(用含m、V的代数式表示)。
②下列操作会导致 含量的测定结果偏高的是
含量的测定结果偏高的是____ (填选项字母)。
a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
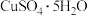 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:
已知:
 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.请回答下列问题:
(1)仪器a的名称是
(2)A中固体由蓝色变为黑色,B中的现象是
(3)C中冰水的作用是
(4)D中品红溶液褪色,E中有
 、
、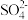 生成,写出E中生成
生成,写出E中生成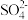 的总的离子方程式:
的总的离子方程式:(5)若生成
 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为(6)小组同学用滴定法测定某胆矾样品中
 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(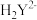 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: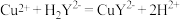 )。
)。①样品中
 的质量分数为
的质量分数为②下列操作会导致
 含量的测定结果偏高的是
含量的测定结果偏高的是a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
您最近一年使用:0次
2019-04-26更新
|
774次组卷
|
3卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)【市级联考】湖南省益阳市2019届高三下学期4月模考理科综合化学试题
8 . 2018年第十二届中国国际航空航天博览会于11月6日至11日在珠海举行。银铜合金广泛用于航空工业,从银铜合金的切割废料中回收银并制备铜化工产品的工艺如下:
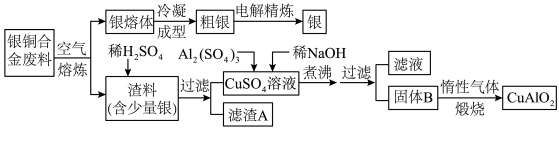
注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
(1)电解精炼银时,粗银作______ 极,另一电极上的电极反应式为____________ 。
(2)加快渣料(含少量银)溶于稀H2SO4的速率的措施有________ 、________ (写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为__________ 。
(4)煮沸CuSO4混合溶液的过程中,得到固体B,则固体B的组成为______ ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________ 。
(5)硫酸铜溶液可用于浸取硫铁矿中的铁元素,浸取时发生复杂的氧化还原反应。反应体系中除CuSO4和FeS2外,还有H2SO4、Cu2S、FeSO4和H2O,下列对该反应的分析正确的是______ (填字母代号)。
A.氧化剂为CuSO4和FeS2
B.反应后溶液的pH降低
C.被氧化的FeS2只占总量的30%
D.每转移2 mol电子消耗3 mol CuSO4

注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
(1)电解精炼银时,粗银作
(2)加快渣料(含少量银)溶于稀H2SO4的速率的措施有
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为
(4)煮沸CuSO4混合溶液的过程中,得到固体B,则固体B的组成为
(5)硫酸铜溶液可用于浸取硫铁矿中的铁元素,浸取时发生复杂的氧化还原反应。反应体系中除CuSO4和FeS2外,还有H2SO4、Cu2S、FeSO4和H2O,下列对该反应的分析正确的是
A.氧化剂为CuSO4和FeS2
B.反应后溶液的pH降低
C.被氧化的FeS2只占总量的30%
D.每转移2 mol电子消耗3 mol CuSO4
您最近一年使用:0次
9 . 氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。
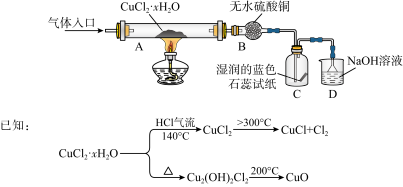
完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________ 。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________ 。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息分析:
① 若杂质是CuCl2,则产生的原因可能是____________________________________ 。
② 若杂质是CuO,则产生的原因可能是_____________________________________ 。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______ (填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________ (精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________

完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是
(2)实验过程中需要全程通入干燥的HCl,其作用是
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息分析:
① 若杂质是CuCl2,则产生的原因可能是
② 若杂质是CuO,则产生的原因可能是
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。
您最近一年使用:0次
2019-04-17更新
|
387次组卷
|
3卷引用:【区级联考】上海市虹口区2019届高三下学期二模考试化学试题
【区级联考】上海市虹口区2019届高三下学期二模考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》上海市上海师范大学附属中学2019-2020学年高三3月月考化学试题
名校
解题方法
10 . 中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________ 。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________ (写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________ 。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________ 。
(5)固体混合物B的组成为___________ ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________ 。
(6)煅烧阶段通入惰性气体的原因___________ 。

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为
(4)过滤操作需要的玻璃仪器除烧杯外还有
(5)固体混合物B的组成为
(6)煅烧阶段通入惰性气体的原因
您最近一年使用:0次
2019-04-08更新
|
524次组卷
|
9卷引用:【市级联考】宁夏回族自治区银川市2019届高三质量检测理科综合化学试题



