名校
解题方法
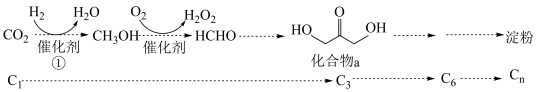
1 . 2021年我国科学家以 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①
②
③
④
 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①

②

③

④

| A.第①步反应断裂了非极性键与极性键 |
| B.催化剂降低了反应的活化能,改变了反应的焓变,降低了合成淀粉的难度 |
C. |
| D.反应④是吸热反应,活化能较大,所以是决速步 |
您最近一年使用:0次
2 . 将CO或CO2转化为高附加值化学品是颇具前景的合成路线。
(1)工业上用CO2和H2反应合成二甲醚。
已知:
 ;
;

 。
。
写出 和
和 转化为
转化为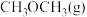 和
和 的热化学方程式:
的热化学方程式:_______________ ,该反应在________ (填“高温”或“低温”)条件下能自发进行。
(2)CO2催化加氢合成乙醇的反应原理为
 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。________________ 。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为________ (填化学式)。
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为 、
、 。
。
在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。________________ 。
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:________________ (任答两点)。
(4)一定条件下,利用CO2和H2还可制得甲烷: ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
①用单位时间内气体分压的变化表示反应 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
________ 。
②该温度下,平衡时CO的体积分数为8%,反应 的平衡常数
的平衡常数
________ ( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
(1)工业上用CO2和H2反应合成二甲醚。
已知:

 ;
;
 。
。写出
 和
和 转化为
转化为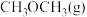 和
和 的热化学方程式:
的热化学方程式:(2)CO2催化加氢合成乙醇的反应原理为

 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为
 、
、 。
。在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。
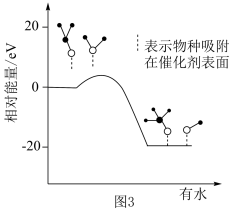
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:
(4)一定条件下,利用CO2和H2还可制得甲烷:
 ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 93.8 | 88.0 | 83.4 | 79.4 | 75.0 | 75.0 |
 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
②该温度下,平衡时CO的体积分数为8%,反应
 的平衡常数
的平衡常数
 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
2024-06-04更新
|
120次组卷
|
3卷引用:河北省2024届高三下学期普通高中学业水平选择性考试化学冲刺卷(二)
名校
3 . 我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发利用二氧化碳技术,降低空气中二氧化碳含量成为重要的任务。
(1)倡导绿色低碳的生活方式,下列措施与节能减碳矛盾的是_____
(2) 加氢合成
加氢合成 的反应为
的反应为 。
。
①下列说法正确的是_____
A.调控反应条件不能改变反应限度
B.投入 和
和 能得到
能得到
C.当 的消耗速率等于其生成速率时,该反应已停止
的消耗速率等于其生成速率时,该反应已停止
D.该反应在一定温度下能自发进行,则
②一般认为,该反应经过如下步骤来实现:
反应Ⅰ: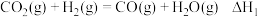 ;
;
反应Ⅱ: 。
。
则总反应的焓变
___________ (用包含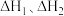 的代数式表示)。若某温度下,反应Ⅰ的平衡常数为
的代数式表示)。若某温度下,反应Ⅰ的平衡常数为 ,反应Ⅱ的平衡常数为
,反应Ⅱ的平衡常数为 ,则总反应的平衡常数
,则总反应的平衡常数
___________ (用包含 的代数式表示)
的代数式表示)
(3)二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应: ;
;
①写出主反应的平衡常数表达式:___________
②某容器中加入一定量的 和
和 ,保持温度和压强不变的情况下,达平衡后再向该容器中注入
,保持温度和压强不变的情况下,达平衡后再向该容器中注入 稀释,主反应的化学平衡将
稀释,主反应的化学平衡将___________ (填“正向移动”、“逆向移动”或“不移动”),达到新平衡后, 的体积分数将
的体积分数将___________ (填“增大”、“减小”或“不变”)
(4) 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线:
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线: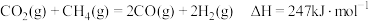
①该反应
___________ 0(填“>”或“<”)
②有传闻 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?___________ (填“正确”或“错误”),并写出原因___________ 。
(1)倡导绿色低碳的生活方式,下列措施与节能减碳矛盾的是_____
| A.购物时使用环保袋 | B.就餐时践行光盘行动 |
| C.使用节能灯代替白炽灯 | D.为食品保鲜,冰箱温度越低越好 |
 加氢合成
加氢合成 的反应为
的反应为 。
。①下列说法正确的是
A.调控反应条件不能改变反应限度
B.投入
 和
和 能得到
能得到
C.当
 的消耗速率等于其生成速率时,该反应已停止
的消耗速率等于其生成速率时,该反应已停止D.该反应在一定温度下能自发进行,则

②一般认为,该反应经过如下步骤来实现:
反应Ⅰ:
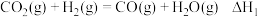 ;
;反应Ⅱ:
 。
。则总反应的焓变

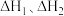 的代数式表示)。若某温度下,反应Ⅰ的平衡常数为
的代数式表示)。若某温度下,反应Ⅰ的平衡常数为 ,反应Ⅱ的平衡常数为
,反应Ⅱ的平衡常数为 ,则总反应的平衡常数
,则总反应的平衡常数
 的代数式表示)
的代数式表示)(3)二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:
 ;
;①写出主反应的平衡常数表达式:
②某容器中加入一定量的
 和
和 ,保持温度和压强不变的情况下,达平衡后再向该容器中注入
,保持温度和压强不变的情况下,达平衡后再向该容器中注入 稀释,主反应的化学平衡将
稀释,主反应的化学平衡将 的体积分数将
的体积分数将(4)
 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线:
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线: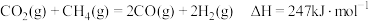
①该反应

②有传闻
 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
您最近一年使用:0次
名校
4 . 回答下列问题
(1)已知热化学方程式: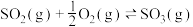
 ,在容器中充入2mol
,在容器中充入2mol 和1mol
和1mol 充分反应,最终放出的热量值一定___________。
充分反应,最终放出的热量值一定___________。
(2)已知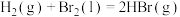
 ,蒸发1moll
,蒸发1moll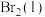 需要吸收的能量为30kJ,其他相关数据如下表:
需要吸收的能量为30kJ,其他相关数据如下表:
则表中
___________ 。
(3)热力学标准态(298.15K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫作该化合物的生成热( )。图甲为氧族元素中的氧、硫、硒(Se)、碲在生成1mol气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表那种元素,试写出硒化氢在上述条件下发生分解反应的热化学方程式为
)。图甲为氧族元素中的氧、硫、硒(Se)、碲在生成1mol气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表那种元素,试写出硒化氢在上述条件下发生分解反应的热化学方程式为___________ 。

(4)三甲胺[ ]是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N―二甲基甲酰胺[
]是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N―二甲基甲酰胺[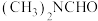 ,简称DMF]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
,简称DMF]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:

该历程中最大能垒(活化能)=______ eV,该步骤的化学方程式为___________ 。
(5)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。

容易得到的副产物有CO和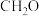 ,其中相对较多的副产物为
,其中相对较多的副产物为______ ,上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中______ (填字母)的能量变化。
A.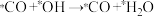 B.
B.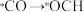
C. D.
D.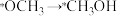
(1)已知热化学方程式:
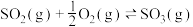
 ,在容器中充入2mol
,在容器中充入2mol 和1mol
和1mol 充分反应,最终放出的热量值一定___________。
充分反应,最终放出的热量值一定___________。| A.等于196.64kJ | B.小于98.32kJ | C.小于196.64kJ | D.大于196.64kJ |
(2)已知
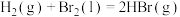
 ,蒸发1moll
,蒸发1moll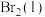 需要吸收的能量为30kJ,其他相关数据如下表:
需要吸收的能量为30kJ,其他相关数据如下表:| 物质 |  | 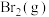 | 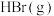 |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | a |

(3)热力学标准态(298.15K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫作该化合物的生成热(
 )。图甲为氧族元素中的氧、硫、硒(Se)、碲在生成1mol气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表那种元素,试写出硒化氢在上述条件下发生分解反应的热化学方程式为
)。图甲为氧族元素中的氧、硫、硒(Se)、碲在生成1mol气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表那种元素,试写出硒化氢在上述条件下发生分解反应的热化学方程式为
(4)三甲胺[
 ]是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N―二甲基甲酰胺[
]是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N―二甲基甲酰胺[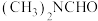 ,简称DMF]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
,简称DMF]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
该历程中最大能垒(活化能)=
(5)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现
 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
容易得到的副产物有CO和
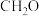 ,其中相对较多的副产物为
,其中相对较多的副产物为A.
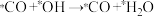 B.
B.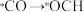
C.
 D.
D.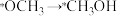
您最近一年使用:0次
名校
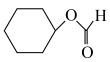
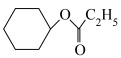
5 . 2023年12月具有完全知识产权、全球首套己内酰胺的绿色生产线正式在中国石化岳阳巴陵石化子公司投产。其生产流程如下:
(1)已知:①
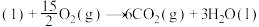
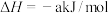
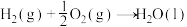

 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
___________ 。(填写计算式)
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):___________ 。
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下: 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
(4)有关该反应过程,说法不正确的是___________(填标号)。
(5)已知环己烯与羧酸发生加成反应的机理如下:
8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
从表格中得出,环己烯与不同羧酸加成,其中与HCOOH反应的产率最高,最有可能的原因是___________ (从分子结构的角度解释)。而环己烯与环戊烯相比,在同样的催化剂条件下,相同温度下,环戊烯加成的产率更高的原因可能是___________ 。
(6)已知在标准状况下,AgCl的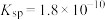 ,
, 的
的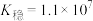 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为___________ mol/L(已知: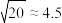 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
(1)已知:①

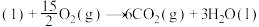
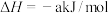
②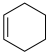
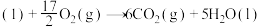
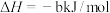
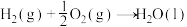

则:
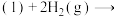

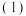

①
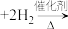
 、
、
②
 。
。
 的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
的物质的量之比为1∶4,初始压强为5MPa的条件下,达平衡时,苯的转化率为20%,环己烷的选择性达90%,则反应②的
Ⅱ.苯选择加氢制环己烯是实现环己酮绿色合成新途径的关键,从热力学的角度来看极为不利,可选择更高效的催化剂,加快环己烯从催化剂的表面脱附,从而提高环己烯的选择性。采用的新型催化剂为:Ru-Zn纳米粒子@BZSS碱式复盐,通过调控BZSS滞水膜厚度进一步提高了环己烯选择性,使用该催化剂使苯的转化率达到70%以上,环己烯的选择性达到80%。已知:苯在水中的溶解度大于环己烯在水中的溶解度,新型负载型催化剂具有亲水性。
(3)请解释Ru-Zn纳米粒子@BZSS碱式复盐能提高环己烯选择性的原因(请从溶解性的角度解释):
Ⅲ.中国石化环己酮氨肟化技术以微米级空心TS-1分子筛原粉为催化剂,并成功开发浆态床/膜分离组合新工艺,从而实现微米级催化剂的分离与连续循环使用。该环节中用蒽醌法生产过氧化氢的反应进程如下:
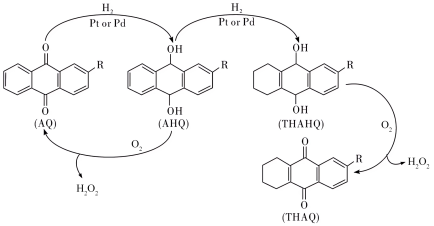
 的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。
的分解温度为60℃,AQ的沸点377℃,AHQ的沸点390℃。(4)有关该反应过程,说法不正确的是___________(填标号)。
A.从AQ到AHQ的反应中,发生变化的碳原子的杂化类型由 到 到 |
B.由THAHQ制备 的反应方程式为 的反应方程式为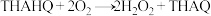 |
C.在AHQ的氧化过程中,生成的 和有机物AQ、AHQ的分离方法为蒸馏 和有机物AQ、AHQ的分离方法为蒸馏 |
| D.我国采用的浆态蒽醌氢化法,使用更高效的Pd基细颗粒催化剂,有利于提高催化的效率 |
(5)已知环己烯与羧酸发生加成反应的机理如下:

8S3SiIH催化的环烯烃与羧酸加成酯化反应结果
| 序号 | 羧酸 | 环烯烃 | 温度/℃ | 产物 | 产率/% |
| 1 | HCOOH |
| 95 |
| 90 |
| 2 |  |
| 110 |
| 82 |
| 3 |  |
| 120 |
| 62 |
| 4 | 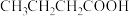 |
| 130 |
| 51 |
| 5 | HCOOH |
| 95 |
| 93 |
(6)已知在标准状况下,AgCl的
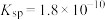 ,
, 的
的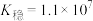 ,若把足量AgCl溶于10mol/L的氨水中,则形成的
,若把足量AgCl溶于10mol/L的氨水中,则形成的 的浓度为
的浓度为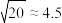 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
您最近一年使用:0次
6 . 近年碳中和理念成为热门,通过“CO2→合成气→高附加值产品”的工艺路
线,可有效实现 CO2的资源化利用。请回答下列问题:
(1)CO2 加氢制合成气(CO、H2)时发生下列反应:
已知:①

②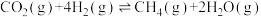

则

_______ 
(2)CO2经催化加氢可合成烯烃: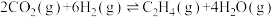
 。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是_____ (填字母)。
A.容器内各物质的浓度不随时间变化 B.2v 正(CO2)=3v 逆(H2)
C.容器内压强不随时间变化 D.混合气体的密度不再改变
② 曲线 c 表示的物质为_______ (用化学式表示)。
(3)由CO2与H2反应合成甲醇:
 。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
该条件下的分压平衡常数 Kp= ______ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)电催化 CO2 制备燃料可实现资源综合利用。如图所示装置工作时,阴极只生成 HCOOH 时,每转移 2mol 电子,阴极室溶液质量增加_____ g。

线,可有效实现 CO2的资源化利用。请回答下列问题:
(1)CO2 加氢制合成气(CO、H2)时发生下列反应:
已知:①


②
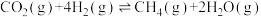

则



(2)CO2经催化加氢可合成烯烃:
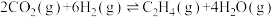
 。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化 B.2v 正(CO2)=3v 逆(H2)
C.容器内压强不随时间变化 D.混合气体的密度不再改变
② 曲线 c 表示的物质为
(3)由CO2与H2反应合成甲醇:

 。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
| p后/p前 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
(4)电催化 CO2 制备燃料可实现资源综合利用。如图所示装置工作时,阴极只生成 HCOOH 时,每转移 2mol 电子,阴极室溶液质量增加

您最近一年使用:0次
7 . 2022年4月16日,中国空间站的3名航天员乘神舟十三号载人飞船平安返回地球。空间站处理 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
I.固态胺吸收与浓缩
在水蒸气存在下固态胺吸收 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。
Ⅱ. 的加氢甲烷化,
的加氢甲烷化, 还原
还原 制
制 的部分反应如下:
的部分反应如下:
i.
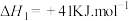
ii.
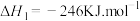
(1)反应 的
的
___________  。
。
(2)向恒容绝热的密闭容器中充入amolCO与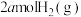 ,进行反应ii,下列能判断反应已达化学平衡状态的是
,进行反应ii,下列能判断反应已达化学平衡状态的是___________ 。
a.容器中混合气体密度不变 b.混合气体中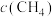 与
与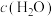 之比不变
之比不变
c.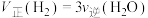 d.容器内温度不变
d.容器内温度不变
Ⅲ.和 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示:
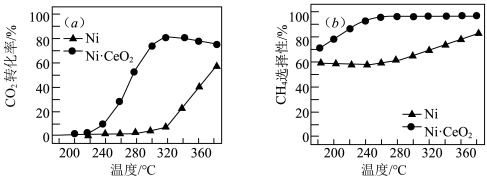
(3)高于320℃后,以Ni为催化剂, 转化率仍在上升,其原因是
转化率仍在上升,其原因是___________ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是________ ,使用的合适温度为__________ 。
(5)控制起始时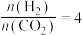 ,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
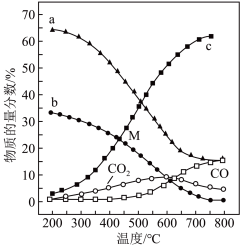
①图中代表 的曲线是
的曲线是___________ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应___________ (填“i”或“ii”)化学平衡常数大,反应完全。
②M点(T<500℃)时,反应 的平衡常数
的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:I.固态胺吸收与浓缩

在水蒸气存在下固态胺吸收
 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。Ⅱ.
 的加氢甲烷化,
的加氢甲烷化, 还原
还原 制
制 的部分反应如下:
的部分反应如下:i.

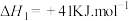
ii.

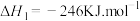
(1)反应
 的
的
 。
。(2)向恒容绝热的密闭容器中充入amolCO与
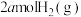 ,进行反应ii,下列能判断反应已达化学平衡状态的是
,进行反应ii,下列能判断反应已达化学平衡状态的是a.容器中混合气体密度不变 b.混合气体中
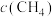 与
与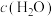 之比不变
之比不变c.
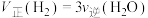 d.容器内温度不变
d.容器内温度不变Ⅲ.和
 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示:
(3)高于320℃后,以Ni为催化剂,
 转化率仍在上升,其原因是
转化率仍在上升,其原因是(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(5)控制起始时
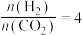 ,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
①图中代表
 的曲线是
的曲线是②M点(T<500℃)时,反应
 的平衡常数
的平衡常数
 (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
您最近一年使用:0次
名校
解题方法
8 . 近年碳中和理念成为热门,通过“CO2→合成气→高附加值产品”的工艺路线,可有效实现CO2的资源化利用。请回答下列问题:
(1)CO2加氢制合成气(CO、H2)时发生下列反应:
已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+206.2kJ∙mol-1
②CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H=-165.0kJ∙mol-1
则CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H=___________ kJ/mol
(2)CO2经催化加氢可合成烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ∆H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
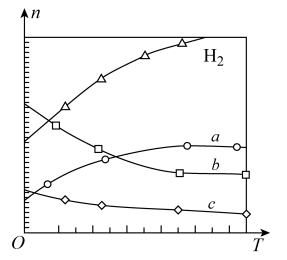
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是___________ (填字母)。
A.容器内各物质的浓度不随时间变化
B.2v正(CO2)=3v逆(H2)
C.容器内压强不随时间变化
D.混合气体的密度不再改变
②该反应的
___________ 0(填“>”或“<”),理由是___________ 。
③曲线c表示的物质为___________ (用化学式表示)。
④为提高H2的转化率,可以采取什么措施___________ (至少写出2种)。
(3)由CO2与H2反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H。某温度下将1molCO2和3molH2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
该条件下的分压平衡常数Kp___________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)CO2加氢制合成气(CO、H2)时发生下列反应:
已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+206.2kJ∙mol-1
②CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H=-165.0kJ∙mol-1
则CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H=
(2)CO2经催化加氢可合成烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ∆H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化
B.2v正(CO2)=3v逆(H2)
C.容器内压强不随时间变化
D.混合气体的密度不再改变
②该反应的

③曲线c表示的物质为
④为提高H2的转化率,可以采取什么措施
(3)由CO2与H2反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H。某温度下将1molCO2和3molH2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
| 时间/h | 1 | 2 | 3 | 4 | 5 |
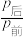 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
该条件下的分压平衡常数Kp
您最近一年使用:0次
名校
9 . 空间站处理 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
Ⅰ.固态胺吸收与浓缩
在水蒸气存在下固态胺吸收 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。
Ⅱ. 的加氢甲烷化
的加氢甲烷化
 还原
还原 制
制 的部分反应如下:
的部分反应如下:
i.CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2 CH4(g)+H2O(g)
CH4(g)+H2O(g) 
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
___________  。
。
(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是___________ ;
a.容器中混合气体密度不变 b.混合气体中 与
与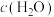 之比不变
之比不变
c.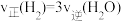 d.容器内温度不变
d.容器内温度不变
Ⅲ.和 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: 转化率仍在上升,其原因是
转化率仍在上升,其原因是___________ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(5)控制起始时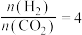 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:___________ (填增大,减小或者不变)。
②图中代表 的曲线是
的曲线是___________ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应___________ (填“i”或“ii”)化学平衡常数大,反应完全。
③反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:Ⅰ.固态胺吸收与浓缩

在水蒸气存在下固态胺吸收
 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。Ⅱ.
 的加氢甲烷化
的加氢甲烷化 还原
还原 制
制 的部分反应如下:
的部分反应如下:i.CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2
 CH4(g)+H2O(g)
CH4(g)+H2O(g) 
(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
 。
。(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是
a.容器中混合气体密度不变 b.混合气体中
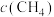 与
与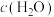 之比不变
之比不变c.
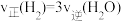 d.容器内温度不变
d.容器内温度不变Ⅲ.和
 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: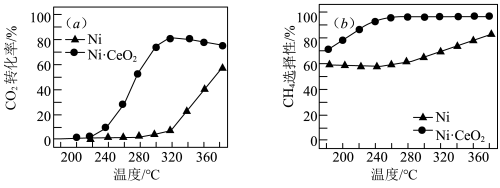
 转化率仍在上升,其原因是
转化率仍在上升,其原因是(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(5)控制起始时
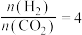 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示: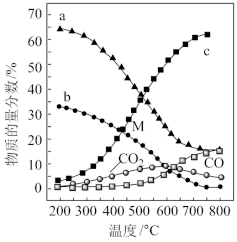
②图中代表
 的曲线是
的曲线是③反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
 (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
您最近一年使用:0次
2024-05-05更新
|
572次组卷
|
4卷引用:宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题
宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
10 . 我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发 资源化利用技术,降低空气中
资源化利用技术,降低空气中 含量成为世界各国研究热点。
含量成为世界各国研究热点。
(1) 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。

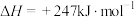
①该反应
___________ 0(填“>”或“<”)
②有传闻 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?___________ (填“正确”或“错误”),并写出原因___________ 。
③若让此反应能自发进行,你认为应选择___________ (填“高温”或“低温”)。
(2)工业上用 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: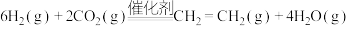

已知:①
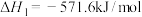
②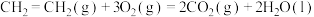
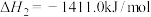
③
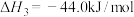
则
___________ ,该反应能够自发进行的条件是___________ (填“低温”、“高温”或“任何温度”)。
(3)电化学法也可还原二氧化碳制乙烯,原理如图所示。
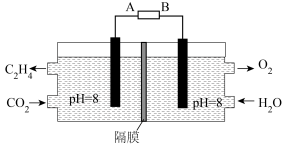
该电池的阴极电极反应式为:___________ 。
 资源化利用技术,降低空气中
资源化利用技术,降低空气中 含量成为世界各国研究热点。
含量成为世界各国研究热点。(1)
 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线。
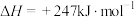
①该反应

②有传闻
 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?③若让此反应能自发进行,你认为应选择
(2)工业上用
 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: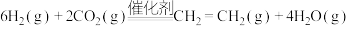

已知:①

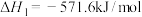
②
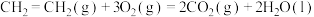
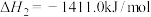
③

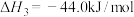
则

(3)电化学法也可还原二氧化碳制乙烯,原理如图所示。

该电池的阴极电极反应式为:
您最近一年使用:0次