名校
1 . 研究化学反应中的能量变化具有重要价值。定量计算和测量则是常用的研究方法。
(1)通过化学键的键能可计算化学反应的反应热。已知几种共价键的键能数据如下:
则 和
和 反应生成
反应生成 和气态
和气态 的热化学方程式为
的热化学方程式为_______ 。
(2)下列关于简单碰撞理论的说法正确的是_______(填字母)。
(3) 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下: ,则常温下,S(单斜)与S(斜方)中较稳定的是
,则常温下,S(单斜)与S(斜方)中较稳定的是_______ [填“S(单斜)”或“S(斜方)”]。 常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和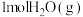 过程中的能量变化图。写出丙烷燃烧热的热化学方程式:
过程中的能量变化图。写出丙烷燃烧热的热化学方程式:_____ 。
(5)水煤气是由 和CO组成的混合气体,在工业上常用作燃料。
和CO组成的混合气体,在工业上常用作燃料。
已知: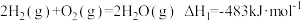 ;
;
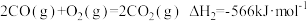 。
。
现取67.2L(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热766KJ,则水煤气中
,测得反应共放热766KJ,则水煤气中 与CO的物质的量之比是
与CO的物质的量之比是_______ 。
(6)已知: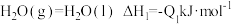 ;
;
 ;
;
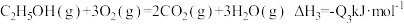 。
。
若将46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为_______ KJ(用含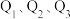 的代数式表示)。
的代数式表示)。
(1)通过化学键的键能可计算化学反应的反应热。已知几种共价键的键能数据如下:
| 共价键 | C-H | H-H | H-O | C=O |
键能 | 413 | 436 | 463 | 745 |
 和
和 反应生成
反应生成 和气态
和气态 的热化学方程式为
的热化学方程式为(2)下列关于简单碰撞理论的说法正确的是_______(填字母)。
| A.发生有效碰撞的分子不一定是活化分子 |
| B.某些反应的点燃或加热条件是为了使普通分子获得能量转变为活化分子 |
| C.基元反应的实质是活化分子有合适取向的碰撞 |
| D.反应活化能越大,则反应过程中单位体积内的有效碰撞次数越多 |
 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下: ,则常温下,S(单斜)与S(斜方)中较稳定的是
,则常温下,S(单斜)与S(斜方)中较稳定的是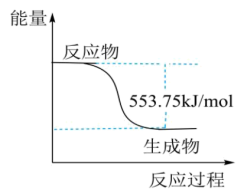
 常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和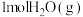 过程中的能量变化图。写出丙烷燃烧热的热化学方程式:
过程中的能量变化图。写出丙烷燃烧热的热化学方程式:(5)水煤气是由
 和CO组成的混合气体,在工业上常用作燃料。
和CO组成的混合气体,在工业上常用作燃料。已知:
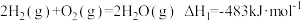 ;
;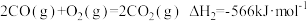 。
。现取67.2L(标准状况)水煤气,使其完全燃烧生成
 和
和 ,测得反应共放热766KJ,则水煤气中
,测得反应共放热766KJ,则水煤气中 与CO的物质的量之比是
与CO的物质的量之比是(6)已知:
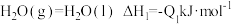 ;
; ;
;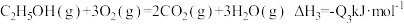 。
。若将46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
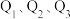 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 根据所学知识,回答下列问题
(1)室温下,将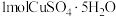 (s)溶于水会使溶液温度降低,热效应为
(s)溶于水会使溶液温度降低,热效应为 ,将
,将 的
的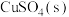 溶于水会使溶液温度升高,热效应为
溶于水会使溶液温度升高,热效应为 ;将
;将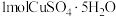 加热到45℃时,失去两分子水、热效应为
加热到45℃时,失去两分子水、热效应为 ;继续加热113℃时,再失去两分子水、热效应为
;继续加热113℃时,再失去两分子水、热效应为 ;最后加热到258℃以上,能脱去最后一分子水、热效应为
;最后加热到258℃以上,能脱去最后一分子水、热效应为 。则用
。则用 、
、 、
、 、
、 表示
表示 的关系式为
的关系式为___________ 。
(2)我国目前使用能源仍然以煤等化石能源为主体。以石墨代表煤中碳素,能量变化关系如图所示: 分别为a、b,估算CO键能为
分别为a、b,估算CO键能为___________ ( )。
)。
(3)稀的强酸与稀的强碱反应生成生成 (l)时放出的热称为中和热。已知含
(l)时放出的热称为中和热。已知含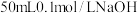 的稀溶液与足量稀盐酸完全中和,放出
的稀溶液与足量稀盐酸完全中和,放出 的热量。写出表示中和热的热化学方程式:
的热量。写出表示中和热的热化学方程式:___________ 。
(4)已知: 液态肼
液态肼 与足量的液态双氧水反应,生成氮气和水蒸气,并放出
与足量的液态双氧水反应,生成氮气和水蒸气,并放出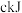 的热量,反应的热化学方程式为
的热量,反应的热化学方程式为___________ 。
(5)已知充分燃烧 乙炔
乙炔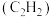 气体时生成
气体时生成 二氧化碳气体和液态水,并放出热量
二氧化碳气体和液态水,并放出热量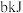 ,乙炔燃烧热的热化学方程式为
,乙炔燃烧热的热化学方程式为___________ 。
(1)室温下,将
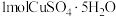 (s)溶于水会使溶液温度降低,热效应为
(s)溶于水会使溶液温度降低,热效应为 ,将
,将 的
的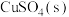 溶于水会使溶液温度升高,热效应为
溶于水会使溶液温度升高,热效应为 ;将
;将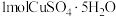 加热到45℃时,失去两分子水、热效应为
加热到45℃时,失去两分子水、热效应为 ;继续加热113℃时,再失去两分子水、热效应为
;继续加热113℃时,再失去两分子水、热效应为 ;最后加热到258℃以上,能脱去最后一分子水、热效应为
;最后加热到258℃以上,能脱去最后一分子水、热效应为 。则用
。则用 、
、 、
、 、
、 表示
表示 的关系式为
的关系式为(2)我国目前使用能源仍然以煤等化石能源为主体。以石墨代表煤中碳素,能量变化关系如图所示:
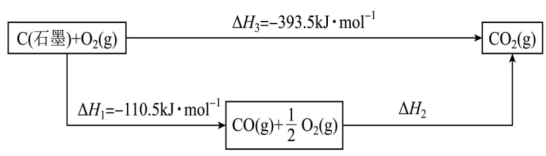
 分别为a、b,估算CO键能为
分别为a、b,估算CO键能为 )。
)。(3)稀的强酸与稀的强碱反应生成生成
 (l)时放出的热称为中和热。已知含
(l)时放出的热称为中和热。已知含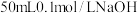 的稀溶液与足量稀盐酸完全中和,放出
的稀溶液与足量稀盐酸完全中和,放出 的热量。写出表示中和热的热化学方程式:
的热量。写出表示中和热的热化学方程式:(4)已知:
 液态肼
液态肼 与足量的液态双氧水反应,生成氮气和水蒸气,并放出
与足量的液态双氧水反应,生成氮气和水蒸气,并放出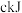 的热量,反应的热化学方程式为
的热量,反应的热化学方程式为(5)已知充分燃烧
 乙炔
乙炔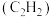 气体时生成
气体时生成 二氧化碳气体和液态水,并放出热量
二氧化碳气体和液态水,并放出热量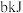 ,乙炔燃烧热的热化学方程式为
,乙炔燃烧热的热化学方程式为
您最近一年使用:0次
名校
3 . 在新型催化剂RuO2作用下,O2氧化HCl可获得Cl2,反应为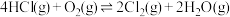
 。下列说法正确的是
。下列说法正确的是
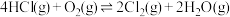
 。下列说法正确的是
。下列说法正确的是| A.该反应中反应物键能总和小于生成物键能总和 |
| B.正反应活化能大于逆反应活化能 |
| C.增大氧气浓度和增大压强都可以提高反应体系内活化分子百分数 |
| D.RuO2的使用能降低该反应的焓变 |
您最近一年使用:0次
名校
解题方法
4 . 用 生产某些含氯有机物时会产生副产物
生产某些含氯有机物时会产生副产物 。利用反应a可实现氯的循环利用:
。利用反应a可实现氯的循环利用:
反应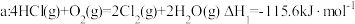 。
。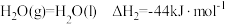 。
。
下列说法不正确 的是
 生产某些含氯有机物时会产生副产物
生产某些含氯有机物时会产生副产物 。利用反应a可实现氯的循环利用:
。利用反应a可实现氯的循环利用:反应
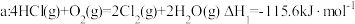 。
。已知:i. .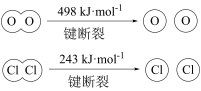 ;
;
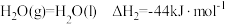 。
。下列说法
| A.反应a中反应物的总能量高于生成物的总能量 |
| B.反应a中涉及极性键、非极性键的断裂和生成 |
C.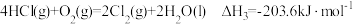 |
D.断开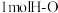 键与断开 键与断开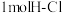 键所需能量相差约为 键所需能量相差约为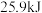 |
您最近一年使用:0次
名校
解题方法
5 . 肼(又称联氨, ,无色液体)可用作火箭燃料。肼
,无色液体)可用作火箭燃料。肼 和强氧化剂
和强氧化剂 混合时,即产生大量氮气和水蒸气,并放出大量热。已知
混合时,即产生大量氮气和水蒸气,并放出大量热。已知 液态肼与足量液态
液态肼与足量液态 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出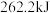 的热量。
的热量。
(1)肼中N的化合价___________ ,其中N与H之间的共价键类型为___________ 。
(2)写出肼与 反应的热化学方程式
反应的热化学方程式___________ 。
(3)肼为二元弱碱,在水中的电离方式与氨相似。已知肼的第一步电离方程式为: ,写出其第二步的电离方程式
,写出其第二步的电离方程式___________ 。肼与硫酸生成的正盐的化学式为___________ 。
(4)在 时,已知
时,已知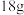 水蒸气变成液态水放出
水蒸气变成液态水放出 的热量。其他相关数据如下:
的热量。其他相关数据如下:
写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式___________ 。
 ,无色液体)可用作火箭燃料。肼
,无色液体)可用作火箭燃料。肼 和强氧化剂
和强氧化剂 混合时,即产生大量氮气和水蒸气,并放出大量热。已知
混合时,即产生大量氮气和水蒸气,并放出大量热。已知 液态肼与足量液态
液态肼与足量液态 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出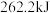 的热量。
的热量。(1)肼中N的化合价
(2)写出肼与
 反应的热化学方程式
反应的热化学方程式(3)肼为二元弱碱,在水中的电离方式与氨相似。已知肼的第一步电离方程式为:
 ,写出其第二步的电离方程式
,写出其第二步的电离方程式(4)在
 时,已知
时,已知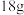 水蒸气变成液态水放出
水蒸气变成液态水放出 的热量。其他相关数据如下:
的热量。其他相关数据如下: |  | 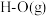 | |
 化学键断裂时需要的能量 化学键断裂时需要的能量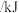 | 496 | 436 | 463 |
 燃烧热的热化学方程式
燃烧热的热化学方程式
您最近一年使用:0次
名校
6 . 一种以太阳能为热源分解水的历程,如图所示:
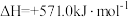
过程I: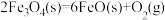
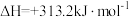
下列说法错误的是
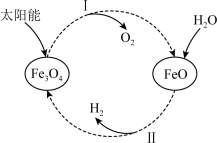

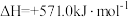
过程I:
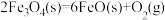
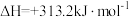
下列说法错误的是
A.铁氧化合物循环制 具有成本低、产物易分离等优点 具有成本低、产物易分离等优点 |
B.破坏 化学键所需能量高于形成 化学键所需能量高于形成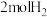 和 和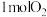 化学键释放的能量 化学键释放的能量 |
C.转化过程中 是催化剂 是催化剂 |
D.过程II热化学方程式为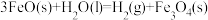 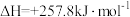 |
您最近一年使用:0次
名校
解题方法
7 . 完成下列问题
(1)下图为常温下碳酸二甲酯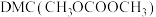 的合成反应的反应机理(吸附在催化剂表面上的物种用*标注)。
的合成反应的反应机理(吸附在催化剂表面上的物种用*标注)。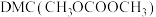 的热化学方程式
的热化学方程式______ (已知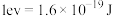 )。该反应历程中有
)。该反应历程中有______ 步基元反应,写出该反应进程中决速步骤的方程式_______ 。
(2)以废旧铅酸蓄电池为原料回收铅时会向废旧铅酸蓄电池中加入少量 ,将
,将 和
和 先都转化成
先都转化成 ,总反应方程式为
,总反应方程式为 ,过程中涉及如下两个反应,请将②反应的方程式写在横线上。
,过程中涉及如下两个反应,请将②反应的方程式写在横线上。
①
②____________ 。
(3)钌及其化合物在合成工业上有广泛用途,下图是用钌(Ru)基催化剂催化合成甲酸的过程。每生成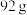 液态
液态 (摩尔质量
(摩尔质量 )放出
)放出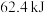 的热量。
的热量。______ 。
(4)在一定温度下,利用催化剂将 分解为
分解为 和
和 。
。
相关化学键的键能数据
已知该反应的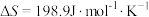 ,在下列哪些温度下反应能自发进行?___(填字母)。
,在下列哪些温度下反应能自发进行?___(填字母)。
(1)下图为常温下碳酸二甲酯
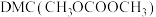 的合成反应的反应机理(吸附在催化剂表面上的物种用*标注)。
的合成反应的反应机理(吸附在催化剂表面上的物种用*标注)。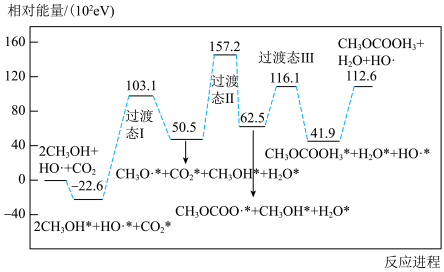
 的热化学方程式
的热化学方程式 )。该反应历程中有
)。该反应历程中有(2)以废旧铅酸蓄电池为原料回收铅时会向废旧铅酸蓄电池中加入少量
 ,将
,将 和
和 先都转化成
先都转化成 ,总反应方程式为
,总反应方程式为 ,过程中涉及如下两个反应,请将②反应的方程式写在横线上。
,过程中涉及如下两个反应,请将②反应的方程式写在横线上。①

②
(3)钌及其化合物在合成工业上有广泛用途,下图是用钌(Ru)基催化剂催化合成甲酸的过程。每生成
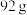 液态
液态 (摩尔质量
(摩尔质量 )放出
)放出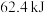 的热量。
的热量。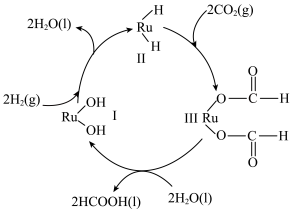
(4)在一定温度下,利用催化剂将
 分解为
分解为 和
和 。
。相关化学键的键能数据
化学键 |
| H—H | N—H |
键能 | 946 | 436.0 | 390.8 |
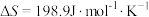 ,在下列哪些温度下反应能自发进行?___(填字母)。
,在下列哪些温度下反应能自发进行?___(填字母)。A. | B.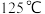 | C. | D.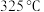 |
您最近一年使用:0次
名校
8 . 苯与 的反应机理如图一所示,其反应过程中的能量变化如图二所示。下列说法正确的是
的反应机理如图一所示,其反应过程中的能量变化如图二所示。下列说法正确的是
 的反应机理如图一所示,其反应过程中的能量变化如图二所示。下列说法正确的是
的反应机理如图一所示,其反应过程中的能量变化如图二所示。下列说法正确的是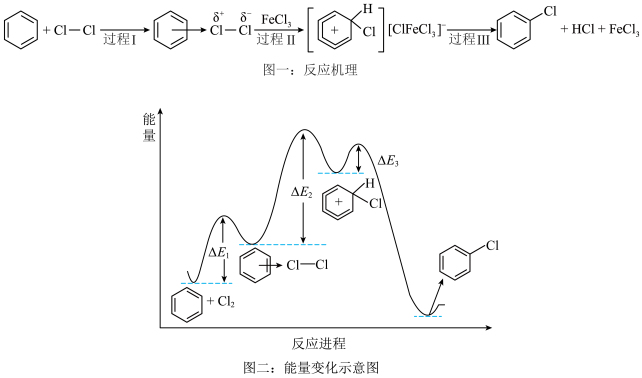
A. 的参与改变了反应历程,降低了总反应的焓变 的参与改变了反应历程,降低了总反应的焓变 |
B.苯和 反应的速率由过程II的速率决定 反应的速率由过程II的速率决定 |
C.反应的 等于苯与 等于苯与 的键能总和减去氯苯的键能总和 的键能总和减去氯苯的键能总和 |
| D.升温既能提高反应速率,又能提高苯的平衡转化率 |
您最近一年使用:0次
名校
解题方法
9 . 氨是化肥工业和基本有机化工的主要原料。回答下列问题:
(1)工业合成氨的反应为: ,查阅资料可知,H-H、
,查阅资料可知,H-H、 、N-H的键能分别为436kJ/mol、946kJ/mol、398kJ/mol,该反应活化能
、N-H的键能分别为436kJ/mol、946kJ/mol、398kJ/mol,该反应活化能
_______  (填“>”或“<”)。
(填“>”或“<”)。
(2)我国科学家研发出一种新型双温催化剂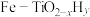 ,该催化剂催化
,该催化剂催化 和
和 合成(如体系温度为495℃时,纳米Fe的温度为547℃,而
合成(如体系温度为495℃时,纳米Fe的温度为547℃,而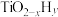 的温度为415℃)的原理如图所示。
的温度为415℃)的原理如图所示。
(3)恒压密闭容器中按 充入
充入 和
和 ,在不同催化剂(I,Ⅱ,Ⅲ)作用下发生反应
,在不同催化剂(I,Ⅱ,Ⅲ)作用下发生反应 ,测得相同反应时间内,
,测得相同反应时间内, 的体积分数随温度变化如图所示。
的体积分数随温度变化如图所示。_______ (填“I”“Ⅱ”或“Ⅲ”)。
②T>300℃,曲线重合的原因是_______ 。
③M点对应条件下的
_______ (对于反应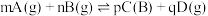 ,
,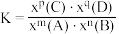 ,x为物质的量分数)。
,x为物质的量分数)。
(4)某温度下,在容积为VL的恒容密闭容器中模拟工业合成氨,充入 和
和 的总物质的量为2mol,容器内起始压强为标准压强
的总物质的量为2mol,容器内起始压强为标准压强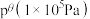 ,容器内各组分的物质的量分数与反应时间t的关系如图所示:
,容器内各组分的物质的量分数与反应时间t的关系如图所示: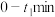 内,平均反应速率
内,平均反应速率
_______  。
。
(1)工业合成氨的反应为:
 ,查阅资料可知,H-H、
,查阅资料可知,H-H、 、N-H的键能分别为436kJ/mol、946kJ/mol、398kJ/mol,该反应活化能
、N-H的键能分别为436kJ/mol、946kJ/mol、398kJ/mol,该反应活化能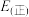
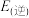 (填“>”或“<”)。
(填“>”或“<”)。(2)我国科学家研发出一种新型双温催化剂
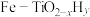 ,该催化剂催化
,该催化剂催化 和
和 合成(如体系温度为495℃时,纳米Fe的温度为547℃,而
合成(如体系温度为495℃时,纳米Fe的温度为547℃,而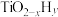 的温度为415℃)的原理如图所示。
的温度为415℃)的原理如图所示。
| A.“热Fe”上的变化属于焓减、熵增的变化 |
B.“热Fe”有利于 快速转化为N 快速转化为N |
| C.“冷Ti”低于体系温度,有利于提高合成氨反应速率 |
| D.该催化剂能较好地解决传统合成氨工艺中存在的反应速率和平衡产率的矛盾 |
(3)恒压密闭容器中按
 充入
充入 和
和 ,在不同催化剂(I,Ⅱ,Ⅲ)作用下发生反应
,在不同催化剂(I,Ⅱ,Ⅲ)作用下发生反应 ,测得相同反应时间内,
,测得相同反应时间内, 的体积分数随温度变化如图所示。
的体积分数随温度变化如图所示。
②T>300℃,曲线重合的原因是
③M点对应条件下的

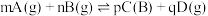 ,
,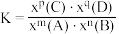 ,x为物质的量分数)。
,x为物质的量分数)。(4)某温度下,在容积为VL的恒容密闭容器中模拟工业合成氨,充入
 和
和 的总物质的量为2mol,容器内起始压强为标准压强
的总物质的量为2mol,容器内起始压强为标准压强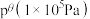 ,容器内各组分的物质的量分数与反应时间t的关系如图所示:
,容器内各组分的物质的量分数与反应时间t的关系如图所示:
 内,平均反应速率
内,平均反应速率
 。
。
您最近一年使用:0次
名校
10 . 乙烯氢化的化学方程式为
 ,使用不同含Au催化剂的反应进程如下图所示。下列说法错误的是
,使用不同含Au催化剂的反应进程如下图所示。下列说法错误的是

 ,使用不同含Au催化剂的反应进程如下图所示。下列说法错误的是
,使用不同含Au催化剂的反应进程如下图所示。下列说法错误的是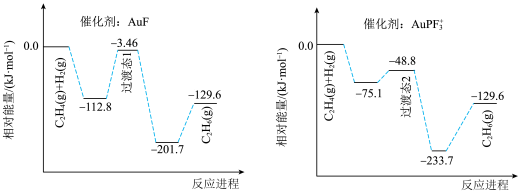
A.1 mol 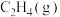 与1 mol 与1 mol  的总键能比1 mol 的总键能比1 mol 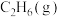 的总键能大 的总键能大 |
B.相同条件下,使用不同催化剂的反应速率: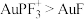 |
| C.过渡态物质的稳定性:过渡态1<过渡态2 |
D.若该反应生成 ,则反应的 ,则反应的 减小 减小 |
您最近一年使用:0次
2024-10-04更新
|
385次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学校2024-2025学年高三上学期8月开学考试化学试卷