名校
解题方法
1 . 根据要求,回答下列问题:
(1)甲醇是一种绿色燃料,甲醇( ,液态)的燃烧热
,液态)的燃烧热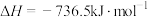 ,则表示甲醇燃烧热的热化学方程式为
,则表示甲醇燃烧热的热化学方程式为___________ 。
(2)工业生产中常用FeS除去工业废水中的 ,则
,则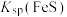
___________ 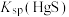 (填“>”或“<”),该反应的离子方程式为
(填“>”或“<”),该反应的离子方程式为___________ 。
(3)工业合成气一般是指CO和 的混合气体,是一种化工原料气,合成气的来源范围很广,如利用二氧化碳与甲烷催化重整可制得合成气:
的混合气体,是一种化工原料气,合成气的来源范围很广,如利用二氧化碳与甲烷催化重整可制得合成气:
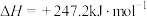 ,则该反应在
,则该反应在___________ (填“低温”“高温”或“任意温度”)下易自发进行。
(4)41℃时,水的离子积常数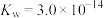 ,该温度时,测得某浓度的稀硫酸中
,该温度时,测得某浓度的稀硫酸中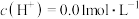 ,则该稀硫酸的pH=
,则该稀硫酸的pH=___________ ,由水电离出的
___________  。
。
(1)甲醇是一种绿色燃料,甲醇(
 ,液态)的燃烧热
,液态)的燃烧热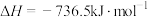 ,则表示甲醇燃烧热的热化学方程式为
,则表示甲醇燃烧热的热化学方程式为(2)工业生产中常用FeS除去工业废水中的
 ,则
,则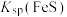
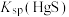 (填“>”或“<”),该反应的离子方程式为
(填“>”或“<”),该反应的离子方程式为(3)工业合成气一般是指CO和
 的混合气体,是一种化工原料气,合成气的来源范围很广,如利用二氧化碳与甲烷催化重整可制得合成气:
的混合气体,是一种化工原料气,合成气的来源范围很广,如利用二氧化碳与甲烷催化重整可制得合成气:
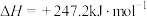 ,则该反应在
,则该反应在(4)41℃时,水的离子积常数
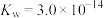 ,该温度时,测得某浓度的稀硫酸中
,该温度时,测得某浓度的稀硫酸中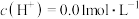 ,则该稀硫酸的pH=
,则该稀硫酸的pH=
 。
。
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题。
(1)已知:正丁烷(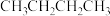 )和异丁烷[
)和异丁烷[ ]的燃烧热
]的燃烧热 分别为-2878
分别为-2878 、-2869
、-2869 。由此推知,25℃、101
。由此推知,25℃、101 时,正丁烷转化为异丁烷是
时,正丁烷转化为异丁烷是___________ (填“吸热过程”或“放热过程”),写出表示异丁烷燃烧热的热化学方程式:___________ 。
(2)已知:25℃、101 时,
时,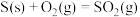
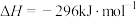 ,则4g硫粉在
,则4g硫粉在 中完全燃烧生成
中完全燃烧生成 气体,放出
气体,放出___________  的热量。
的热量。
(3)二氧化硫的催化氧化反应常使用含钒物质来提高反应速率。下图为有、无催化剂时该反应[

 ]的能量变化示意图,则使用催化剂的曲线为
]的能量变化示意图,则使用催化剂的曲线为___________ (填“实线”或“虚线”),该反应的
___________ (用含a、b的代数式表示)。

(4)已知 与
与 反应生成
反应生成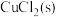 和一种黑色固体。在25℃、101
和一种黑色固体。在25℃、101 下,该反应每转移2
下,该反应每转移2
 ,放热88.8
,放热88.8 ,则该反应的热化学方程式是
,则该反应的热化学方程式是___________ 。
(1)已知:正丁烷(
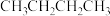 )和异丁烷[
)和异丁烷[ ]的燃烧热
]的燃烧热 分别为-2878
分别为-2878 、-2869
、-2869 。由此推知,25℃、101
。由此推知,25℃、101 时,正丁烷转化为异丁烷是
时,正丁烷转化为异丁烷是(2)已知:25℃、101
 时,
时,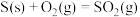
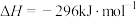 ,则4g硫粉在
,则4g硫粉在 中完全燃烧生成
中完全燃烧生成 气体,放出
气体,放出 的热量。
的热量。(3)二氧化硫的催化氧化反应常使用含钒物质来提高反应速率。下图为有、无催化剂时该反应[


 ]的能量变化示意图,则使用催化剂的曲线为
]的能量变化示意图,则使用催化剂的曲线为

(4)已知
 与
与 反应生成
反应生成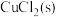 和一种黑色固体。在25℃、101
和一种黑色固体。在25℃、101 下,该反应每转移2
下,该反应每转移2
 ,放热88.8
,放热88.8 ,则该反应的热化学方程式是
,则该反应的热化学方程式是
您最近一年使用:0次
名校
3 . 根据已知,回答下列问题。
(1)已知:0.3mol气态高能燃料乙硼烷( )在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式
)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式___________ 。
(2)在25℃、101kPa下,1g甲烷燃烧生成 和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为
和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________ 。
(3)已知: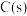 与水蒸气反应制取水煤气(一氧化碳和氢气)时,每转移
与水蒸气反应制取水煤气(一氧化碳和氢气)时,每转移 个电子)吸收65.75kJ的热量。写出该反应的热化学方程式
个电子)吸收65.75kJ的热量。写出该反应的热化学方程式___________ 。
(4)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数(KJ·mol-1)
根据键能数据计算以下反应的反应热 :
:
 =
=___________ 。
(5)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、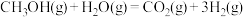
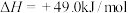
B、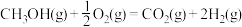
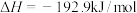
由上述方程式可知,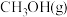 的燃烧热
的燃烧热___________ (填“大于”、“等于”或“小于”)192.9kJ/mol
(6)火箭的常规燃料是液态四氧化二氮和液态肼( ),
), 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:
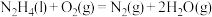
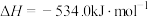
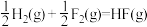
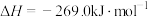
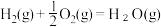
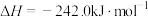
请写出肼和氟气反应的热化学方程式:___________ 。
(1)已知:0.3mol气态高能燃料乙硼烷(
 )在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式
)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式(2)在25℃、101kPa下,1g甲烷燃烧生成
 和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为
和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为(3)已知:
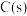 与水蒸气反应制取水煤气(一氧化碳和氢气)时,每转移
与水蒸气反应制取水煤气(一氧化碳和氢气)时,每转移 个电子)吸收65.75kJ的热量。写出该反应的热化学方程式
个电子)吸收65.75kJ的热量。写出该反应的热化学方程式(4)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数(KJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 |  | 565 |
 | 436 |  | 391 |  | 158 |
 :
:
 =
=(5)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、
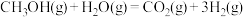
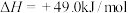
B、
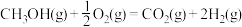
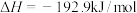
由上述方程式可知,
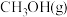 的燃烧热
的燃烧热(6)火箭的常规燃料是液态四氧化二氮和液态肼(
 ),
), 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。已知:
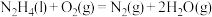
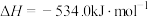
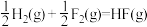
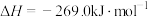
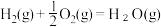
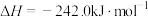
请写出肼和氟气反应的热化学方程式:
您最近一年使用:0次
2023-10-22更新
|
505次组卷
|
3卷引用:河南省洛阳市宜阳县第一高级中学2023-2024学年高二上学期清北园第六次能力达标测试化学试题
4 . 请按要求用化学用语作答。
(1)已知 在氧气中燃烧完全转化为S单质放出
在氧气中燃烧完全转化为S单质放出 热量,完全转化为
热量,完全转化为 放出
放出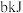 热量,写出表示
热量,写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式_______ 。
(2)明矾[化学式为 ]可以作净水剂的原因是
]可以作净水剂的原因是_______ (用离子方程式表示)。
(3)已知 是一种一元酸,写出它的正盐水解的离子方程式
是一种一元酸,写出它的正盐水解的离子方程式_______ 。
(4) 溶液可通过调节
溶液可通过调节 改变颜色,原因是
改变颜色,原因是_______ (用离子方程式表示)。
(5)将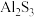 固体放入水中,写出该反应的化学方程式
固体放入水中,写出该反应的化学方程式_______ 。
(1)已知
 在氧气中燃烧完全转化为S单质放出
在氧气中燃烧完全转化为S单质放出 热量,完全转化为
热量,完全转化为 放出
放出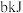 热量,写出表示
热量,写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式(2)明矾[化学式为
 ]可以作净水剂的原因是
]可以作净水剂的原因是(3)已知
 是一种一元酸,写出它的正盐水解的离子方程式
是一种一元酸,写出它的正盐水解的离子方程式(4)
 溶液可通过调节
溶液可通过调节 改变颜色,原因是
改变颜色,原因是(5)将
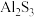 固体放入水中,写出该反应的化学方程式
固体放入水中,写出该反应的化学方程式
您最近一年使用:0次
名校
5 . 燃烧值是单位质量的燃料完全燃烧时所放出的热量。已知一些燃料的燃烧值如下:
注:反应产物中的水为液态。
回答下列问题:
(1)CO的燃烧热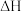 =
=___________  •mol-1.
•mol-1.
(2)表示CH4燃烧热的热化学方程式是___________ 。
(3)①在相同状况下,CO、H2和CH4完全燃烧产生的热量相同时,消耗的CO、H2和CH4中体积最小的是___________ (填化学式),理由是___________ 。
②若13.3gCH4完全燃烧产生的热量与13.3gCO、H2的混合气体完全燃烧产生的热量相同,则混合气体中CO的质量为___________ g。
③44.8L(标准状况)CH4、CO和H2的混合气体完全燃烧生成等物质的量的CO2气体和液态水,则放出热量的范围___________ kJ。
| 燃料 | CO | H2 | CH4 |
| 燃烧值/(kJ·g-1) | 10.1 | 143.1 | 55.6 |
注:反应产物中的水为液态。
回答下列问题:
(1)CO的燃烧热
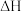 =
= •mol-1.
•mol-1.(2)表示CH4燃烧热的热化学方程式是
(3)①在相同状况下,CO、H2和CH4完全燃烧产生的热量相同时,消耗的CO、H2和CH4中体积最小的是
②若13.3gCH4完全燃烧产生的热量与13.3gCO、H2的混合气体完全燃烧产生的热量相同,则混合气体中CO的质量为
③44.8L(标准状况)CH4、CO和H2的混合气体完全燃烧生成等物质的量的CO2气体和液态水,则放出热量的范围
您最近一年使用:0次
6 . 有科学家预言,氢能将成为21世纪的主要能源之一,而且是一种理想的绿色能源。
(1)氢能被称为绿色能源的原因是____ (只答一点即可)。
(2)在101kPa下,1gH2完全燃烧生成液态水放出143.9kJ的热量,请回答下列问题:
①该反应的生成物总能量____ (填“大于”“小于”或“等于”)反应物总能量。
②氢气的燃烧热为_____ 。
③该反应的热化学方程式为____ 。
④若1molH2完全燃烧生成1mol气态水放出241kJ的热量,已知H-O的键能为463kJ·mol-1,H-H的键能为436kJ·mol-1,计算O=O的键能为_____ kJ·mol-1。
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) △H1=-72.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1;
MgNi2(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3=_____ kJ·mol-1。
(1)氢能被称为绿色能源的原因是
(2)在101kPa下,1gH2完全燃烧生成液态水放出143.9kJ的热量,请回答下列问题:
①该反应的生成物总能量
②氢气的燃烧热为
③该反应的热化学方程式为
④若1molH2完全燃烧生成1mol气态水放出241kJ的热量,已知H-O的键能为463kJ·mol-1,H-H的键能为436kJ·mol-1,计算O=O的键能为
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) △H1=-72.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1;
MgNi2(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3=
您最近一年使用:0次
名校
解题方法
7 . 研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。
(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。
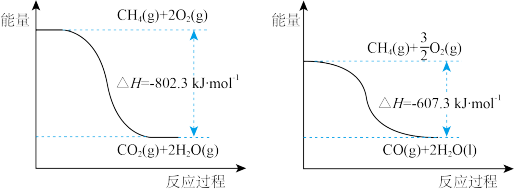
①写出表示甲烷燃烧热的热化学方程式:_______ 。
②CO的燃烧热△H=_______ kJ·mol-1。
(2)已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为_______ 。
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。
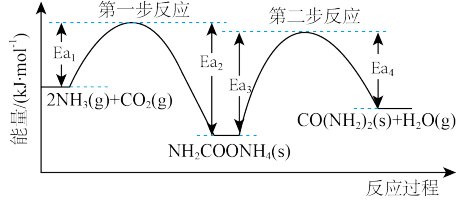
①第一步反应的热化学方程式为_______ 。
②第二步反应的△H_______ 0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第_______ 步反应。
(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:
②CO的燃烧热△H=
(2)已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。

①第一步反应的热化学方程式为
②第二步反应的△H
③从图象分析决定生产尿素的总反应的反应速率的步骤是第
您最近一年使用:0次
2022-09-06更新
|
804次组卷
|
6卷引用:河南省濮阳市2021-2022学年高二上学期期末学业质量监测化学试题
名校
8 . 金刚石和石墨燃烧,氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。
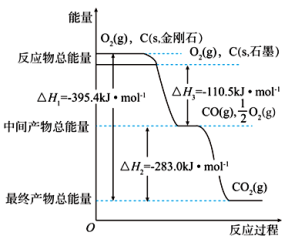
(1)在通常状况下,金刚石和石墨中___________ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH为___________ 。
(2)当10g丁烷完全燃烧生成CO2和液态水时,放出热量为500kJ,写出表示丁烷燃烧热的热化学方程式:___________ 。
(3)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1;N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为___________ kJ·mol-1。
(4)由盖斯定律结合下述反应方程式,回答问题:
已知:①C(s)+O2(g)=CO2(g) ΔH1; ②2CO(g)+O2(g)=2CO2(g) ΔH2;③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3;则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=___________ 。(列出关于ΔH1、ΔH2、ΔH3的表达式)

(1)在通常状况下,金刚石和石墨中
(2)当10g丁烷完全燃烧生成CO2和液态水时,放出热量为500kJ,写出表示丁烷燃烧热的热化学方程式:
(3)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1;N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为
(4)由盖斯定律结合下述反应方程式,回答问题:
已知:①C(s)+O2(g)=CO2(g) ΔH1; ②2CO(g)+O2(g)=2CO2(g) ΔH2;③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3;则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
您最近一年使用:0次
名校
9 . 根据所给信息及要求填空。
(1)已知CH3OH(l)的燃烧热ΔH1,CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH2,则ΔH2
O2(g)=CO2(g)+2H2(g) ΔH2,则ΔH2_____ ΔH1(填“>”、“<”或“=”)。
(2)1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热量,写出甲烷燃烧热的热化学方程式:___ 。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为____ 。
(4)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=xkJ•mol-1
已知:碳的燃烧热 ΔH1=akJ•mol-1
S(s)+2K(s)=K2S(s) ΔH2=bkJ•mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=ckJ•mol-1,则x为____ kJ/mol。
(1)已知CH3OH(l)的燃烧热ΔH1,CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH2,则ΔH2
O2(g)=CO2(g)+2H2(g) ΔH2,则ΔH2(2)1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热量,写出甲烷燃烧热的热化学方程式:
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为
(4)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=xkJ•mol-1
已知:碳的燃烧热 ΔH1=akJ•mol-1
S(s)+2K(s)=K2S(s) ΔH2=bkJ•mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=ckJ•mol-1,则x为
您最近一年使用:0次
2022-08-24更新
|
345次组卷
|
2卷引用:河南省禹州市高级中学2022-2023学年高二上学期第一次月考化学试题
名校
10 . 用相关化学反应原理解释下列问题。
(1)请用离子方程式表示热纯碱溶液除油污原理_______ 。
(2)请解释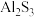 不能通过水溶液的离子反应制备,其原因是
不能通过水溶液的离子反应制备,其原因是_______ 。
(3)氯碱工业原理_______ 。
(4)难溶物ZnS作沉淀剂除去废水中 ,写出该过程的离子方程式
,写出该过程的离子方程式_______ 。
(5)将0.3mol的气态高能燃料乙硼烷( )在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为
)在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_______ 。
(1)请用离子方程式表示热纯碱溶液除油污原理
(2)请解释
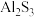 不能通过水溶液的离子反应制备,其原因是
不能通过水溶液的离子反应制备,其原因是(3)氯碱工业原理
(4)难溶物ZnS作沉淀剂除去废水中
 ,写出该过程的离子方程式
,写出该过程的离子方程式(5)将0.3mol的气态高能燃料乙硼烷(
 )在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为
)在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为
您最近一年使用:0次



