1 . ①H2O(l)=H2(g)+ O2(g) ΔH=+285.8kJ·mol-1
O2(g) ΔH=+285.8kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
③C(s)+ O2(g)=CO(g) ΔH=-110.5kJ·mol-1
O2(g)=CO(g) ΔH=-110.5kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是___________ 。(填序号)
(2)H2的燃烧热为___________ 。
(3)燃烧10gH2生成液态水,放出的热量为___________ 。
 O2(g) ΔH=+285.8kJ·mol-1
O2(g) ΔH=+285.8kJ·mol-1②H2(g)+
 O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1③C(s)+
 O2(g)=CO(g) ΔH=-110.5kJ·mol-1
O2(g)=CO(g) ΔH=-110.5kJ·mol-1④C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是
(2)H2的燃烧热为
(3)燃烧10gH2生成液态水,放出的热量为
您最近半年使用:0次
2 . 在25℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:___________ 。
您最近半年使用:0次
解题方法
3 . 依据叙述,按要求填空
(1)在25℃、101kPa下,1g甲醇(CH3OH液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________ 。
(2)11.2L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5kJ热量,其热化学方程式:___________ 。
(3)已知1molC(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3kJ热量,请写出该反应的热化学方程式:___________ 。
(4)甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1=+92.09kJ/mol
氧化法:CH3OH(g)+ O2(g)=HCHOg+H2O(g) △H2
O2(g)=HCHOg+H2O(g) △H2
已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ/mol,则△H2=___________ 。
(1)在25℃、101kPa下,1g甲醇(CH3OH液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
(2)11.2L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5kJ热量,其热化学方程式:
(3)已知1molC(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3kJ热量,请写出该反应的热化学方程式:
(4)甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1=+92.09kJ/mol
氧化法:CH3OH(g)+
 O2(g)=HCHOg+H2O(g) △H2
O2(g)=HCHOg+H2O(g) △H2已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ/mol,则△H2=
您最近半年使用:0次
4 . 填空
(1)硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:_____ 。反应III为_____ (选填“吸热”或“放热”)反应。
(2)在25℃、101kpa下,1g甲烷燃烧生成CO2和液态水时放热22.68kJ。则表示甲烷燃烧的热化学方程式为_____ 。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____ 。
(1)硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
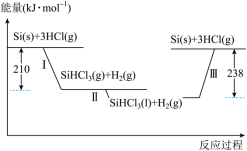
(2)在25℃、101kpa下,1g甲烷燃烧生成CO2和液态水时放热22.68kJ。则表示甲烷燃烧的热化学方程式为
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
您最近半年使用:0次
名校
5 . 请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为___________ (填“吸热”或“放热”)反应,其中ΔH=___________ (用含有a、b的关系式表示)。___________ 114.6kJ(填“大于”、“等于”或“小于”)。
(3)在25℃,101kPa下,16g的N2H4(g)完全燃烧生成氮气和液态水时放热316kJ,则表示N2H4(g)燃烧热的热化学方程式为___________ 。
(4)甲醇(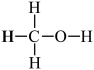 )既是重要的化工原料,又可作为燃料。利用水煤气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的反应为:CO(g)+2H2(g)
)既是重要的化工原料,又可作为燃料。利用水煤气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的反应为:CO(g)+2H2(g) CH3OH(g) ΔH。已知反应中相关的化学键键能数据如下:H-H键键能为436kJ/mol;C-O键键能为343kJ/mol;H-O键键能为463kJ/mol;H-C键键能为413kJ/mol;CO中的化学键键能为1071kJ/mol。计算该反应的ΔH=
CH3OH(g) ΔH。已知反应中相关的化学键键能数据如下:H-H键键能为436kJ/mol;C-O键键能为343kJ/mol;H-O键键能为463kJ/mol;H-C键键能为413kJ/mol;CO中的化学键键能为1071kJ/mol。计算该反应的ΔH=___________ 。
(1)如图表示某反应的能量变化关系,则此反应为
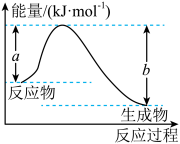
(3)在25℃,101kPa下,16g的N2H4(g)完全燃烧生成氮气和液态水时放热316kJ,则表示N2H4(g)燃烧热的热化学方程式为
(4)甲醇(
 )既是重要的化工原料,又可作为燃料。利用水煤气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的反应为:CO(g)+2H2(g)
)既是重要的化工原料,又可作为燃料。利用水煤气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的反应为:CO(g)+2H2(g) CH3OH(g) ΔH。已知反应中相关的化学键键能数据如下:H-H键键能为436kJ/mol;C-O键键能为343kJ/mol;H-O键键能为463kJ/mol;H-C键键能为413kJ/mol;CO中的化学键键能为1071kJ/mol。计算该反应的ΔH=
CH3OH(g) ΔH。已知反应中相关的化学键键能数据如下:H-H键键能为436kJ/mol;C-O键键能为343kJ/mol;H-O键键能为463kJ/mol;H-C键键能为413kJ/mol;CO中的化学键键能为1071kJ/mol。计算该反应的ΔH=
您最近半年使用:0次
名校
6 . 已知下列反应:i.

ii.
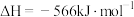
iii.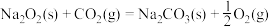

(1)CO的燃烧热
___________ 。
(2)根据上述信息,写出一氧化碳与过氧化钠在催化剂的作用下生成固体碳酸钠的热化学方程式___________ 。


ii.

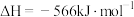
iii.
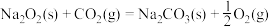

(1)CO的燃烧热

(2)根据上述信息,写出一氧化碳与过氧化钠在催化剂的作用下生成固体碳酸钠的热化学方程式
您最近半年使用:0次
7 . 将化学知识系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:从不同的角度,化学反应可以有不同的分类方法。
(1)四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在下图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。___________
(2)反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)。
问题3:化学反应中均伴随着能量的变化。
(3)如果一个化学反应中,反应物的总能量和生成物的总能量有如图所示的关系,则该反应过程中的能量变化是___________ (填“吸热”或“放热”)。
C(g) + O2(g)= CO2 (g) H=-393.5KJ/mol
H=-393.5KJ/mol
H2 (g) + O2 (g)= H2O (l)
O2 (g)= H2O (l)  H=-285.8KJ/mol
H=-285.8KJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是___________ (保留1位小数)。
问题4:化学反应的发生是有条件的。
(5)反应物相同,反应的条件不同,反应的原理不同。如:4Na+O2=2Na2O、2Na+O2 Na2O2;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:
Na2O2;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:
反应物相同,反应物的浓度不同,反应的原理不同:___________ 。
问题1:从不同的角度,化学反应可以有不同的分类方法。
(1)四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在下图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。

(2)反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)。
| 序号 | 实际生产中采取的措施 | 工业生产实例(写名称) |
| (1) | 通过增大压强提高原料转化率 | |
| (2) | 使用催化剂增大反应的速率 |
问题3:化学反应中均伴随着能量的变化。
(3)如果一个化学反应中,反应物的总能量和生成物的总能量有如图所示的关系,则该反应过程中的能量变化是
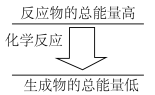
C(g) + O2(g)= CO2 (g)
 H=-393.5KJ/mol
H=-393.5KJ/molH2 (g) +
 O2 (g)= H2O (l)
O2 (g)= H2O (l)  H=-285.8KJ/mol
H=-285.8KJ/mol试通过计算说明等质量的氢气和碳燃烧时产生热量的比是
问题4:化学反应的发生是有条件的。
(5)反应物相同,反应的条件不同,反应的原理不同。如:4Na+O2=2Na2O、2Na+O2
 Na2O2;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:
Na2O2;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同:
您最近半年使用:0次
名校
8 .  、
、 的燃烧热为
的燃烧热为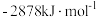 ,写出丁烷的燃烧热的热化学方程式:
,写出丁烷的燃烧热的热化学方程式:_______ 。
 、
、 的燃烧热为
的燃烧热为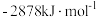 ,写出丁烷的燃烧热的热化学方程式:
,写出丁烷的燃烧热的热化学方程式:
您最近半年使用:0次
名校
解题方法
9 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为_______ 。
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。_________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______ 。(填“变大”“变小”或“不变”)
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=__________ 。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
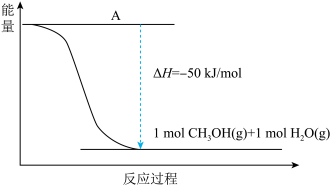
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=
您最近半年使用:0次
解题方法
10 . 已知:①2H2(g)+O2(g) =2H2O(l),ΔH1=-572 kJ·mol-1
②2H2O2(l) = 2H2O(l)+O2(g),ΔH2=-196 kJ·mol-1
1.请写出生产H2O2总反应的热化学方程式___________ 。
2.反应①中的ΔH1___________ (选填: A.是 B.否)为H2的燃烧热,原因为___________ 。
3.H2O2沸点为150.2℃,受热容易分解。某试剂厂欲将7%的过氧化氢溶液浓缩成30%的溶液,以下方法中可以采用的是___________。
②2H2O2(l) = 2H2O(l)+O2(g),ΔH2=-196 kJ·mol-1
1.请写出生产H2O2总反应的热化学方程式
2.反应①中的ΔH1
3.H2O2沸点为150.2℃,受热容易分解。某试剂厂欲将7%的过氧化氢溶液浓缩成30%的溶液,以下方法中可以采用的是___________。
| A.常压蒸馏 | B.减压蒸馏 | C.加热蒸发 | D.加氧化钙除水 |
您最近半年使用:0次



