名校
1 . 能源是人类生存和发展的重要支柱。研究和有效地开发新能源有重要意义。已知CH3CH2CH2CH3(g)与CH3CH(CH3)CH3(g)的燃烧过程如图所示:

已知:H2O(g)=H2O(l) ΔH=-41kJ·mol-1.请根据以上信息,回答下列有关问题:
(1)图形中E表示CH3CH2CH2CH3(g)燃烧反应逆反应的___________ 。
(2)CH3CH2CH2CH3(g)与CH3CH(CH3)CH3(g)的热稳定性___________ 更高。
(3)表示CH3CH(CH3)CH3(g)燃烧热的热化学方程式为___________ 。
(4)CH3CH2CH2CH3(g)转化为CH3CH(CH3)CH3(g)的热化学反应方程式为___________ 。
(5)如表所示是部分化学键的键能参数:
合成气(CO和H2的混合气体)可以合成CH3CH2CH2CH3(g),同时生成H2O(g),则合成1molCH3CH2CH2CH3(g)的ΔH=___________ 。
(6)标准状况,CH3CH2CH2CH3(g)与CH3CH(CH3)CH3(g)的混合气体11.2L,充分燃烧后,生成H2O(g)和CO2(g),共放出1333.8kJ热量,则混合气体中CH3CH2CH2CH3(g)与CH3CH(CH3)CH3(g)的物质的量之比为___________ 。

已知:H2O(g)=H2O(l) ΔH=-41kJ·mol-1.请根据以上信息,回答下列有关问题:
(1)图形中E表示CH3CH2CH2CH3(g)燃烧反应逆反应的
(2)CH3CH2CH2CH3(g)与CH3CH(CH3)CH3(g)的热稳定性
(3)表示CH3CH(CH3)CH3(g)燃烧热的热化学方程式为
(4)CH3CH2CH2CH3(g)转化为CH3CH(CH3)CH3(g)的热化学反应方程式为
(5)如表所示是部分化学键的键能参数:
| 化学键 | C≡O | C—H | H—H | C—C | H—O |
| 键能/(kJ·mol-1) | a | b | d | e | f |
(6)标准状况,CH3CH2CH2CH3(g)与CH3CH(CH3)CH3(g)的混合气体11.2L,充分燃烧后,生成H2O(g)和CO2(g),共放出1333.8kJ热量,则混合气体中CH3CH2CH2CH3(g)与CH3CH(CH3)CH3(g)的物质的量之比为
您最近一年使用:0次
名校
2 . 写出下列反应的热化学方程式。
(1)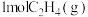 与适量
与适量 反应,生成
反应,生成 和
和 ,放出
,放出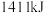 的热量
的热量___________ 。
(2) 完全燃烧生成氮气和气态水时,放出
完全燃烧生成氮气和气态水时,放出 热量
热量___________ 。
(3)1g碳与适量水蒸气反应生成CO和 ,吸收
,吸收 热量
热量___________ 。
(4)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,请写出表示硫的燃烧热的热化学方程式:___________ 。
(5)如图是298 K、101 kPa时,CO2和NH3合成尿素[CO(NH2)2]的能量变化图,写出该反应的热化学方程式:___________ 。

(1)
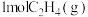 与适量
与适量 反应,生成
反应,生成 和
和 ,放出
,放出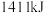 的热量
的热量(2)
 完全燃烧生成氮气和气态水时,放出
完全燃烧生成氮气和气态水时,放出 热量
热量(3)1g碳与适量水蒸气反应生成CO和
 ,吸收
,吸收 热量
热量(4)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,请写出表示硫的燃烧热的热化学方程式:
(5)如图是298 K、101 kPa时,CO2和NH3合成尿素[CO(NH2)2]的能量变化图,写出该反应的热化学方程式:

您最近一年使用:0次
名校
3 . 生产生活中的化学反应都伴随能量的变化,请用学到的有关知识回答下列问题:
(1)制作有降温、保鲜和镇痛的冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热盒饭”可利用下面___________ (填字母序号)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水 C.钠和水
(3)CH3OH是优质液体燃料,在25℃、101 kPa下,充分燃烧1 g CH3OH并恢复到原状态,会释放22.7 kJ的热量。请写出表示CH3OH燃烧热的热化学反应方程式:___________ 。
(1)制作有降温、保鲜和镇痛的冷敷袋可以利用
(2)“即热盒饭”可利用下面
A.生石灰和水 B.浓硫酸和水 C.钠和水
(3)CH3OH是优质液体燃料,在25℃、101 kPa下,充分燃烧1 g CH3OH并恢复到原状态,会释放22.7 kJ的热量。请写出表示CH3OH燃烧热的热化学反应方程式:
您最近一年使用:0次
名校
4 . I.按要求完成下列题目:
(1)下列反应中,属于吸热反应的是________ (填字母)。
(2)已知氢气的燃烧热为285.8kJ/mol,写出表示氢气燃烧热的热化学方程式:________ 。
(3)利用中和热实验装置测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol•L-1的盐酸,则还需加入________ (填序号)。
A.1.0gNaOH固体
B.50mL0.50mol•L-1NaOH溶液
C.50mL0.55mol•L-1NaOH溶液
II.回答下列问题:
(4)在体积为1L密闭容器中充入3molCO2(g)和9molH2(g),发生反应2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。

①反应到达3min时,v正________ v逆(填“>”“<”或“=”)。
②0~5min内,v(CO2)=________ mol•L-1•min-1。
③反应达到平衡状态时,CH3OCH3(g)的体积分数为________ %(保留1位小数)。
④a、b、c三点中代表达到平衡的是________ 。
(1)下列反应中,属于吸热反应的是
| A.碳与水蒸气反应 | B.氧化钙和水反应 |
| C.CaCO3受热分解 | D.锌与盐酸反应 |
(2)已知氢气的燃烧热为285.8kJ/mol,写出表示氢气燃烧热的热化学方程式:
(3)利用中和热实验装置测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol•L-1的盐酸,则还需加入
A.1.0gNaOH固体
B.50mL0.50mol•L-1NaOH溶液
C.50mL0.55mol•L-1NaOH溶液
II.回答下列问题:
(4)在体积为1L密闭容器中充入3molCO2(g)和9molH2(g),发生反应2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
①反应到达3min时,v正
②0~5min内,v(CO2)=
③反应达到平衡状态时,CH3OCH3(g)的体积分数为
④a、b、c三点中代表达到平衡的是
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题
(1)甲醇是人们开发和利用的一种新能源。已知:
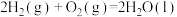
 kJ/mol
kJ/mol
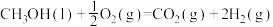
 kJ/mol
kJ/mol
①由上述方程可知甲醇的燃烧热为___________ ;
②上述第二个反应的能量变化如图所示,则
___________ kJ/mol。(用 、
、 的相关式子表示);
的相关式子表示);
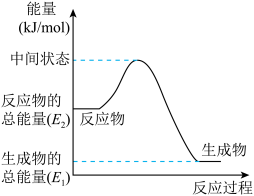
(2)已知反应
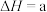 kJ/mol,试根据表中所列键能数据估算
kJ/mol,试根据表中所列键能数据估算
___________ 。
(3)1 mol 和1 mol
和1 mol  完全燃烧放出的热量分别为:286 kJ、890 kJ,等质量的
完全燃烧放出的热量分别为:286 kJ、890 kJ,等质量的 和
和 完全燃烧放出的热量,
完全燃烧放出的热量,___________ (填化学式)放出的热量多。
(4)火箭推进器中盛有强还原剂液态肼( )和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
①写出该反应的热化学方程式:___________ 。
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___________ 。
(1)甲醇是人们开发和利用的一种新能源。已知:
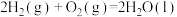
 kJ/mol
kJ/mol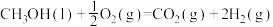
 kJ/mol
kJ/mol①由上述方程可知甲醇的燃烧热为
②上述第二个反应的能量变化如图所示,则

 、
、 的相关式子表示);
的相关式子表示);
(2)已知反应

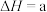 kJ/mol,试根据表中所列键能数据估算
kJ/mol,试根据表中所列键能数据估算
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
(3)1 mol
 和1 mol
和1 mol  完全燃烧放出的热量分别为:286 kJ、890 kJ,等质量的
完全燃烧放出的热量分别为:286 kJ、890 kJ,等质量的 和
和 完全燃烧放出的热量,
完全燃烧放出的热量,(4)火箭推进器中盛有强还原剂液态肼(
 )和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。①写出该反应的热化学方程式:
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
您最近一年使用:0次
2023-10-12更新
|
536次组卷
|
5卷引用:四川省成都外国语学校2023-2024学年高二上学期10月月考化学试题
名校
6 . Ⅰ. 盐酸跟
盐酸跟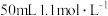 氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)___________ (填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。
(2)回答下列问题:
若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1___________ ΔH (填写<、>、=);若测得该反应放出的热量为2.84kJ,请写出盐酸与NaOH溶液反应的中和热的热化学方程式:___________
Ⅱ.已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(3)写出表示甲烷燃烧热的热化学方程式为___________ 。
(4)发射卫星可用肼做燃料,四氧化二氮做氧化剂,两者反应生成氮气和水蒸气。已知:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=___________ 。
(5)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol-1,O=O键能为498kJ·mol-1,计算H-H键能为___________ kJ·mol-1。
 盐酸跟
盐酸跟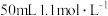 氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)
(2)回答下列问题:
若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1
Ⅱ.已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(3)写出表示甲烷燃烧热的热化学方程式为
(4)发射卫星可用肼做燃料,四氧化二氮做氧化剂,两者反应生成氮气和水蒸气。已知:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=
(5)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol-1,O=O键能为498kJ·mol-1,计算H-H键能为
您最近一年使用:0次
名校
7 . 化学反应中常伴随着能量变化,请按要求回答问题:
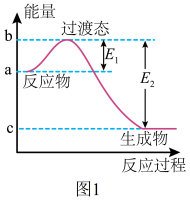
(1)1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图如图1所示,已知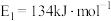 ,
, ,NO2和CO反应的热化学方程式为
,NO2和CO反应的热化学方程式为_______ 。
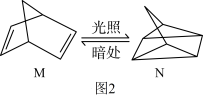
(2)有机物M经过太阳光光照可转化成N,转化过程如图2所示: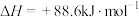 ,分则M、N相比,较稳定的是
,分则M、N相比,较稳定的是_______ 。
(3)25℃、101kPa时,56gCO在足量的O2中充分燃烧,放出565.2kJ热量,则CO的燃烧热为
_______ 。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料, ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为_______ kJ。
(5)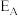 、
、 、
、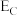 、
、 分别表示A(g)、B(g)、C(g)、D(g)所具有的能量,则对于反应:
分别表示A(g)、B(g)、C(g)、D(g)所具有的能量,则对于反应:
_______  (用含
(用含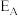 、
、 、
、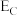 、
、 的代数式表示)。
的代数式表示)。
(6)合成氨反应的能量变化如下图所示,则反应
_______  。
。
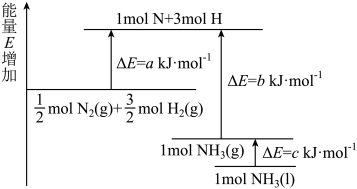
(7)用50mL0.50mol/L盐酸与50mL0.65mol/LNaOH溶液进行中和反应的反应热的测定实验,测得酸、碱初始温度的平均值为25.0℃,反应过程中监测到最高温度的平均值为28.4℃,实验中盐酸和氢氧化钠溶液的密度均可取为 ,反应后溶液的比热容
,反应后溶液的比热容 。则生成1mol液态水时,反应热
。则生成1mol液态水时,反应热
_______  (
(保留三位有效数字 )。
(1)1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图如图1所示,已知
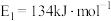 ,
, ,NO2和CO反应的热化学方程式为
,NO2和CO反应的热化学方程式为
(2)有机物M经过太阳光光照可转化成N,转化过程如图2所示:
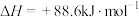 ,分则M、N相比,较稳定的是
,分则M、N相比,较稳定的是
(3)25℃、101kPa时,56gCO在足量的O2中充分燃烧,放出565.2kJ热量,则CO的燃烧热为

(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为(5)
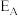 、
、 、
、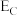 、
、 分别表示A(g)、B(g)、C(g)、D(g)所具有的能量,则对于反应:
分别表示A(g)、B(g)、C(g)、D(g)所具有的能量,则对于反应:
 (用含
(用含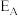 、
、 、
、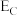 、
、 的代数式表示)。
的代数式表示)。(6)合成氨反应的能量变化如下图所示,则反应

 。
。
(7)用50mL0.50mol/L盐酸与50mL0.65mol/LNaOH溶液进行中和反应的反应热的测定实验,测得酸、碱初始温度的平均值为25.0℃,反应过程中监测到最高温度的平均值为28.4℃,实验中盐酸和氢氧化钠溶液的密度均可取为
 ,反应后溶液的比热容
,反应后溶液的比热容 。则生成1mol液态水时,反应热
。则生成1mol液态水时,反应热
 (
(
您最近一年使用:0次
2023-05-29更新
|
176次组卷
|
2卷引用:四川省什邡中学2023-2024学年高二上学期10月月考化学试题
名校
8 . 回答下列问题
(1)已知C(s,石墨)═C(s,金刚石), ;则稳定性:金刚石
;则稳定性:金刚石___________ (填“>”或“<”)石墨。
(2)已知: ;
; ,则
,则
___________ (填“>”或“<”) 。
。
(3) 、
、 时,
时,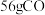 在足量的
在足量的 中充分燃烧,放出
中充分燃烧,放出 热量。则
热量。则 的燃烧热为
的燃烧热为
___________ 。
(4) 溶液与
溶液与 溶液完全反应,放出
溶液完全反应,放出 热量,该反应的中和热
热量,该反应的中和热
___________ 。
(5)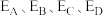 分别表示
分别表示 所具有的能量,则对于反应:
所具有的能量,则对于反应: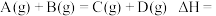
___________ (用含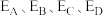 的代数式表示)。
的代数式表示)。
(6)合成氨反应的能量变化如下图所示,则反应
___________ 。

(1)已知C(s,石墨)═C(s,金刚石),
 ;则稳定性:金刚石
;则稳定性:金刚石(2)已知:
 ;
; ,则
,则
 。
。(3)
 、
、 时,
时,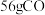 在足量的
在足量的 中充分燃烧,放出
中充分燃烧,放出 热量。则
热量。则 的燃烧热为
的燃烧热为
(4)
 溶液与
溶液与 溶液完全反应,放出
溶液完全反应,放出 热量,该反应的中和热
热量,该反应的中和热
(5)
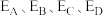 分别表示
分别表示 所具有的能量,则对于反应:
所具有的能量,则对于反应: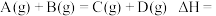
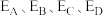 的代数式表示)。
的代数式表示)。(6)合成氨反应的能量变化如下图所示,则反应


您最近一年使用:0次
2023-03-21更新
|
624次组卷
|
2卷引用:四川省成都市第七中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
9 . I.根据下列叙述写出相应的热化学方程式:
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫燃烧的热化学方程式:_______ 。
(2)在1.01×105Pa时,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,表示氢气燃烧热的热化学方程式为_______ 。
(3)1mol N2与适量的O2起反应生成NO2,吸收68kJ热量,反应的热化学方程式为_______ 。
II.请对下列变化分类:
①过氧化钠与水反应;②碳酸氢钠受热分解;③食物腐烂;④酒精燃烧;⑤液态水变成水蒸气;⑥生石灰与水作用制熟石灰;⑦胆矾加热失去结晶水;⑧铝片遇浓硫酸钝化。
(4)属于放热反应的有:_______ (填序号,下同)。
(5)属于吸热反应的有:_______ 。
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫燃烧的热化学方程式:
(2)在1.01×105Pa时,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,表示氢气燃烧热的热化学方程式为
(3)1mol N2与适量的O2起反应生成NO2,吸收68kJ热量,反应的热化学方程式为
II.请对下列变化分类:
①过氧化钠与水反应;②碳酸氢钠受热分解;③食物腐烂;④酒精燃烧;⑤液态水变成水蒸气;⑥生石灰与水作用制熟石灰;⑦胆矾加热失去结晶水;⑧铝片遇浓硫酸钝化。
(4)属于放热反应的有:
(5)属于吸热反应的有:
您最近一年使用:0次
解题方法
10 . 完成下列问题
(1)保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促使燃料循环使用的构想,其原理如图所示。回答下列问题:

①过程Ⅰ发生的反应为反应_______ (填“吸热”或“放热”),反应过程中能量的主要转化形式为_______ ;
②上述转化过程中,△H1+△H2_______ 0(填“>”“<”或“=”)。
(2)以NH3、CO2为原料生产尿素[CO(NH2)2]的反应历程与能量变化如图所示。回答下列问题:

①以NH3、CO2为原料生产尿素[CO(NH2)2]的热化学方程式为_______ ;
②从图像分析该反应分两步进行,则决定生产尿素的总反应速率的步骤是第_______ 步反应(填“一”或“二”)。
(3)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-544 kJ/mol的部分键能数据如下表所示:
①物质的稳定性O2(g)_______ N2(g)(填“>”“<”或“=”);
②若H2O(l)=H2O(g) △H=+44 kJ/mol,则N2H4(g)的燃烧热为_______ ;
③已知:N2(g)+2O2(g)=2NO2(g) △H=+68 kJ/mol,则N2H4(g)和NO2(g)反应生成氮气和水蒸气的热化学方程式为_______ 。
(1)保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促使燃料循环使用的构想,其原理如图所示。回答下列问题:

①过程Ⅰ发生的反应为反应
②上述转化过程中,△H1+△H2
(2)以NH3、CO2为原料生产尿素[CO(NH2)2]的反应历程与能量变化如图所示。回答下列问题:

①以NH3、CO2为原料生产尿素[CO(NH2)2]的热化学方程式为
②从图像分析该反应分两步进行,则决定生产尿素的总反应速率的步骤是第
(3)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-544 kJ/mol的部分键能数据如下表所示:
| 化学键 | N-N | O=O | N≡N |
| 键能(kJ/mol) | 193 | 497 | 946 |
②若H2O(l)=H2O(g) △H=+44 kJ/mol,则N2H4(g)的燃烧热为
③已知:N2(g)+2O2(g)=2NO2(g) △H=+68 kJ/mol,则N2H4(g)和NO2(g)反应生成氮气和水蒸气的热化学方程式为
您最近一年使用:0次



