名校
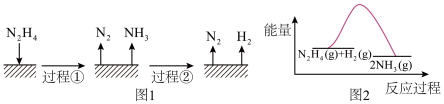
1 . 肼 在不同条件下分解产物不同,200℃时在
在不同条件下分解产物不同,200℃时在 表面分解的机理如图1。
表面分解的机理如图1。
已知200℃时:反应 I : =
=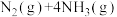
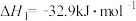
反应II: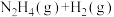 =
=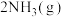
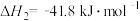
下列说法不正确的是( )
 在不同条件下分解产物不同,200℃时在
在不同条件下分解产物不同,200℃时在 表面分解的机理如图1。
表面分解的机理如图1。已知200℃时:反应 I :
 =
=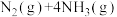
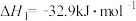
反应II:
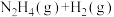 =
=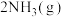
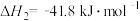

下列说法不正确的是( )
A.200℃时,肼分解生成氮气和氢气的热化学方程式为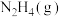 = =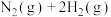 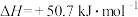 |
| B.反应Ⅱ的能量过程示意图如图2所示 |
C.断开3 mol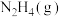 中的化学键吸收的能量大于形成1 mol 中的化学键吸收的能量大于形成1 mol 和4 mol 和4 mol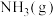 中的化学键释放的能量 中的化学键释放的能量 |
| D.图l所示过程①是放热反应 |
您最近一年使用:0次
名校
解题方法
2 . (1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
由此计算上述反应的反应热△H=___________ kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________ (用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________ ,O2的转化率为___________ (用百分数表示,且保留小数点后一位),该反应的平衡常数为___________ (列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________
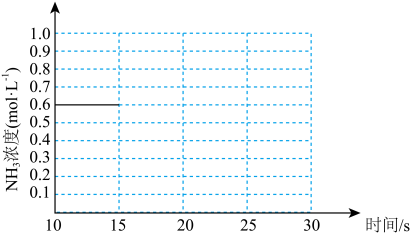
(3)下列有关该反应的说法正确的是___________ (填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________ 。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查阅资料可得有关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。

(3)下列有关该反应的说法正确的是
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:
您最近一年使用:0次
2019-02-07更新
|
473次组卷
|
3卷引用:【市级联考】山西省晋中市2019届高三上学期1月高考适应性考试理科综合化学试题
名校
3 . 科学家最近研究出一种环保,安全的储氢方法,其原理可表示为NaHCO3+H2 HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( )
 HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( )| A.储氢、释氢过程均有能量变化 |
| B.储氢过程中,NaHCO3被还原 |
| C.NaHCO3、HCOONa均含有离子键和共价键 |
| D.释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2 |
您最近一年使用:0次



