1 . “一碳化学”的研究对象为含有一个碳原子的物质,如CO、CO2、CH4等,“一碳化学”在消除二氧化碳排放、有效降低全球变暖风险中具有十分广泛的应用。请完成下列各题:。
(1)CH4与CO2反应可获得应用广泛的合成气(CO和H2):CH4+CO2=2CO+2H2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-820kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=_______ kJ·mol-1。其正反应的活化能为EakJ·mol-1,则逆反应的活化能为_______ kJ·mol-1。该反应自发进行的条件是_______ (填“高温”“低温”或“任意条件”)。
(2)一定条件下,将CO2与H2的混合气体通过催化剂可实现将CO2转变为二甲醚(CH3OCH3)(g),同时有H2O(g)生成。在某压强下,在不同温度、不同投料比时,CO2与H2反应生成二甲醚的反应中,CO2的平衡转化率如图甲所示:
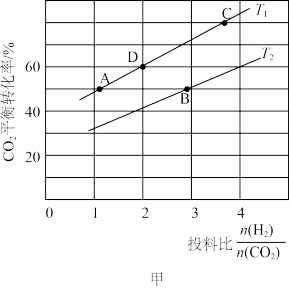
①写出该反应的化学方程式:_______ 。
②T1温度下,在2L密闭容器中充入18mol原料气,5min后反应达到D点,则0~5min内的平均反应速率v(CH3OCH3)=_______ 。
③若T1<T2,则反应的ΔH_______ (填“<”“>”或“=”)0;T1温度下D点所对应反应的平衡常数为_______ (保留两位小数);KA、KB、KC三者之间的大小关系为_______ 。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图乙所示:
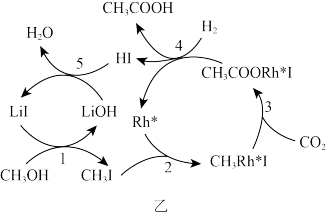
①根据图示,写出总反应的化学方程式:_______ 。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:_______ 。
(1)CH4与CO2反应可获得应用广泛的合成气(CO和H2):CH4+CO2=2CO+2H2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-820kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=
(2)一定条件下,将CO2与H2的混合气体通过催化剂可实现将CO2转变为二甲醚(CH3OCH3)(g),同时有H2O(g)生成。在某压强下,在不同温度、不同投料比时,CO2与H2反应生成二甲醚的反应中,CO2的平衡转化率如图甲所示:

①写出该反应的化学方程式:
②T1温度下,在2L密闭容器中充入18mol原料气,5min后反应达到D点,则0~5min内的平均反应速率v(CH3OCH3)=
③若T1<T2,则反应的ΔH
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图乙所示:

①根据图示,写出总反应的化学方程式:
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:
您最近一年使用:0次
2 . 造成大气污染的NOx、SO2主要来自于汽车尾气及工厂废气的排放,对其进行处理是我们研究的重要课题。
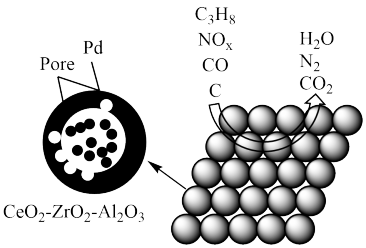
(1)某汽车安装的尾气净化装置工作原理如图所示。下列叙述错误的是_______(填字母)。
(2)已知:2C(s)+O2(g) 2CO(g) ΔH1=-221.0kJ·mol-1
2CO(g) ΔH1=-221.0kJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
则用焦炭还原NO生成无污染气体的热化学方程式为_______ 。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
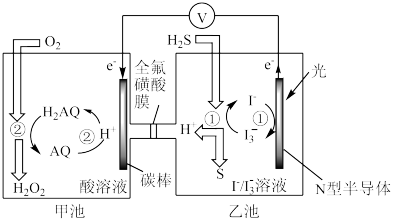
①装置中H+向_______ 池迁移。
②写出乙池溶液中发生反应的离子方程式_______ 。
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和 的吸收液,反应的离子方程式为
的吸收液,反应的离子方程式为_______ ;现采用电解法将上述吸收液中的 转化为无毒物质,同时再生Ce4+,其原理如图所示。
转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_______ (填字母代号)口流出。
②写出阴极的电极反应式:_______ 。
(1)某汽车安装的尾气净化装置工作原理如图所示。下列叙述错误的是_______(填字母)。

| A.Pd-Pore催化剂可提高尾气净化反应的平衡转化率 |
| B.NOx的生成主要是与汽油燃烧不充分有关 |
| C.在此变化过程中,NOx被还原 |
| D.在催化剂的作用下,CO、NOx、C3H8都转化为无毒的物质 |
 2CO(g) ΔH1=-221.0kJ·mol-1
2CO(g) ΔH1=-221.0kJ·mol-1N2(g)+O2(g)
 2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g) ΔH2=+180.5kJ·mol-12NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1则用焦炭还原NO生成无污染气体的热化学方程式为
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向
②写出乙池溶液中发生反应的离子方程式
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和
 的吸收液,反应的离子方程式为
的吸收液,反应的离子方程式为 转化为无毒物质,同时再生Ce4+,其原理如图所示。
转化为无毒物质,同时再生Ce4+,其原理如图所示。
①Ce4+从电解槽的
②写出阴极的电极反应式:
您最近一年使用:0次
2022-08-20更新
|
148次组卷
|
2卷引用:山西省怀仁市第一中学2021-2022学年高三上学期期中理科综合化学试题
3 . 回答下列问题:
(1)将5mL0.005mol/L的 溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
①若滴加1mol/LKSCN溶液4滴,平衡___________ (填“正向”“不”或“逆向”,②同)移动,溶液红色___________ 。
②若滴加3滴浓KCl溶液,则平衡___________ 移动。
(2)火箭发射时可以用肼( ,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol
,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol 在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
在上述反应中放出64.22kJ的热量,该反应的热化学方程式为___________ 。
(3)在探究温度对化学平衡影响的实验中。已知,绿色 水溶液中存在如下平衡:
水溶液中存在如下平衡: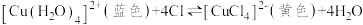
 ,加热的实验现象是溶液变为
,加热的实验现象是溶液变为___________ 色,由此得出的结论是___________ 。
(4)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得了诺贝尔化学奖。
①工业上合成氨反应的化学方程式为___________ 。
②用 分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列)
分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列) ___________
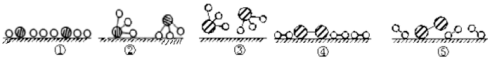
状态①、②、④中,能量最高的状态是___________ 。
(1)将5mL0.005mol/L的
 溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。
溶液与5mL0.01mol/L的KSCN溶液混合,建立平衡。①若滴加1mol/LKSCN溶液4滴,平衡
②若滴加3滴浓KCl溶液,则平衡
(2)火箭发射时可以用肼(
 ,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol
,液态)为燃料,过氧化氢(液态)作氧化剂,两者反应生成氮气和水蒸气,已知0.05 mol 在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
在上述反应中放出64.22kJ的热量,该反应的热化学方程式为(3)在探究温度对化学平衡影响的实验中。已知,绿色
 水溶液中存在如下平衡:
水溶液中存在如下平衡: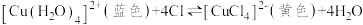
 ,加热的实验现象是溶液变为
,加热的实验现象是溶液变为(4)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得了诺贝尔化学奖。
①工业上合成氨反应的化学方程式为
②用
 分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列)
分别表示N2、H2、NH3。观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列) 
状态①、②、④中,能量最高的状态是
您最近一年使用:0次
名校
解题方法
4 .  捕获技术用于去除气流中的
捕获技术用于去除气流中的 或者分离出
或者分离出 作为气体产物,其中
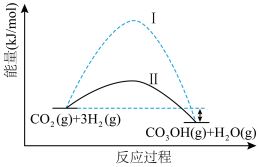
作为气体产物,其中 催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
(1)温度为523 K时,测得上述反应中生成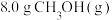 放出的热量为12.3 kJ。反应的热化学方程式为
放出的热量为12.3 kJ。反应的热化学方程式为___________ 。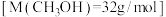
(2)从图可知,有催化剂存在的是过程___________ (填“Ⅰ”或“Ⅱ”)。
(3)一定温度下(各物质均为气态),向体积为2 L的恒容密闭容器中充入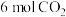 和
和 ,加入合适催化剂进行反应。某时刻测得
,加入合适催化剂进行反应。某时刻测得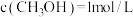 ,此时反应
,此时反应___________ (填“正向移动”、“逆向移动”或“达到平衡)。已知该温度下反应的化学平衡常数值为1/40.
(4)关于 催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
(5)制备过程中存在副反应: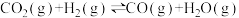
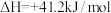 将混合气按进料比
将混合气按进料比 通入反应装置,选择合适催化剂发生反应。不同温度和压强下,
通入反应装置,选择合适催化剂发生反应。不同温度和压强下, 平衡产率和
平衡产率和 平衡转化率分别如图1、图2。
平衡转化率分别如图1、图2。
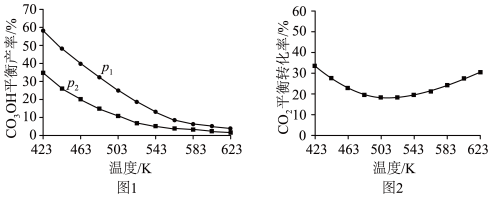
①图1中,压强
___________  (填“>”“=”或“<”),推断的依据是
(填“>”“=”或“<”),推断的依据是___________ 。
②图2中,压强为 ,温度高于503 K后,
,温度高于503 K后, 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是___________ 。
 捕获技术用于去除气流中的
捕获技术用于去除气流中的 或者分离出
或者分离出 作为气体产物,其中
作为气体产物,其中 催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
(1)温度为523 K时,测得上述反应中生成
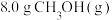 放出的热量为12.3 kJ。反应的热化学方程式为
放出的热量为12.3 kJ。反应的热化学方程式为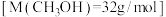
(2)从图可知,有催化剂存在的是过程
(3)一定温度下(各物质均为气态),向体积为2 L的恒容密闭容器中充入
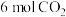 和
和 ,加入合适催化剂进行反应。某时刻测得
,加入合适催化剂进行反应。某时刻测得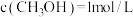 ,此时反应
,此时反应(4)关于
 催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。| A.该反应原子转化率为100% |
B.该反应可用于 的转化,有助于缓解温室效应 的转化,有助于缓解温室效应 |
C.使用催化剂可以降低该反应的 ,从而使反应放出更多热量 ,从而使反应放出更多热量 |
D.降温分离液态甲醇和水,将剩余气体重新通入反应器,可提高 与 与 的利用率 的利用率 |
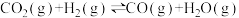
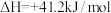 将混合气按进料比
将混合气按进料比 通入反应装置,选择合适催化剂发生反应。不同温度和压强下,
通入反应装置,选择合适催化剂发生反应。不同温度和压强下, 平衡产率和
平衡产率和 平衡转化率分别如图1、图2。
平衡转化率分别如图1、图2。
①图1中,压强

 (填“>”“=”或“<”),推断的依据是
(填“>”“=”或“<”),推断的依据是②图2中,压强为
 ,温度高于503 K后,
,温度高于503 K后, 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是
您最近一年使用:0次
2021-11-15更新
|
181次组卷
|
2卷引用:山西省介休市第十中学2022-2023学年高二上学期 期中考试化学试题
5 . 碳的单质及化合物在人类生产生活中起着非常重要的作用。请回答下列问题:
(1)已知CH3OH(l)的燃烧热 ,
,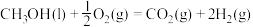
 ,则
,则
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和CO2(g),当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:___________ 。
(3)火箭和导弹表面的薄层是耐高温物质。下列反应可制得耐高温材料,热化学方程式为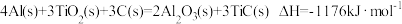 。该反应过程中每转移1mol电子放出的热量为
。该反应过程中每转移1mol电子放出的热量为_________ kJ。
(4)工业上乙烯催化氧化制乙醛的反应原理为: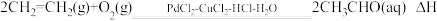 ,该反应原理可以拆解为如下三步反应:
,该反应原理可以拆解为如下三步反应:
I.
II.……
III.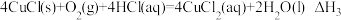
若第II步反应的反应热为 ,且
,且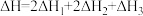 ,则第II步反应的热化学方程式为
,则第II步反应的热化学方程式为__ 。
(5)山西是全国最大的炼焦用煤资源基地,炼焦过程的副产品之一焦炉煤气富含H2、CH4和CO,因此可通过甲烷化反应来提高热值,使绝大部分CO、CO2转化成CH4.甲烷化反应的主要化学原理为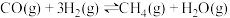 ,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
该反应的
__________  。
。
(1)已知CH3OH(l)的燃烧热
 ,
,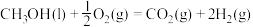
 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和CO2(g),当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:
(3)火箭和导弹表面的薄层是耐高温物质。下列反应可制得耐高温材料,热化学方程式为
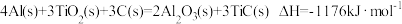 。该反应过程中每转移1mol电子放出的热量为
。该反应过程中每转移1mol电子放出的热量为(4)工业上乙烯催化氧化制乙醛的反应原理为:
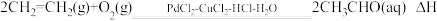 ,该反应原理可以拆解为如下三步反应:
,该反应原理可以拆解为如下三步反应:I.

II.……
III.
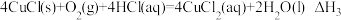
若第II步反应的反应热为
 ,且
,且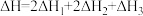 ,则第II步反应的热化学方程式为
,则第II步反应的热化学方程式为(5)山西是全国最大的炼焦用煤资源基地,炼焦过程的副产品之一焦炉煤气富含H2、CH4和CO,因此可通过甲烷化反应来提高热值,使绝大部分CO、CO2转化成CH4.甲烷化反应的主要化学原理为
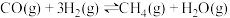 ,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):| 化学键 |  |  |  |  |  |  |
键能/( ) ) | 347.7 | 413.4 | 436 | 351 | 1065 | 462.8 |

 。
。
您最近一年使用:0次



