1 . Ⅰ.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:C(s)+ O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJ•mol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________ 。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:
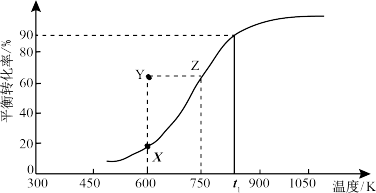
CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
①该反应的ΔH___ 0 (填“>”或“<”);600K时,Y点甲醇的v(正) ____ v(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________ 。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________ , 温度为t1时,该反应的平衡常数K=____________ 。
Ⅱ.金属铜因导电性强而应用广泛。
由黄铜矿冶炼得到的粗铜经过电解精炼才能得到纯铜。电解时,粗铜作______ 极,阴极的电极反应式为_______________ 。
Ⅲ.含铜离子的的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使铜离子的浓度符合排放标准(不超过0.5mg/L),溶液中的硫离子的物质的量浓度至少为__________ mol/L(保留至小数点后一位)。
(1)已知:C(s)+
 O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJ•mol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:
CH3OH(g)
 HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。①该反应的ΔH
②从Y点到X点可采取的措施是
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=
Ⅱ.金属铜因导电性强而应用广泛。
由黄铜矿冶炼得到的粗铜经过电解精炼才能得到纯铜。电解时,粗铜作
Ⅲ.含铜离子的的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使铜离子的浓度符合排放标准(不超过0.5mg/L),溶液中的硫离子的物质的量浓度至少为
您最近一年使用:0次
2018-11-07更新
|
183次组卷
|
3卷引用:【全国百强校】山西省晋中市平遥县平遥中学2019届高三上学期12月月考化学试题
2 . CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______ mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
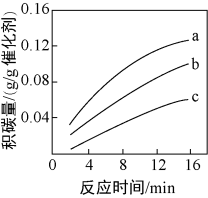
①由上表判断,催化剂X____ Y(填“优于”或“劣于”),理由是_________________ 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________ 填标号)。

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________ 。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ΔH/(kJ·mol−1) | 75 | 172 | |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为

您最近一年使用:0次
2018-06-09更新
|
14150次组卷
|
23卷引用:【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题
【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合(已下线)高考母题题源14 基本概念、基本理论综合二【全国百强校】西藏自治区拉萨中学2019届高三上学期第二次月考理科综合化学试题【校级联考】江西省上饶市“山江湖”协作体2018-2019学年高二上学期第三次月考化学试题(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略【全国百强校】江西省南昌市第十中学2019届高三下学期期中考试(第二次模拟)理科综合化学试题辽宁省实验中学东戴河分校2019-2020学年高二10月月考化学试题四川省宜宾市叙州区第一中学2020届高三上学期开学考试理综化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题山东省2020届高三新高考仿真模拟化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考安徽省临泉第一中学2020-2021学年高二上学期第三次月考化学试题青海省湟川中学2020-2021学年高二上学期期中考试化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练甘肃省临夏县中学2020-2021学年高二上学期期末考试化学试题贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题湖南省长沙县第九中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
3 . 最新研究表明,有毒气体H2S具有参与调节神经信号传递、舒张血管减轻高血压的功能。
(1)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是______ (填标号)。
A.H2S的还原性强于H2SO3
B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1
C.H2S不能与NaHCO3溶液反应,而H2SO3可以
D.等浓度的两种溶液pH值: NaHS > NaHSO3
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知(1)式和(5)式的热化学方程式分别为___________ 、________________ ,制得等量H2所需能量系统I是系统II的_______ 倍。
(3)H2S与CO2在高温下发生反应: H2S(g)+CO2(g) COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
①H2S的平衡转化率a1=_______ %,反应平衡常数K=______________ 。
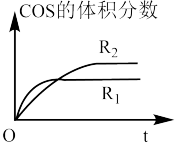
②在不同条件下发生上述反应,COS的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是____________ (填字母序号)CO2的转化率a2__ a1,(填”>”或“<”)
A.压强B.温度C.催化剂
(4)反应开始,保持T1温度,2L钢瓶中充入0.08molCO2、0.40molH2S、0.02molCOS和0.02molH2O,则此时V正___ V逆(填”>”或“<”)判断依据是___________________________ 。
(1)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是
A.H2S的还原性强于H2SO3
B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1
C.H2S不能与NaHCO3溶液反应,而H2SO3可以
D.等浓度的两种溶液pH值: NaHS > NaHSO3
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知(1)式和(5)式的热化学方程式分别为
(3)H2S与CO2在高温下发生反应: H2S(g)+CO2(g)
 COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02①H2S的平衡转化率a1=
②在不同条件下发生上述反应,COS的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是
A.压强B.温度C.催化剂

(4)反应开始,保持T1温度,2L钢瓶中充入0.08molCO2、0.40molH2S、0.02molCOS和0.02molH2O,则此时V正
您最近一年使用:0次
2017-12-31更新
|
198次组卷
|
2卷引用:山西省祁县中学2018届高三12月月考化学试题
名校
解题方法
4 . 雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g) △H<O
2CO2(g)+N2(g) △H<O
①反应的速率时间图像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是(填对应字母)__________
B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)__________
已知:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g) N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:__________ .
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2O⇌CO+3H2,该反应在不同温度下的化学平衡常数如表:
①该反应是__________ 反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O CO+3H2的平衡常数K=
CO+3H2的平衡常数K=__________ ;
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。__________
②电解后溶液的pH=__________ (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是__________ L。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO
 2CO2(g)+N2(g) △H<O
2CO2(g)+N2(g) △H<O①反应的速率时间图像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是(填对应字母)

B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)
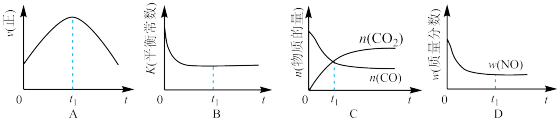
已知:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol2NO2(g)
 N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2O⇌CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O
 CO+3H2的平衡常数K=
CO+3H2的平衡常数K=(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
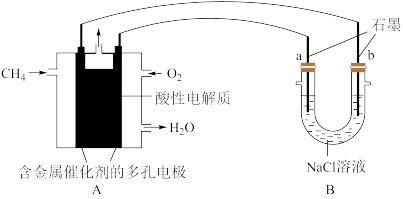
②电解后溶液的pH=
③阳极产生气体的体积在标准状况下是
您最近一年使用:0次
2017-02-17更新
|
377次组卷
|
7卷引用:2016届山西省祁县中学高三5月月考理综化学试卷
真题
名校
5 . 氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
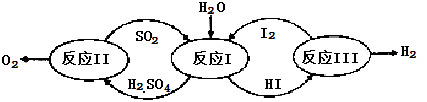
(1)反应Ⅰ的化学方程式是___________ 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是___________ (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是___________ 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是___________ 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
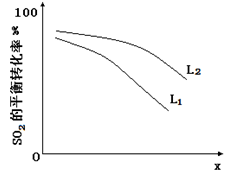
①X代表的物理量是_________________ 。
②判断L1、L2的大小关系,并简述理由:_________________ 。

(1)反应Ⅰ的化学方程式是
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。

①X代表的物理量是
②判断L1、L2的大小关系,并简述理由:
您最近一年使用:0次
2016-12-09更新
|
2438次组卷
|
3卷引用:2016届山西省平遥中学高三第二轮训练三化学试卷



